�咰����@�`���ÃK�C�h���C��
�K�C�h���C�������̕����ԍ�����C�Y�����镶�����X�g�փ����N����܂�
Clinical Questions
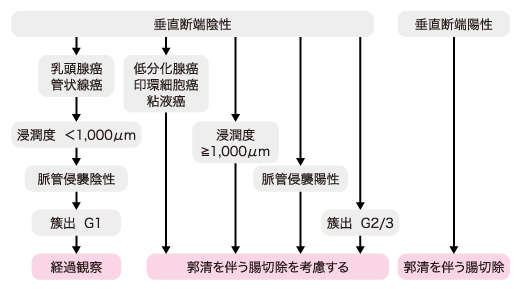
CQ 1�F�������I�E�����ꂽpT1�iSM�j�咰���̒lj����Â̓K����͉����H
- ①�����f�[�z���̏ꍇ�͊O�ȓI�؏���lj����邱�Ƃ��]�܂����B�i�����x�E�G�r�f���X���x��1C�j
- ②�E���W�{�̑g�D�w�I�����ňȉ��̈���q�ł��F�߂�C�lj����ÂƂ��ă����p�ߊs�������؏����l������B�i�G�r�f���X���x��B�j
�i1�jSM �Z���x1,000��m �ȏ�
�i2�j���ǐN�P�z��
�i3�j�ᕪ���B���C��זE���C�S�t��257�j
�i4�j�Z����i�����Əo�ibudding�jGrade 2/3257�j
���j
- �����f�[�z���Ƃ́C�����S�����w�f�[�ɘI�o���Ă�����̂ł���B
- SM �Z���x�́CCQ2�̃T�C�h�����Ɏ������@�Ɋ�Â��đ��肷��B
- ���ǐN�P�Ƃ́C�����p�ǐN�P�ƐÖ��N�P�������iCQ2�̃T�C�h�����Q�Ɓj�B
- �Əo�̕]���@�� CQ2�̃T�C�h�����Ɏ����B
�Z�����ł���pT1�iSM�j���̎��Â̌����̓����p�ߊs�������؏��ł���B�������C�]�ڃ��X�N���ɂ߂ĒႢpT1�iSM�j�������݂��邱�Ƃ������ł���C���̂悤�ȏǗ�ɑ��Č��ʓI�ɂ͉ߏ莡�ÂƂȂ�lj��؏����y�I�Ɍ����邱�Ƃ��{��̍쐬�ړI�ł���B���݂̂Ƃ���C�����p�ߓ]�ځipN�j���m���ɗ\�m�ł���f�f�@�͑��݂��Ȃ����C�]�ڃ��X�N�̍����lj����Î��{�̔��f�ޗ��Ƃ��ė��p���邱�Ƃ��\�ł���B
pT1�iSM�j���̏��������p�ߓ]�ڃ��X�N���q�Ƃ��āC�S�����w�̐Z�������iSM �Z���x�j258, 259�j�C�ᕪ���B���E��זE���E�S�t���Ȃǂ̑g�D�^257�j�C�Z����i���̒ᕪ���̈�E�S�t���߂̑��݁C�Əo�C���ǐN�P�Ȃǂ�����Ă���257, 260�j�B
��L�̒lj����Â̓K����́C�w�咰���戵���K��x�i��2 �ŁC1980 �N�j261�j�ɋL�ڂ���Ă���pT1�iSM�j���̒lj����؏���3 ���ځi①���炩�Ȗ��Ǔ����Z���C②�ᕪ���B�����邢�͖��������C③�f�[�ߖT�܂ł�massive �Ȋ��Z���j�����Ƃɍ쐬���ꂽ���̂ł���C�umassive�Ȋ��Z���v�́w�咰���戵���K��x�̑�5 �Łi1994 �N�j�ɂ����āu���Ƃ��Ζ�200�`300��m�������x�́g����߂ĐZ���h���[���Z���v�Ƌ�̓I�L�q�ɉ������ꂽ262�j�B
���̌�̖{�M�ɂ�����Ǘ�W�ό�������C���̊����1,000��m �܂Ŋg�傷�邱�Ƃ��\�ł��邱�Ƃ������ꂽ263�j�B�咰��������̃v���W�F�N�g�����ɂ���SM �Z���x1,000��m �ȏ�̃����p�ߓ]�ڗ���12.5���ł������i�\11�j258, 259, 263�j�B�������Ȃ���C1,000 ��m �Ȑ[�Z����̂��ׂĂ��lj���p�̐�ΓK���ɂȂ�킯�ł͂Ȃ��BSM �Z���x1,000��m �ȏ�ł����Ă�9 �����x�̓����p�ߓ]�ڂ��Ȃ��킯�ł���CSM �Z���x�ȊO�̃����p�ߓ]�ڊ댯���q�C�X�̏Ǘ�̐g�̓I�E�Љ�I�w�i�C���Ҏ��g�̈ӎv�����\���ɍl�����������Œlj����Â̓K�������肷�邱�Ƃ��d�v�ł���B�Ȃ��C��L�̎��ÓK����̐����̋����ɂ��ẮC�K�C�h���C���ψ��̃R���Z���T�X�������Ă��Ȃ����ߐ����x�͎����Ă��Ȃ��B2009 �N�łŒlj����Â��l�����ׂ����q�Ƃ����Əo�ibudding�j��lj�������18, 23�j�C����ɑ��̕a���g�D�w�I���q�Ɋւ���v���W�F�N�g���������ݐi�s���ł���B���{������������͖{��̑Ó����̌������ʂ�����Ă���10, 264, 265�j�B�Ȃ��C�C�O�ɂ́C�lj����Â̓K����Ƃ��ĐZ������������Əo���̗p����Ă���K�C�h���C���͂Ȃ��B
�k�������I�E�����pT1�iSM�j���̎��Õ��j�l
CQ 2�F�ő�a2 cm �ȏ�̕a�ςɑ���������I�E����Z�̑I����͉����H
�ő�a2 cm �ȏ�̕a�ςɑ���������I�E���@�ɂ�EMR�C����EMR�CESD ������B�������I�E���ɂ������ẮC���m�ȏp�O�������f�f���K�{�����ł���C�p�҂̓������I�E���̋Z�ʂ��l�����ēE���@��I������B�i�����x�E�G�r�f���X���x��1B�j
�B��CcTis�iM�j�������cT1�iSM�j�y�x�Z���a�ς����������Â̂悢�K���ŁCcT1�iSM�j���x�Z�����͕a�ς̑傫���ɍS��炸�K���O�ł���B�E���W�{�̐��m�ȕa���f�f�̂��߂Ɋ��a�ς̈ꊇ�؏����v���ł���C��ʂɃX�l�A�̃T�C�Y����EMR �ňꊇ�E�����\�ȕa�ς͍ő�a2 cm ���x�ł���3�j�B�������C�B������a�ρi�B������j�ł͑B����ł̕��f�ɂ��v��I����EMR�i�������͈ꊇ�؏�����j�̍��������m�F����Ă���3, 266, 267�j�C�ő�a2 cm �ȏ��LST�ilaterally spreading tumor�j�̈ꕔ�͕���EMR �̂悢�K���ƂȂ�268�j�B�������C����EMR �ɂ͊m���ȃX�l�A�����O�Z�p���K�v�ł��邱�Ƃɗ��ӂ��ׂ��ł���C�܂����m�ȑg�D�w�I���肪����ƂȂ�悤�ȑ������؏��͔�����ׂ��ł���269, 270�j�B�Ȃ��C�B��Ɗ����̔��ʂɂ́C�C���W�S�J���~���U�z�ɂ��F�f�������ώ@��g��ώ@�ɂ��pit pattern �f�f���L�p�ł���6, 268�j�BESD ��p����Όa2 cm �ȏ�̕a�ς��ꊇ�E�����\�ł��邪�CESD �͎�Z�̓�x�������C��n���҂��{�s�����ꍇ�́C���E�Ȃǂ̋����ǔ��Ǘ��������Ȃ邱�Ƃ��\���ɍl�����ׂ��ł���3, 267�j�B
�T�C�h����
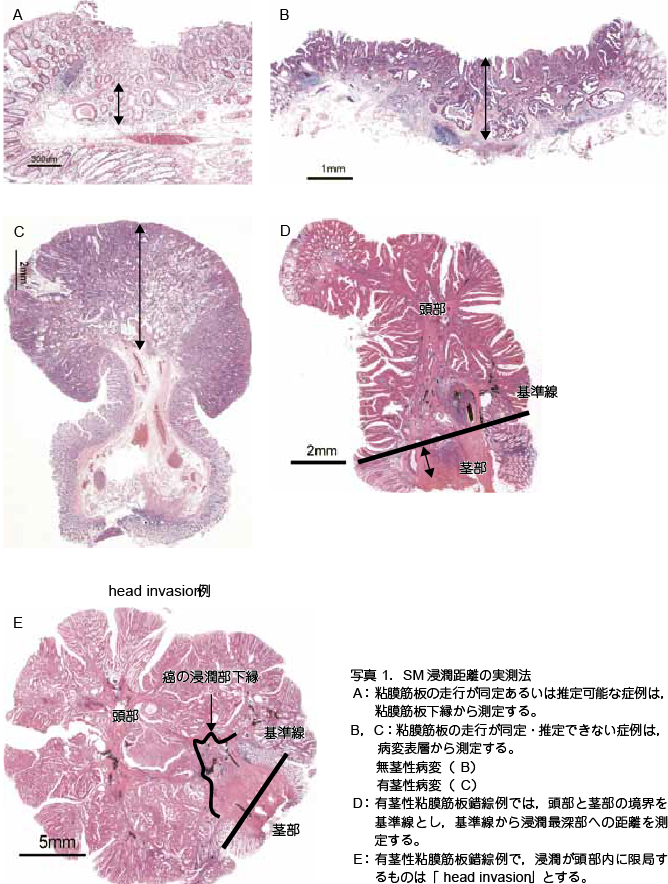
��SM �Z�������̎����@�i�ʐ^ 1�j
- ����^�ɂ�����炸�S���ؔ̑��s������܂��͐���\�ȏǗ�́C�a�ς̔S���ؔ������瑪�肷��
- �S���ؔ̑��s������E����ł��Ȃ������͕a�ϕ\�w���瑪�肷��B
�����ł����u���s������܂��͐���\�v�Ƃ́CSM �Z���ɂ��u�ό`�v�C���Ȃ킿���s�̗���C�𗣁C�f��C�f�Љ��Ȃǂ��Ȃ��S���ؔ��w���B�ό`�����S���ؔ��N�_�Ƃ����SM �Z���������ߏ��]������\��������B�u�ό`�v�̔���͕K�������e�Ղł͂Ȃ����C�S���ؔ��͂�desmoplastic reaction �����̂́u�ό`����v�Ɣ��肷��B - �L�s���a�ςł́C�S���ؔ��������Z�������̎n�_�ƂȂ�S���ؔ�����ł��Ȃ��ꍇ������B���̏ꍇ��SM �Z�������͓����ƌs���̋��i�S���ɂ������ᇂƔ��ᇂ̋��E�j������Ƃ��C��������Z���Ő[���ւ̐Z�������𑪒肷��B�Z�����������Ɍ��ǂ���L�s���a�ς́uhead invasion�v�Ƃ���B
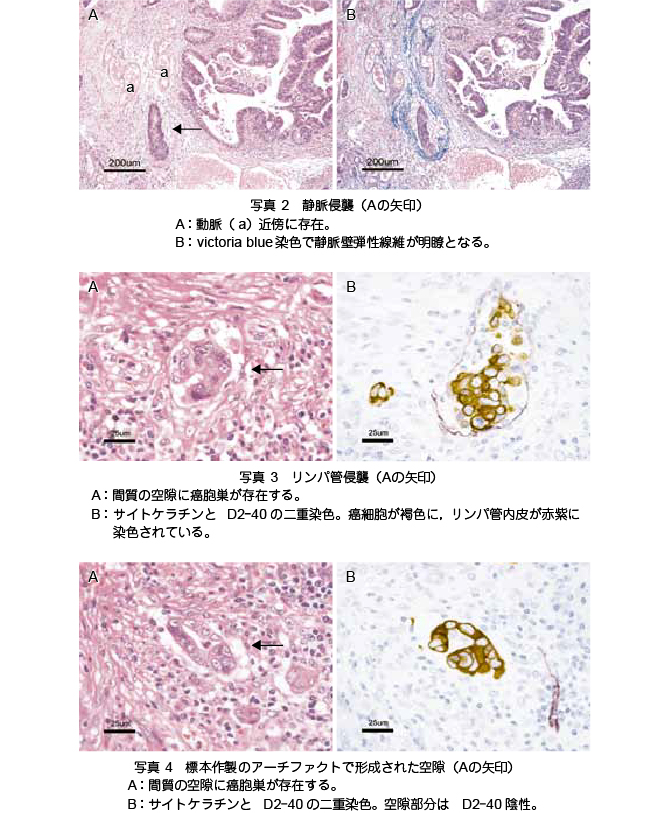
�����ǐN�P�̕]���@�i�ʐ^ 2�`4�j
- �Ö��N�P�̕]���́C�����ɒ��ڂ���̂��|�C���g�ł���B��a�����痣��āC�����̋ߖT�ɑ��݂���Ӊ����ȉ~�`�C�މ~�`�C���ȉ~�`�̊��E���͐Ö��N�P�̉\���������C���͂ɐÖ��Ǎ\���i���e���⌌�ǎ��͕����j���m�F�����ΐÖ��N�P�Ɣ���ł���B�������C�Ö��Ǎ\���͊��Z���ɂ�舳�r�E�������Ă�����CHE ���F�ł͕s���ĉ����Ă��邱�Ƃ����Ȃ��Ȃ��B
- �Ԏ��̋ɑ��݂�����זE�܂��͊��E���̓����p�ǐN�P���^�������ł���B���Ƀ����p�t�C�����p�����[�����Ă���̓����p�ǂł���\���������C�𗠑ł��������זE���m�F���������p�ǂƔ���ł���B�������CHE �W�{�ł͓���זE�̊m�F�͍���ȏꍇ�������C�͕W�{�쐻�ɂ��A�[�`�t�@�N�g�ł��`�������B
- ���̂悤��pT1�iSM�j���̎��Õ��j�����߂�d�v�Ȏw�W�ł��閬�ǐN�P�̕]���́CHE ���F�ł͍���ȏꍇ�����Ȃ��Ȃ��B�Ö��N�P�̕]���ɂ�elastica van Gieson ���F�܂���victoria blue ���F�ɂ��Ö��ǂ̒e�����ۂ̓��肪�C�����p�ǐN�P�̕]���ɂ̓����p�Ǔ���זE�ɑ���Ɖu���F�iD2-40 ���j���L�p�ł���B
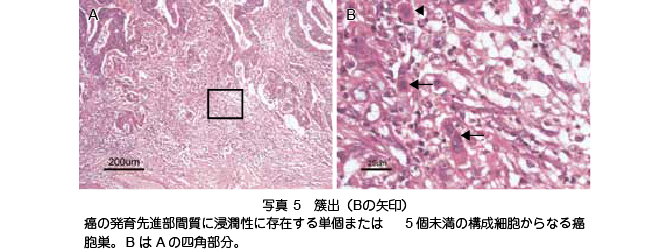
���Əo�̕]���@�i�ʐ^ 5�j
�k�Əo�̒�`�l257�j�������i���Ԏ��ɐZ�����ɑ��݂���P�܂���5 �����̍\���זE����Ȃ���E���B
�k�Əo�� Grade�l�Əo���ł����x�ȗ̈��I����C20�~10 �{����Ŋ������i�����ώ@���C�Əo�̌����J�E���g����B
Grade 1�F0�`4 ��
Grade 2�F5�`9 ��
Grade 3�F10 �ȏ�
- �Əo�́C�����C���̔���l����\������p��ł���C�������i���ɂ����āC①���ς���2�`3 �̕��ɑ�������זE���Ŕ��炷����́C②���זE���X�ɗV�����Ĕ��炷����́C�ƒ�`����Ă���271�j�B�������CpT1�iSM�j���̃����p�ߓ]�ڃ��X�N���q�Ƃ��ẮC��҂́u���זE�̗V������v���d�v�ł���C��҂݂̂��Əo�ƒ�`�����B
- Grade 2/3 �̃����p�ߓ]�ڗ���Grade 1 �����L�ӂɍ����ł���BGrade 1 ��low grade�CGrade 2/3 ��high grade �ƕ��ނ���ƁChigh grade �͓Ɨ����������p�ߓ]�ڂ̗\�����q�ł��邱�Ƃ��咰����������Əo�����v���W�F�N�g�ψ���ɂ�鑽�{�����������疾�炩�ƂȂ���272�j�B
CQ 3�F�咰ESD �ɂ��咰��ᇂ̓������I�E���̒��ӓ_�͉����H
ESD �̓K���́C�u����������ᇁv�ł���C���m�ȏp�O�������f�f�Əp�҂̓������I�E���̋Z�ʂ��l�����Č��肷��B�i�����x�E�G�r�f���X���x��1B�j
�����͐�i�{��273, 274�j�݂̂Ŏ{�s����Ă���ESD �ł��邪�C�ŋ߂͑����̎{�݂Ŏ{�s���� ��悤�ɂȂ��Ă����B
�咰ESD �̗L�����ƈ��S���́C�{�M�̒P�{�݂�case series ������275, 276�j�C���{�݃A���P�[�g����277�j�ɂ�莦����Ă���C�����ǂ̕p�x���������������������Ă���B���{�ݑO���������ɂ��1,111 ��̌�������C��ᇌa5 cm �ȏ�C���{������50 �������̎{�݂ł́C���E��o���Ȃǂ̋����ǔ��Ǘ��������Ȃ�\�����w�E���ꂽ��278�j�C�咰��������u�������E����Z�̕W�����E�v���W�F�N�g�����v�ɓo�^���ꂽ1,845 ��iEMR 1,029 ��CESD 816 ��j�̌�������́C�a4 cm �ȏ�̕a�ςɑ���EMR �̈ꊇ�؏�����12���ł���̂ɑ��āCESD �ł�93���ƍ����C�����ǔ��Ǘ��ɗL�Ӎ��͔F�߂��Ȃ������B�Ȃ��C���Î��Ԃ͌a4 cm �ȏ��ESD ��129 ���ƗL�ӂɒ�������279�j�B2009 �N����J�n���ꂽ���{������������w��哱�́u��i��ÂƂ��Ď{�s���ꂽ�咰ESD �̗L�����ƈ��S���Ɋւ��鑽�{���������i�S��60 �{�݂ɂ��O�����R�z�[�g�����j�v�ŁC�咰ESD �̗L�����ƈ��S�������炩�ƂȂ�C2012 �N4 ���ɁC�u�����咰������ᇁv�ɑ��đ咰ESD �̕ی��K�p���F�߂�ꂽ�B�Ȃ��C���ӎ����Ƃ��āw�ő�a��2 cm ����5 cm �̑��������͑B��ɑ��āC�a�ς��܂ޔ͈͂��ꊇ�Ő؏������ꍇ�ɎZ�肷��B�x�ƕt�L����Ă���B
ESD �͑咰��������Z�ɏ\�����ʂ�����t���C�K�v�Ȋe��f�o�C�X�i�d�C���X�C�~���f�o�C�X�C��[�A�^�b�`�����g�C�q�A�������_�Ȃǂ̋ǒ���273, 274, 280�j�CCO2���C���u281�j�C�N���b�v�Ȃǁj�����C���@��O�ȓI���u���s������ōs���ׂ��ł���B
�ihttp://www.mhlw.go.jp/topics/bukyoku/isei/sensiniryo/kikan01.html �Q�Ɓj
CQ 4�F�咰���ɑ��镠�o������p�͗L�����H
�C�O�̃����_������r������R�N�������r���[�ɂ����āC�����������RS ���ɑ��镠�o������p�̈��S������ђ������т��J����p�Ɣ�r���ē����ł��邱�Ƃ�����Ă���B�������Ȃ���C���o������D3 �s���͓�x�������̂ŁCcStage Ⅱ�`cStage Ⅲ�ɑ��Ă͌X�̎�p�`�[���̏K�n�x���\���ɍl�����ēK�������肷��B�܂��C���s�������C���x�얞��C���x�����������x�ł��邱�Ƃɗ��ӂ���B
�������ɑ��镠�o������p�̗L�����ƈ��S���͏\���Ɋm������Ă��Ȃ��B�K���Ɍv�悳�ꂽ�Տ������Ƃ��Ď��{���邱�Ƃ��]�܂����B�i�����x�E�G�r�f���X���x��1B�j
�C�O�̑�K�̓����_������r������R�N�������r���[�ɂ����āC�����������RS ���ɑ��镠�o������p�̗L�p�����J����p�Ƃ̔�r�Ō�������282-292�j�C���o������p�ł͎�p���Ԃ���������C�o���ʂ����Ȃ��C���lj^���̉������C�݉@���Ԃ��Z���Ȃǂ̒Z�����т��D��Ă��邱��282, 285-288�j�C�����ǔ���������эĔ����E�������͓����ł��邱��284, 286, 289-292�j������Ă���B�������C�Ⴆ��Stage Ⅲ�̊J����p�Q��5 �N��������50���ƒᗦ�ł��邱��282�j�C�E���������p��̋Ǐ��Ĕ�����15���ƍ����ł��邱��292�j�ȂǁC�{�M�̎��Ð��тƂ͘�������������B�킪���̎��Ìo���Ɋ�Â��K�������肷��ɂ́C�O���������ɂ�鑽����̌������K�v�ł���293�j�B
���s�������͑����̃����_������r�����ŏ��O�����Ƃ���Ă���282-284, 293�j�B���s�������ɑ��镠�o������p�͊J����p����������p���Ԃ�v����Ƃ���������294�j�C��U�w�I�����ɂ��x�z���Ǎ������͂̊s����Z�̓�x���l�����ēK�������肷��B���̑��C�얞��͊J����p�ւ̈ڍs���������C��p���Ԃ������C�����Ǘ�����������295, 296�j�C�J����������L����Ǘ�͖����̂��߂ɓ�x�������C�J����p�ւ̈ڍs������������297�j���l������B
�������������̃����_������r�����őΏۊO�ł���282-286�j�C�R�N�������r���[��ʗ����Ă���������ΏۂƂ��������_������r�����͏��Ȃ�287, 291, 292, 298, 299�j�B��������ΏۂƂ���COREAN �����CCOLOR Ⅱ�����ł́C�J����p�Q�ƕ��o������p�Q�ŊO��剝���ʗz�����ɍ��͂Ȃ������ƕ���Ă�����298, 299�j�CMRC CLASICC �����ł́C����������ыǏ��Ĕ����ɂ͗L�Ӎ���F�߂Ȃ����̂�292�j�C�O��剝���ʗz�����͕��o������p�Q�ō����ł�����288, 289�j�B�������ɑ��镠�o������p�́C���ǐؗ��E��������̓�x���������ƁC���o�����̑����s���̎�Z���m������Ă��Ȃ����ƂȂǂ���C�����_�ł͓K���Ɍv�悳�ꂽ�Տ������Ƃ��Ď��{���C�L�����ƈ��S�����m�F����K�v������300�j�B
�ŋ߂ł́C�P�E����p�Ȃǃ|�[�g�������炵�����o������p�����݂��Ă��邪�C�L�����ƈ��S���𑽐���Ō��������͂Ȃ��C�\���Ɋm������Ă��Ȃ��B�����_�ł͓K���Ɍv�悳�ꂽ�Տ������Ƃ��Ď��{����̂��]�܂����B
�咰���ɑ��郍�{�b�g��p�́C����ꂽ�{�݂ɂ����čs���Ă���i�K�ł���C�����_�ł͑咰���ɑ���ی��K���͂Ȃ��B
CQ 5�F�؏��s�\�ȉ��u�]�ڂ�L����Ǘ�Ɍ������؏��͗L�p���H
�؏��s�\�ȉ��u�]�ڂ�L����Ǘ�ɑ��錴�����؏��̗L�p���́C�������ɂ��Ǐ�C���u�]�ڂ̏�ԁC�S�g��ԓ��C�X�̏ɉ����ĈقȂ�B
- ①���̗Ö@�ł͐��䍢��Ȍ������ɂ��Ǐ���C�ߑ�N�P�ƂȂ�Ȃ��؏��ł���C��������؏����đ����ɑS�g���w�Ö@���s�����Ƃ����������B�i�����x�E�G�r�f���X���x��1C�j
- ②�������C�������ɂ��ǏȂ��ꍇ�̌������؏��̗L�p���͊m������Ă��Ȃ��B
�؏��s�\�ȉ��u�]�ڂ�L����咰���̌������؏��̓K���͋c�_�̑������ł���B�ǂ�o���ȂǁC�ۑ��I�Ö@�ł͐��䍢��ȏǏ���ɘa����ړI�ōs���錴�����؏����邢�͐l�H��呢�݂Ȃǂɂ�钰�Nj�u�p�ɂ��Ă͈٘_�����Ȃ�301�j�B
����C���Ǐ�Ȃ����Ǐy���ȏǗ�ɑ���K���ɂ͂��܂��܂ȍl����������B���Ǐ��ɑ��āC�\�������Ǐ�̏o���ɐ�Č������؏����s�����Ƃ̗L�p�������ƂȂ�B���̂悤�ȏǗ�ɑ��C�������؏����s�����ق������w�Ö@���s������萶�����Ԃ��������C�Ǐ�ɑ���ً}�I�ȑΉ�������ł���Ƃ����������������̃��^�A�i���V�X�̕����邪302�j�C����ꂽ�����\��̂Ȃ��Ō������̐؏����Ǐ�ɘa�Ȃǂ�QOL �̉��P�ɂǂ�قNJ�^���邩��\�����邱�Ƃ͗e�Ղł͂Ȃ�303, 304�j�B�{�a�Ԃ͍��x�̐i�s�S����Ԃł���C��p�����ǂ��p���S�̃��X�N���������Ƃ���C��������؏������S�g���w�Ö@���s�����Õ��@���s����305, 306�j�B
�ߔN�������i�������S�g���w�Ö@�ɂ���Đ؏��s�\�ȓ]�ڑ����؏��\�ƂȂ�ǗႪ�o�������悤�ɂȂ�C�Ǐ�ɘa�Ƃ͕ʂɁC����������ɓ��ꂽ�������؏��̈Ӌ`�����������悤�ɂȂ��Ă��Ă���307, 308�j�B�������C����ł͎��ۂɍ����������邱�Ƃ͗�O�I�ł���C�g�̋@�\��Ɖu�\�̒ቺ�������炷��p��������C�L���ȑS�g���w�Ö@���y�I�ɑ����J�n���邱�Ƃ��������̃R���g���[���ɂ��L���ł���Ƃ����l��������309-311�j�B���Ƃ��C���Ǖǂɑ��ẮC�X�e���g���u�̗L�p��������Ă���312-314�j�C�؏��ȊO�̎�i�ɂ��Ǐ�R���g���[�����\�ȏǗႪ���邱�Ƃɂ����ӂ���B
�ȏ���C�������؏��̓K���́C�������̏Ǐ�C�]�ڂ̏�ԁC�S�g��Ԃ̂ق��C�����\��C��p�̃��X�N315�j�C�؏��ɂ��Ǐ�ɘa�̌��ʗ\���Ȃǂ�Տ��I�ȏ𑍍��I�ɔ��f���ďǗႲ�Ƃɕ]�����Č��肷��B
CQ 6�F�����d���F�߂��ꍇ�C�������Ɠ����ɕ����d���؏����邱�Ƃ͗L�p���H
�����d�푃�؏��̗L�p���͏ؖ�����Ă��Ȃ��B���ǐ��d��iP1�CP2�j���������Ɠ����ɐ؏������Ǘ�Œ��������Ⴊ����Ă���C�ߑ�N�P�ƂȂ�Ȃ��؏��ł���C�������Ɠ����ɕ����d���؏����邱�Ƃ��]�܂����B�i�����x�E�G�r�f���X���x��2D�j
�����������d��ɑ���؏��̗L�������ؖ������K�͗Տ������͂Ȃ����C�؏��ɂ��\��̉��P�Ⓑ�������Ⴊ����Ă���27, 316�j�C�ߑ�ȐN�P�킸�ɐ؏��\�ȓ��������ǐ��d��iP1�CP2�j�͌������ƂƂ��ɐ؏����邱�Ƃ��]�܂����B
�َ��������d��ɑ���؏��̗L�p�����ؖ�����Ă��Ȃ��B�������C���̍Ĕ�����F�߂��C���ǂ���d�푃��F�߂��ꍇ�C���w�Ö@���܂ވ��̌o�ߊώ@�̌�ɐ؏����l������ꍇ������B
�C�O����́C�L�͂Ȕd��ɑ���S�����؏��itotal peritonectomy�j317�j������C�S�����؏��ɂ�錸�ʎ�p�ƕ��o�����M���w�Ö@�Ƃ̗L�p��������Ă���318-320�j�B�������Ȃ���C���ۂɖ{�Ö@�����{���Ă���̂͊C�O�ł�����ꂽ��Ë@�ւ݂̂ŁC�{�M�ɂ����Ă͂قƂ�ǎ��Î��т�L���Ȃ��Ö@�ł��邽�߁C��ʂ̈�Ë@�ւŎ��{�ł�����̂ł͂Ȃ��B
CQ 7�F�̓]�ڂƔx�]�ڂ̑o�����ɗL����Ǘ�ɑ���؏��̓K���͉����H
�̓]�ڂƔx�]�ڂ̑o�����ɗL����Ǘ�ɑ���؏��̗L������������Ă���C�؏��\�Ȋ̔x�]�ڂɑ��Ă͐؏����l������B�������C��p�K�����������ɑ���f�[�^�͂Ȃ����ƁC�������͍����Ȃ����ƁC�؏��̗\��\�����q�ipredictive factor�j�͕s���ł��邱�ƂȂǂɊւ���\���ȃC���t�H�[���h�E�R���Z���g��K�v������B�i�����x�E�G�r�f���X���x��2D�j
�������Ɋ̓]�ڂƔx�]�ڂ��Ƃ��ɗL����Ǘ�ł��؏��ɂ�蒷���������邢�͎����������邱�Ƃ�����321-323�j�B�������Ȃ���́E�x�]�ڂ��Ƃ��ɗL����Ǘ�ł͌�������]�ڑ��̐i�W�����x�ł��邱�Ƃ�C�́E�x�ȊO�ɂ��]�ڂ�F�߂邱�Ƃ������C���S�؏��̉\���͈��̌����������Ă��Ȃ��BAdam ��̕ł́C�̂���ъ̊O�a�ς�L����186 ��213 �a�ς̂���108 �a�ρi51���j���x�]�ڂŁC���̂���42 �a�ρi39���j�Ŋ��S�؏����\�ł�����324�j�B���̈���Ŗ{�M�ɂ�����Kobayashi ��̏W�v�ɂ��C351 ��̔x�]�ڐ؏���̂���47 ��Ɋ̓]�ڐ؏����s��ꂽ���C�������Ɋ́E�x�]�ڂ��؏����ꂽ�̂�7 ��i2���j�݂̂ł�����30�j�B���̂悤�Ȋ�����C�́E�x�؏����L���ƂȂ�\��\�����q�͏\���ɂ͉𖾂���Ă��炸�C�������]�ڂ����َ����]�ڂ̂ق����\��ǍD�ł��邪�����_�ł͐؏��Ɋւ��閾�m�ȓK����͂Ȃ�324-326�j�B�p�OCEA ��CA19-9�C���Ĕ����ԁC�̓]�ځE�x�]�ڌ��C�������̐苒���ʁC�N��\����q�Ƃ��ďd�v�ł��邱�ƂȂǂ̕�����93, 324�j�B����C�ߔN��FOLFOX�CFOLFIRI ���͂��߂Ƃ���V�K�R����܂͊́E�x�]�ڏǗ�ɑ����p���тɂ��e����^���Ă���327, 328�j�B
�́E�x�]�ڂ��Ƃ��ɗL����Ǘ�ɑ���O�Ȏ��ÂɊւ��āC����Ă���̂͂��ׂČ����������ł��邪�C�́E�x�]�ڂ̐؏����\����P�Ɋ�^����ǗႪ���̊����ő��݂��邱�Ƃ͊m���ł���C�\��\�����q�𒆐S�Ƃ�����p�K������m�����邱�Ƃ��}���ł���B
CQ 8�F���u�]�ڑ��؏���̕⏕���w�Ö@�͗L�����H
�咰�����u�]�ڑ��؏���̕⏕���w�Ö@�̗L�����ƈ��S���͊m������Ă��Ȃ��B�K���Ɍv�悳�ꂽ�Տ������Ƃ��Ď��{����̂��]�܂����B�i�G�r�f���X���x��C�j
�؏��\�Ȋ̓]�ڂ�x�]�ڂɑ���ł����ʂ��������Ö@�͊O�ȓI�؏��ł���B�������C�]�ڑ��؏���̍Ĕ�����50�`70���ƍ����ł���C��p���Â̎��Ë��x�͏\���Ƃ͌����Ȃ��̂�����ł���B��p���Â̎��Ë��x�̏�悹���ʂ����҂���̂��⏕���w�Ö@�ł��邪�C���̗L�����͏ؖ�����Ă��Ȃ��B
���ǐ��̊̓]�ڂ���x�Ȃǂ֓��]�ڂ��N�����O�Ɏc�̍Ĕ���\�h����Ƃ����l������C�̓����Ö@�����{����Ă��邪�C�c�̍Ĕ��̗}�����ʂ͂�����̂̐������Ԃ̉����ɂ͊�^���Ȃ����Ƃ�������Ă���329-331�j�B
�̐؏���̕⏕�Ö@�Ƃ��Ă̑S�g���w�Ö@�̗L�����������������́C���݂܂ł̂Ƃ����̃����_������r�����iFFCD09002 �����j31�j�ƈ�̓�����́ipooled analysis�j32�j�݂̂ł���BFFCD09002 �����ł́C�����؏����ΏۂɎ�p�P�Ƃ�5-FU�{LV ��p�����S�g���w�Ö@����r����C5 �N���Ĕ��������͉��w�Ö@�Q���L�ӂɗǍD�ł��������C�S�������Ԃɂ͗L�ӂȍ���F�߂Ȃ�����31�j�BENG ���������킹��������͂ł��C���w�Ö@�Q���\��Ɋ֗^���邱�Ƃ������������C�������Ԃɂ͎�p�P�ƂƔ�ׂėL�Ӎ���F�߂Ȃ�����32�j�B�Ȃ��C�咰���x�]�ڐ؏���̕⏕���w�Ö@�Ɋւ��郉���_������r�����͕���Ă��Ȃ��B
�ȏ�̂悤�ɁC���u�]�ڑ������؏��̕⏕���w�Ö@�̗L�����m�Ɏ����G�r�f���X�͔F�߂��Ă��Ȃ��BStage Ⅲ�ɑ���⏕���w�Ö@�̗L�������m�����Ă��錻�݁CStage Ⅲ�����Ĕ����X�N�����炩�ɍ���Stage Ⅳ�ɑ���⏕���w�Ö@�����n�Տ��̏�Ŏ��{���Ă���̂�����ł���B�������C�]�ڑ��؏���Ƃ����a�Ԃɑ���⏕���w�Ö@�̈��S���Ƃ������ʂ��\���ɍl�����ׂ����Ƃ���C���̗L�����ƈ��S����K���Ɍv�悳�ꂽ�Տ�����332�j�Ō�����̂��]�܂����B
���u�]�ڑ��؏���̕⏕���w�Ö@���s��Ȃ����Ƃ̐����̋����ɂ��āC�K�C�h���C���ψ��̃R���Z���T�X��ɂ͎���Ȃ������̂Ő����x�͎����Ă��Ȃ��B
CQ 9�F���w�Ö@���t�����Đ؏��\�ƂȂ����́E�x�]�ڂɑ���؏��͗L�����H
�̂܂��͔x�Ɍ��ǂ����]�ڗ�ʼn��w�Ö@���t�����Đ؏��\�ƂȂ����ꍇ�ɂ͐؏����l�����ׂ��ł���B�i�����x�E�G�r�f���X���x��2D�j
�؏��s�\�Ɣ��f�����̌��Ǔ]�ڗ�ɑ��鉻�w�Ö@�̗L�����ƈ��S���Ɋւ��ẮC���܂��\���ȃG�r�f���X�̏W�ς͂Ȃ���Ă͂��Ȃ��̂�����ł��邪140, 143, 333�j�C�ߔN�C�S�g���w�Ö@��ɍ����؏����\�ɂȂ�ǗႪ���̊����ő��݂��邱�Ƃ��������Ă���37, 38�j�B�܂��C���w�Ö@�̑t�����Ɛ؏����ɂ͖��ڂȊ֘A�����邱�Ƃ�����Ă���334�j�B�S�g���w�Ö@�ɕ��q�W�I������������W�����ō����̓]�ڂ̐؏���������Ă���335�j���C���q�W�I��������Ă��؏����͕ς��Ȃ��Ƃ����336�j������B
���w�Ö@���t�����Đ؏��\�ƂȂ����̓]�ڂɂ͐؏����l������143, 333, 337�j�B�������Ȃ���C���w�Ö@���t�����Đ؏��\�ƂȂ����Ǘ�ł́C�]�ڐf�f������؏��\�Ȋ̓]�ڗ�قǂ̗\��͊��҂ł��Ȃ��Ƃ̕�����338, 339�j�B
����C���w�Ö@���t�����Đ؏��\�ƂȂ����x�]�ڗ�̕͏��Ȃ��C�G�r�f���X�ɖR�������C���w�Ö@��؏��̕����茻���_�ł͐؏����l�����Ă��悢333�j�B
CQ 10�F�������Ǐ��Ĕ��ɑ����p�K���͉����H
�������Ǐ��Ĕ���R0 �؏����\�Ɣ��f�����ꍇ�Ɏ�p���l�����邪�C��p�N�P�ƃ��X�N�C�p���QOL ���l��������œK�������肷�ׂ��ł���B�i�����x�E�G�r�f���X���x��2D�j
�������Ǐ��Ĕ��ɑ��C�O�Ȏ��Âƕ��ː��Ö@���r���������_������r�����͂Ȃ����C�O�Ȏ��×��5 �N��������20�`40���ł���C����ɑ���������ː��Ö@�̎��Ð��т͂Ȃ�340, 341�j�B�؏��\�ȋǏ��Ĕ��ɑ��Ă͐؏����l������B�������CR0 ��ڎw�����؏��ł��C������c�����ꍇ�̗\��͋ɂ߂ĕs�ǂł��邱�ƁC��p�����ǂ̔��������������ƁC���Փ������卜�����؏���QOL �ɑ���ȉe�����y�ڂ��p���ł��邱�Ƃɂ��ď\���ȃC���t�H�[���h�E�R���Z���g�邱�Ƃ��s���ł���B
�������Ĕ��ƑO���Ĕ���R0 �؏��\�Ⴊ������39, 342�j�C����Ĕ��ł�����������؏��ɂ��R0 �؏����\�ƂȂ���̂�����343�j�B�������C��2 �卜������荂�ʂ̐ؒf���K�v�ȍĔ��͎�p�̓K���O�Ƃ���̂���ʓI�ł���343, 344�j�B�卜�_�o�p�Z���ɂ���u�ɂ≺�ڂ̕���C�p�O��CEA ���l�Ȃǂ͗\��s�Lj��q�ł���345, 346�j�B�Ĕ��ɋN�����鐅�t�ǂ�����ꍇ�̗\��͕s�ǂȂ��߁C�t�@�\�C�؏��ɂ�艷���\�ȔA�ǂ̒����Ȃǂ��l�����ēK����T�d�ɔ��f����347-349�j�B�܂��C�����p�ő����s�����s���Ă���Ǘ�̑����Ĕ��ł�R0 �؏����s����\���͒Ⴂ34�j�B
���u�]�ڂ�L����Ǘ�͐؏��̓K���O�Ƃ���̂������ł��邪�C���u�]�ڂ̍����؏��ō�������������ꍇ������350�j�B
��p�⏕�Ö@�Ƃ��ĕ��ː��Ö@�̗L�p�����F�߂��Ă���351, 352�j�C���ɕ��ː����×��̂Ȃ��Ǘ�ł͐؏����C����؉������̌���Ɋ�^���邱�Ƃ�����Ă���353-355�j�B���Ăł͏������̎�p�⏕�Ö@�Ƃ��ĕ��ː��Ö@��p���邱�Ƃ������̂ŁC�Ǐ��Ĕ��ɑ���lj��Ǝ˂̈��S�����뜜����邪�C�Ǝ˖@���H�v���邱�Ƃŕ��ː����×�������Ǐ��Ĕ��ɂ���r�I���S�Ɏ��{�\�Ƃ����356-358�j�B
�ȏォ��C�������Ǐ��Ĕ��ɑ��Ă͊O�Ȏ��Â����I���ł���B�����s���Ƃ����Ǝ��̎��Õ��j�������C���ː����×��̂Ȃ��Ǐ��Ĕ��������{�M�ɂ����āC�ǂ̂悤�ɕ��ː��Ö@�����p���邩���Ŕ��̌����ۑ�ł���B
CQ 11�F�؏��\�̓]�ڂɑ���p�O�⏕���w�Ö@�͗L�����H
�؏��\�̓]�ڂɑ���p�O���w�Ö@�̗L�����ƈ��S���͊m������Ă��Ȃ��B�K���Ɍv�悳�ꂽ�Տ������Ƃ��Ď��{����̂��]�܂����B�i�G�r�f���X���x��D�j
�؏��\�Ȋ̓]�ڂɑ���p�O���w�Ö@�̎傽��ړI�́C��ᇏk���ɔ����̐؏��ʂ̌�����ؗ��[�̊m�ہC�����]�ڑ��̑������ÁC���w�Ö@�̑t��������ł��邪�C��t���Ⴊ�؏��s�\�ƂȂ郊�X�N�C�R����܂ɂ��̏�Q����p�������ǂȂǂ̖�������B
�]���C�p�O���w�Ö@�̑t����̗\�オ�ǍD�ł��邱�Ƃ���������������m���Ă���359, 360�j�B�������Ȃ���C�p�O���w�Ö@�Ǝ�p�P�ƌQ�̊̐؏���̐������Ԃ�O�����ɔ�r���������͂Ȃ��B
�gEORTC�iEuropean Organisation for Research and Treatment of Cancer�j�ł́C�����؏��\�Ȋ̓]�ڂ��咰���ɑ��āC�O�ȓI�؏��P�Ƃ�FOLFOX4 �̏p�O�E�p�㉻�w�Ö@�{�O�ȓI�؏��̃����_������r�����iEORTC40983 �����j���s���CFOLFOX4 �Q�Ŗ������������Ԃ��D��Ă����ƕ��ꂽ361�j���C�ŏI�I��5 �N�S�������͉��w�Ö@�Q��52.4���C��p�P�ƌQ��48.3���ł���S�������ɂ�����FOLFOX4 �Q�̗D�z���͔F�߂��Ȃ������B�ȏ���C�̓]�ڐ؏���ɑ���p�O�E�p��̉��w�Ö@�̗L�p���͊m������Ă��炸���n�Տ��ł̓K���͐T�d�ɔ��f���ׂ��ł���B
�؏��\�Ȋ̓]�ڂɑ��ďp�O���w�Ö@���s��Ȃ����Ƃ̐����̋����ɂ��āC�K�C�h���C���ψ��̃R���Z���T�X��ɂ͎���Ȃ������̂Ő����x�͎����Ă��Ȃ��B
CQ 12�F�̓]�ڑ��ɑ���M�ÌŗÖ@�͗L�����H
- �@�M�ÌŗÖ@�̗L�����������͏��Ȃ����I�����ÂƂ��Ă͐�������Ȃ��B�i�����x�E�G�r�f���X���x��1C�j
- �A�̓]�ڂɑ���M�ÌŗÖ@�͋Ǐ��Ĕ��̃��X�N���������ߐ؏��\�ł���C�܂��؏����l�����ׂ��ł���B
�̎�ᇂɑ�����h�Ǐ��Ö@�ɂ̓G�^�m�[�������@��}�C�N���g�ÌŗÖ@�imicrowave coagulation therapy�FMCT�j�C���W�I�g�ĎܗÖ@�iradiofrequency ablation�FRFA�j������CRFA �͑��̕��@�ɔ�ׂċÌŔ͈͂��L���C���h�����Ȃ����ߊ̓]�ڑ��ɑ��Ă͎��RFA ���p������BRFA �̗��_�͊̐؏�������N�P�ł���C�J��Ԃ��{�s���\�ł��邱�Ƃł���B����������Ă���RFA ��̋Ǐ��Ĕ�����1.7�`66.7��362�j�Ƃ����������̂̊̐؏��������炩�ɍ����C�Ĕ����X�N���l�����C�\���ȃC���t�H�[���h�E�R���Z���g����Ŏ��{����BRFA �̋Ǐ��Ĕ��̊댯���q�Ƃ��Ă͌������̑g�D�^�i�咰���͊̍זE����������ᇂɔ�Ǐ��Ĕ����������j�C��ᇌa���傫���ꍇ�i3 cm ����j�C�Ӊ��̏Ď܂��s�\���ȏꍇ�i�}�[�W��1 cm �����j�C��v���ǂƗאڂ��Ă���ꍇ�Ȃǂ��������Ă���363, 364�j�B5 �N��������14�`55���ƕ�362�j�Ƃ���邪�C�����Ċ̐؏���������̂ł͂Ȃ��B�َ����̓]�ڂɑ���̐؏���RFA �̔�r�ł́CRFA �͍Ĕ��܂ł̊��Ԃ��Z���C�Ǐ��Ĕ�����ъ̓��Ĕ��������i�A���̊O�Ĕ��ł͗L�Ӎ��Ȃ��j���Ƃ�����Ă��邪45, 75�j�C�\���ȏǗᐔ��O�����ɔ�r���������͏��Ȃ��B����C�O�����������s���ꍇ�C���炩�ɍĔ���������RFA �̓K������ǂ̂悤�ɐݒ肷��̂��Ƃ����ϗ��I�Ȗ����N���A����K�v������B
�ȏ���CPS ���ǍD�Ȋ��҂̐؏��\�Ȋ̓]�ڂɑ���W�����Â͊̐؏��ł���B�M�ÌŗÖ@�́C��N�P�ł���Ƃ������_���������āCPS �s�Ǘ��C��b�����╹���ǂ̂��ߐ؏��Ƀ��X�N���ꍇ�ȂǑI�����ꂽ�Ǘ�ɍl������鎡�Ö@�ł���365, 366�j�B
CQ 13�F70 �Έȏ�̍���҂ɏp��⏕���w�Ö@�͗L�p���H
70 �Έȏ�̍���҂ɂ��CPS ���ǍD�Ŏ�v����@�\���ۂ���Ă���C���w�Ö@�ɑ��ă��X�N�ƂȂ�悤�Ȋ�b�����╹���ǂ��Ȃ���C�p��⏕���w�Ö@���s�����Ƃ����������B�i�����x�E�G�r�f���X���x��1 A�j
���Ăōs��ꂽ5-FU �x�[�X�̃����_������r������pooled analysis �Ȃǂ̉�͂���367-369�j�C70 �Έȏ�̊��҂ɂ����Ă��C60 �Έȉ��̊��҂Ɠ����̍Ĕ��}�����ʂƐ������ԉ�����������Ă���B����p�ɂ��ẮC����҂ł͍D���������������o��X���ɂ��邪�C���̗L�Q���ۂɂ��Ă͂قړ����ł���367�j�B�������CNSABP C-07 ������MOSAIC �����ɂ�����T���I�ȃT�u�O���[�v��͂ł�70 �Έȏ�̍���҂ɂ�����OX �lj��̗L�������F�߂��Ă��Ȃ����Ƃɗ��ӂ�122, 370�j�C�K���̔��f�͎�v����@�\��S�g��Ԃ��������ĐT�d�ɍs���K�v������B
CQ 14�FStage Ⅱ�咰���ɏp��⏕���w�Ö@�͎{�s���ׂ����H
Stage�U�咰���ɑ���p��⏕���w�Ö@�̗L�p���͊m�����Ă��炸�C���ׂĂ�Stage Ⅱ�咰���ɑ��Ĉꗥ�ɕ⏕���w�Ö@���s��Ȃ��悤���߂���B�i�����x�E�G�r�f���X���x��1 A�j
3,238 ���̌����E�������iStage Ⅱ��91���Ō�������71���j��ΏۂƂ���5-FU�{LV�i�{/�|�jlevamisole �Q�Ǝ�p�P�ƌQ���r����QUASAR �����ł́C���w�Ö@�Q�̍Ĕ�������ѐ��������ǍD�ŁC5 �N��������3�`4���̏�悹���ʂ��݂�ꂽ���CStage Ⅱ�݂̂ł͗L�Ӎ��͓����Ȃ�����371�j�B�܂��CT3N0 ��ΏۂƂ���5-FU�{LV �Q�Ǝ�p�P�ƌQ�̃����_������r������pooled analysis�iIMPACT B2�j�ł͍Ĕ����E�������Ƃ��ɗL�Ӎ��͂Ȃ�372�j�C���^�A�i���V�X373, 374�j��SEER database review375�j�ł����w�Ö@�Q�̐������Ԃ��ǍD�ȌX����������̗̂L�Ӎ��͓����Ȃ������B
���������Ȃ��ŁC�C�O�̃K�C�h���C���ɂ�Stage Ⅱ�������̂Ȃ��ɍĔ������X�N�Q��ݒ肵�C���҂������ʂƗ\�z����镛��p���\���������������ŁC�p��⏕���w�Ö@���s���Ƃ������j���������̂�����B���̏ꍇ�CStage Ⅲ�������Ɠ������Ö@�Ɠ��^���Ԃ���������Ă���B�Ĕ������X�N�v���Ƃ��ẮC�����x���̃G�r�f���X�Ɋ�Â����̂ł͂Ȃ����̂́CASCO2004 �K�C�h���C���ł́C�s�������p�ߌ�12 �����CT4 �Ǘ�C���E��C�ᕪ���B���E��זE���E�S�t���Ǘ�113�j�CESMO �K�C�h���C���ł́CT4�C�ᕪ���B���܂��͖��������C���ǐN�P�C�����p�ǐN�P�C�T�_�o�Z���C�����Ǐ��ǂ܂��͒����E�C�s�������p�ߌ���12 �����ƋK�肵�Ă���114�j�BStage Ⅱ�̂Ȃ��ł��\��s�ǂȃT�u�O���[�v�ɓI���i���ĕ⏕���w�Ö@���s���Ƃ����헪�́C�����_�ł͑Ó��ȑI���ƍl�����C���ʂ͏�q�̃��X�N���q���Q�l�Ƃ��ďp��⏕���w�Ö@�̓K�����������邱�Ƃ��]�܂��B
�ŋ߂ł͗Տ��a���w�I���q�ȊO�ɁC�Ĕ��̗\����\��̔���ɁC���L�p���̍����o�C�I�}�[�J�[�̒T���������i�߂��Ă���iMSI�COncotype DX Colon Cancer test�CColoPrint �Ȃǁj376-378�j�B
CQ 15�F�p��⏕���w�Ö@�̎��Ê��Ԃ�6 �J�����K���H
�p��⏕���w�Ö@�̎��Ê��Ԃɂ��Ă͊m��I�Ȍ��_�͓����Ă��Ȃ����C���݂̂Ƃ���6 �J�����^���W���I�ł���C�K�ł���B�i�����x�E�G�r�f���X���x��1 A�j
Intergroup �v���g�R�[��-0089 �ł́C5-FU�{levamisole�iLEV�j�i12 �J���j��ΏƌQ�Ƃ��āC5-FU�{LV�iMayo �@��27 �T�C�܂���RPMI �@��32 �T�j�����5-FU�{LV�{LEV�i6 �J�����^�j�̔�r�������Ȃ��ꂽ�B3.8 �N��̖��Ĕ��������Ԃ���ѐ������Ԃɂ�4 �Q�Ԃ̍����F�߂��Ȃ������B�Ő��C�R�X�g�C���҂̗����̊ϓ_����C5-FU�{LEV ��12 �J������5-FU�{LV ��6�`8 �J�����^�̕����D�܂����ƌ��_���ꂽ135�j�B�܂�NCCTG ��NCIC �́C�Ĕ������X�N�������̏p��⏕���w�Ö@�Ƃ��Ď��Ö@�Ɠ��^���Ԃ�]������Տ�����������iNCCTG 89-46-51�j379�j�B2�~2 �v���f�U�C����5-FU�{LEV ��������5-FU�{LV�{LEV ��6 �J����12 �J�����^���r�������ʁC������̃��W��������ѓ��^���Ԃ����Ĕ����C�S���������ɗL�ӂȉe�����y�ڂ��Ȃ����Ƃ������ꂽ�B�������C���^���ԁ\���W�����̗L�ӂȑ��ւ��F�߂�ꂽ���߁C�e���^�Q�ɂ��ĕʁX�ɉ�͂��s��ꂽ���ʁC5-FU�{LV�{LEV ��6 �J�����^�̐����������ł������������C�e���W������12 �J�����^���L�ӂɗD��Ă��邱�Ƃ͎�����Ă��Ȃ��B����CMayo �@��24 �T���^��5-FU �����Ò��i300 mg/m2�j��12 �T���^���r���������ł́C���Ĕ��������ԂƐ������ԂɗL�Ӎ��͂Ȃ��C�����Ò��͉�����D���������Ȃǂ̗L�Q���ۂ����Ȃ������ƕ���Ă���380�j�B
�ȏォ��C�ԐړI�ł͂��邪5-FU�{LV ��6 �J�����^�i�T1 �^�j�́C5-FU�{LEV ��5-FU�{LV ��1 �N�ԓ��^�Ɠ����̗L���������邱�Ƃ���������C���݁C�W���I�Ȏ��Âƍl�����Ă���B�܂�oxaliplatin ���p��5-FU�{LV �ɑ���D�z����������MOSAIC ����121�j�CNSABP C-07 ����120�j�CXELOXA ����123�j�ɂ����Ă����҂�6 �J�����^�Ŕ�r����Ă���B�o���R����܁iUFT�{LV�Ccapecitabine�j�̓������Ԃ́C5-FU�{LV �Ƃ̓���������������NSABP C-06117�j��XACT ����118�j�ł͐Ò��@�Ɠ���6 �J�����^���̗p���ꂽ���CNSAS-CC �̎��ÌQ��UFT ��12 �J�����^���ꂽ133�j�B���݁C�o���R����܂�FOLFOX/CapeOX �̎��K���^���Ԃ����������r�������s���Ă���Ƃ���ł���C�{�ۑ�̊m�ؓI�Ȍ��_��܂łɂ͂���Ȃ錟�����K�v�ł���B
CQ 16-1�F���Âɂ�����bevacizumab �̓��^�͗L�����H
�ꎟ���Âɂ�����bevacizumab ���^�̗L���ɍS�炸�C���ÂƂ���bevacizumab ���p���w�Ö@���s�����Ƃ͗L���ł���B�i�����x�E�G�r�f���X���x��2B�j
�ꎟ���Â�bevacizumab ���^������Ă��Ȃ��ꍇ�̓��Âɂ����ẮC���^�\�ȏǗ�ɑ��Ă�bevacizumab �̓K���g�p�ɏ����������^���s�����Ƃ��]�܂����B���̏ꍇ�̎��K���^�ʁi5 mg/kg �܂���10 mg/kg�j�ɂ��Ă̏\�����m�ȃG�r�f���X�͂Ȃ�155, 167�j���C10 mg/kg ��5 mg/kg �ɑ���L�����̏�悹���F�߂��Ȃ������Ƃ����r����381�j���킪���������C�����_�ł�5 mg/kg �����������B
�ꎟ���Â�bevacizumab �����^����C�ꎟ���Â̌��ʂ��������Ă��邪�C�R����܂̗L�Q���ۂɂ�蓊�^�p��������ɂȂ����ꍇ�́Cbevacizumab ���p�����^���邱�Ƃ��]�܂����B����Cbevacizumab ���܂ވꎟ���Â̌��ʂ������iPD�j�ł������ꍇ�̓��Âɂ�����bevacizumab �̌p�����^�iBevacizumab Beyond Progression�FBBP�j�ɂ��ẮC�L�p������������ώ@�����̕�382�j�ƂƂ��ɁC�����_������r�����iML18147 �����j162�j�ɂ�����BBP �Q�̗L�ӂȑS�������ԉ������F�߂��C�L�����������ꂽ�B���̌��ʁCBBP �����w�Ö@�̕W�����Â̈�Ƃ��Ĉʒu�Â�����ƍl����B�������C�{�����ɂ�����BBP �ɂ�蓾��ꂽMST �̍���1.4 �J�����x�̍��ł��邱�ƁC�t�������ɍ����Ȃ����ƁC���z�Ȉ�ÃR�X�g�ȂǁC���X�N�ƃx�l�t�B�b�g���\���l��������Ŏ��Ö@��I�����邱�Ƃ��]�܂����B
CQ 16-2�F���Âɂ����镪�q�W�I���Ö�i�REGFR �R�̖�j�̓��^�͗L�����H
KRAS �쐶�^�ɂ����āC���ÂƂ��Ă̍REGFR �R�̖�icetuximab/panitumumab�j��p�������Â��s�����Ƃ͗L���ł���B�i�����x�E�G�r�f���X���x��2C�j
���ÂƂ��Ă�cetuximab �̓��^�kFOLFIRI �Ö@�i�܂���IRI �P�Ɓj�{cetuximab�l�́C�������������Ԃ̉����C�t�������̑����CQOL ����Ɋ�^���邱�Ƃ������ꂽ��164�j�C�v���C�}���[�G���h�|�C���g�ł���S�������Ԃł́C�ΏƁiIRI �P�Ɓj�Q�ɂ����鎎�����Ì��cetuximab ���^�i�N���X�I�[�o�[�j�̉e��������CIRI �P�ƗÖ@�ƍ��͊m�F����Ȃ������B���l�ɁCKRAS �쐶�^�Ɍ��肵�����ÂƂ��Ă�panitumumab �̓��^�kFOLFIRI �Ö@�i�܂���IRI �P�Ɓj�{panitumumab�l�ɂ����Ă��������������Ԃ̉����Ɋ�^���邱�Ƃ������ꂽ���C�S�������Ԃł�FOLFIRI �Ö@�Ƃ̍����m�F����Ȃ�����165�j�B
�S�������Ԃ��v���C�}���[�G���h�|�C���g�ɂ������CKRAS �쐶�^�̓��Âɂ�����REGFR �R�̖p���w�Ö@��bevacizumab ���p���w�Ö@�Ƃ̃����_������r�����͍s���Ă��炸�C����̌����ۑ�ł���B
CQ 17�F�̓]�ڂɑ���̓����Ö@�͗L�p���H
�؏��s�\�̓]�ڂɑ��āC�t�b���s���~�W���P�Ƃɂ��̓����Ö@�ƑS�g���w�Ö@�̔�r�ł͐������Ԃɖ��炩�ȍ��͔F�߂��Ă��Ȃ��B�܂��C���ܕ��p�S�g���w�Ö@�ɑ���̓����Ö@�̗L�p���͊m�����Ă��Ȃ��B�i�����x�E�G�r�f���X���x��1C�j
�؏��s�\�̓]�ڂ�ΏۂƂ���CALGB-9481 �����ɂ����āCFUDR �̓����Ö@�̑t�����C�S�������Ԃ�5-FU�{LV �S�g���w�Ö@�Ɣ�r���L�ӂɗǍD�ł��邱�Ƃ������ꂽ383�j�B�������C�{�������܂��^�A�i���V�X�ł́C�̓����Ö@�iFUDR �܂���5-FU�{LV�j�͑S�g���w�Ö@�iFUDR �܂���5-FU�{LV�j�Ɣ�r���t�����͗L�ӂɍ������C�S�������Ԃɖ��炩�ȍ��͔F�߂��Ȃ�����384�j�B
�̓����Ö@�ƑS�g���w�Ö@�̕��p�Ö@���J������Ă���CFUDR �̓����Ö@��OX�{5-FU�{LV �S�g���w�Ö@�̕��p��Ⅰ�������ł͑t����87���C�������Ԓ����l22 �J���C5-FU �̓����Ö@��IRI �S�g���w�Ö@�̕��p��Ⅰ/Ⅱ�������ł͊e�X72���C49.8 �J���ȂǗǍD�Ȑ��т�����Ă���385, 386�j�B
���g���X�y�N�e�B�u�Ȍ����ɂ�����5-FU�COX�CIRI �ɕs���ƂȂ����؏��s�\�̓]�ڗ�ɑ���5-FU �̓����Ö@�͑t����18.2���C�������Ԓ����l6.7 �J���ƕ���Ă���387�j�B
����܂ł̃����_������r�����͂�������t�b���s���~�W���P�Ƃ̊̓����Ö@�ƑS�g���w�Ö@�̔�r�ł���C���݂̕W���I�ȑS�g���w�Ö@�ł���OX ��IRI�C���q�W�I���Ö��p�������ܕ��p�Ö@�ɑ���̓����Ö@�܂��͊̓����Ö@�ƑS�g���w�Ö@�̕��p�Ö@�̗L�����͊m�����Ă��Ȃ��B
�T�C�h����
�� IRI ��UGT1A1 ��`�q���^
IRI �̊�����ӎY���ł���SN-38 �̊̓��̑�Ӎy�f�i������SN-38 ����s������SN-38 G �֕ϊ�����y�f�j�ł���UGT1A1 ��`�q��*6�C*28 �̃_�u���w�e���ڍ��́C���邢�͂��ꂼ����z���ڍ��̂Ƃ��Ă����Ă��銳�҂ւ̓��^�́CUGT1A1 �̃O���N�����_�����\���ቺ���CSN-38 �̑�ӂ��x�����邱�Ƃ��m���Ă���C�D���������ȂǏd�Ăȕ���p����������\��������B�Ƃ�킯�C�����r�����r���l���������ҁC����ҁC�S�g��Ԃ��s�ǂȊ��ҁi���Ƃ���PS2�j�C�O���IRI ���^�ō��x�ȓŐ��i���ɍD���������j�������������҂́C���^�O��UGT1A1 ��`�q���^�̗L���ׂĂ������Ƃ��]�܂����B����CUGT1A1 ��`�q���^�݂̂�IRI �̓Ő������ׂė\�m�ł��Ȃ����Ƃ���C��`�q���^�̗L���ɂ�����炸�C���Ò��͑S�g��Ԃ�c�����Ȃ���C���Ӑ[������p�Ǘ����s���Ă������Ƃ��̗v�ł���B
CQ 18�F�������ɑ���p�O���w���ː��Ö@�͗L�����H
���Ăɂ����Ă͒������ɑ���p�O���w���ː��Ö@�́CTME �P�ƂƔ�r���ċǏ��Ĕ�����ቺ�����邪�C�������̉��P�ɂ͊�^���Ȃ����Ƃ�����Ă���B���ĂƏp���̈قȂ�{�M�ɂ����ẮC��ᇉ������������]�������呤�ɂ��钼�����ɑ���p�O���w���ː��Ö@�̗L�p���͊m�����Ă��Ȃ��B�i�G�r�f���X���x��B�j
�������ɑ��đ����s�����s���Ȃ����Ăōs��ꂽ�Տ������ł́C�p�O���w���ː��Ö@�ɂ��Ǐ��Ĕ����̒ቺ��������Ă��邪�C�������̌���͎�����Ă��Ȃ�187, 388, 389�j�B�{�M�̑咰�����{�݂ɂ����ẮC���������i�s���ɑ��Ă�TME�i���邢��TSME�j�{�����s�����W���I�ɍs���Ă���C�������C�Ǐ��Ĕ����Ƃ��ɗǍD�Ȑ��т�����Ă���C���ĂŕW���ł���p�O���w���ː��Ö@�͐ϋɓI�ɂ͍s���Ă��Ȃ��̂�����ł���B���������p�ߓ]�ڂ��Ȃ��Ɛf�f���ꂽ�Ǘ�ɂ����ďp�O�Ǝˌ�ɂ����鑤�������p�ߊs���̗L�����r�����{�M�ɂ����郉���_������r�����ł́C���Q�̖��Ĕ����C�S�������ɍ��͂Ȃ��C�����s�����{�s���Ȃ��Q�ŗL�ӂɔr�A��Q�C���@�\��Q�����Ȃ����Ƃ�����Ă��邪390�j�C45 ��Ə�����̌����ł��邱�Ƃ���C���̈̕Ӌ`�͌���I�ł���B����C�p�O���ː��Ö@�ɂ͒��Ǐ�Q�C�r�@�\��Q�C���@�\��Q�C2 ���������Ȃǂ̗L�Q���ۂ�����Ă���189, 391�j�C�{�M�ɂ�����p�O���w���ː��Ö@�̋Ǐ��Ĕ��ጸ�ɂ������悹���ʁC���邢�͑����s���̑�ւƂ��Ă̗L�����ɂ��ẮC�L�Q���ۂ��l�������C�K�Ɍv�悳�ꂽ�Տ������ł̕]�����K�v�ł���B
���݁C�����O�ŐV�K�R����܂p�����p�O���w���ː��Ö@�̎��ÊJ�����s���Ă���201, 392-398�j�C����������Ɋ�^���邩�͍���̌�����҂K�v������B�܂��C�V�����Ǝ˕��@�Ƃ��āC�O�������̏Ǝ˂̐i���`�ł���C�t�������Ìv��i�C���o�[�X�v�����j�Ɋ�Â���ԓI�C���ԓI�ɕs�ψ�ȕ��ː����x�����Ǝ˃r�[���𑽕�������Ǝ˂��邱�Ƃɂ��a�����ɍœK�Ȑ��ʕ��z�邱�Ƃ��\�ȋ��x�ϒ����ː����Áiintensity modulated radiotherapy�FIMRT�j������B���ՏƎ˂ɂ����āC���ǂ��N���C���Ս��ւ̐��ʂ�ጸ�����āC������Ő��C�����Ő��̌y����}�邱�Ƃ��ł���B��������ΏۂƂ���IMRT ��p�����p�O���w���ː��Ö@�̑�Ⅱ�������ɂ����ėL�Q���ۂ̌y�����ʂ͔F�߂�ꂸ205�j�C�����_�ł͗Տ������ōs�����Ƃ���������Ă���B
CQ 19�F�؏��s�\�ȋǏ��i�s�E�Ǐ��Ĕ��������ɑ��鉻�w���ː��Ö@�͗L�����H
- ①���Â̎�ᇏk�����ʂɂ���Ă�R0 �؏��\�ɂȂ�Ɣ��f�����Ǐ��i�s�E�Ǐ��Ĕ��������ɑ��ẮC�؏����w���������w���ː��Ö@�����ː��P�ƗÖ@�������������B�i�����x�E�G�r�f���X���x��1B�j
- ②�Ǐ�ɘa��ړI�Ƃ���ꍇ�ɂ́C���w���ː��Ö@���l�������B�i�����x�E�G�r�f���X���x��1C�j
1�j���Â̎�ᇏk�����ʂɂ���Ă�R0 �؏��\�ɂȂ�imarginal resectable�j�Ɣ��f�����Ǐ��i�s�������ɑ��ẮC�؏����w�������p�O���w���ː��Ö@�����ː��P�ƗÖ@�������������iCQ 10 �Q�Ɓj399-401�j�B
���܂��܂ȍR����܂Ƃ̓������p�Ö@���W������������Ă���402-404�j�B�؏��s�\�iT4�j��������ΏۂƂ��������_������r�����ł́C5-FU�{LV�{50 Gy �̉��w���ː��Ö@�Q�́C���Ő����������̂̈�ʐf�Ã��x���Ŏ��{�\�Ɣ��f���ꂽ�B���w���ː��Ö@�Q�͕��ː��P�ƗÖ@�Q�ɔ�ׂāC���S�؏����i84�� v 68�� p��0.009�j�C5 �N���Փ����䗦�i82�� v 67�� p��0.03�j�C�������ِ������i72�� v 55�� p��0.02�j�ɂ����ėD��Ă������C�Ĕ�����N���E�O���B�Z������܂ޏǗ�̌����ł���C���ʂ̉��߂ɂ͒��ӂ��K�v�ł���405�j�B�Ǐ��i�s�������C�Ǐ��Ĕ��������ɑ��鉻�w�Ö@�P�Ƃ�R0 �؏����Ɋւ���͂Ȃ��B
�p���Ǝ˂́C���{�\�Ȏ{�݂���������̂́C�p�O���w���ː��Ö@���10�`20 Gy �̏p���Ǝ˂��s���C�\�オ���P�����Ƃ���������208, 406�j�C���ɑ�����Z����܂��͍Ĕ���Ő؏��f�[���z���������͋ߐڂ��Ă���ꍇ�ɂ͋Ǐ����䗦�̌���̂��߂ɍl�����Ă��悢�Ö@�ł���407, 408�j�B
2�j�L�Ǐ�̐؏��s�\�ȋǏ��i�s�E�Ǐ��Ĕ��������ɑ��ẮC�ȉ��̂悤�ɑw�ʉ����ꂽ�ɘa���Â��s���Ă���B①�S�g��Ԃ��ǍD�ł���Ö@�����{�\�ȏǗ�ɑ��ẮC�ł��邾�������Ԃɂ킽��Ǐ�ɘa���ʂĊ��҂�QOL �������ۂ��Ƃ����҂��āC���w���ː��Ö@���l�������B②�S�g��Ԃ��s�ǂł���Ö@�����{����ȏǗ�ɑ��ẮC�Z���Ԃ���Ő��ɁC�u�Ɋɘa��~���Ȃǂ̏Ǐy������邱�Ƃ����҂��āC�ɘa�I���ː��P�ƗÖ@���I������邱�Ƃ������B���Ǐ�̐؏��s�\�ȋǏ��i�s/�Ǐ��Ĕ��������ɑ��ẮC�l�X�Ȏ��Ö@���I������Ă���B���w���ː��Ö@�͐ϋɓI�ȋ~�ώ��Â̑I�����̈�ƍl�����Ă���42�j�B
���ɕ��ː��Ö@���s��ꂽ�Ǘ�̏Ǐ�ɘa�ɂ́C���w�Ö@�p���������ߕ����Ǝ˂��L�p�ł������ƕ���Ă���211, 357, 409, 410�j�B
�ߔN�C�O�������̏Ǝ�404�j�⋭�x�ϒ����ː�����411�j�Ȃǂ����p�ł���悤�ɂȂ�C�L�Q���ۂ��뜜����鏬���Ȃǂ̗אڑ���ւ̐��ʂ�ቺ�����Ȃ���C�a�ϕ��ւ̐��ʂ����邱�Ƃ��\�ƂȂ��Ă����B�܂��C�Y�f��412�j�C�z�q���Ȃǂ̏d�C�I������p�������Âɂ���z�������ʕ��z���\�ƂȂ�C���ɒY�f���͍��������w�I���ʂ����҂���Ă���B����͂����̐V�������ː��Ö@��p���āC�W�I�̐ς̐ݒ�@�C���ʑ����C���p��ܓ��ɂ��L�����ƈ��S���̌���ɂ��āC�K���Ɍv�悳�ꂽ�Տ����������{���Ă����K�v������B
CQ 20-1�F�咰�������؏���̃T�[�x�C�����X�͗L�����H
�T�[�x�C�����X�̗L�����́C�Ĕ��̑����������\�����Ɋ�^���邱�Ƃ��玦����Ă���C����I�ȏp��T�[�x�C�����X�����{����̂��]�܂����B�i�����x�E�G�r�f���X���x��1A�j
�������C��Ìo�ϊw�I�ϓ_���܂߂����K�ȃT�[�x�C�����X�v���g�R�[���͏\���Ɋm������Ă��Ȃ��B
�咰�������؏���̃T�[�x�C�����X���@�Ɨ\��̊֘A�͕����̃����_������r�����Ō�������Ă���413-421�j�Bintensive �ȃT�[�x�C�����X���ǍD�ȗ\��Ɋ�^����Ƃ�����416, 418, 420�j�C�����ے肷������邪413-415, 417�j�C���^�A�i���V�X�ɂ���āC�T�[�x�C�����X�ɂ��Ĕ��̑��������͑咰�������؏���̗\�����Ɋ�^���邱�Ƃ�������Ă���234-238�j�i�\1�j�B
�������C�ߋ��ɍs��ꂽ�T�[�x�C�����X�Ɋւ��郉���_������r�����͉��ĂŎ{�s����C�gintensive�h�Ɉʒu�Â����Ă���T�[�x�C�����X���@�ɂ́C�����Ԋu������417�j�C��ᇃ}�[�J�[�̑����摜�f�f���ȗ����Ă�����̂�����Ȃ�413, 415, 421�j�C�{�M�ň�ʓI�ɍs���Ă���T�[�x�C�����X����less intensive �Ȃ��̂����Ȃ��Ȃ����Ƃɗ��ӂ���K�v������B�{�M�ɂ����錻��̃T�[�x�C�����X�̑Ó����Ɋւ���͉ߋ��̗Տ���������͓���ꂸ�C�����intensive �ȃX�P�W���[����V�����f�f���_���e�B��g�ݍ��ނ��Ƃ̗Տ��I�Ӌ`�͕s���ł���B
���Ă̑�\�I�ȃK�C�h���C���ɂ����Đ��������p��T�[�x�C�����X���@���\2 �Ɏ���114, 242, 243, 422�j�B�K�C�h���C�����Ƃɐf�f���_���e�B��X�P�W���[���̑a���x�ɍ������邪�C�{�M�ɂ����錻��̃T�[�x�C�����X���@�Ɣ�r����Ƃ����͊T����less intensive �ł���B���̑���Ɋւ��āC���Ăł͖{�M�ȏ�ɔ�p�Ό��ʂɏd�����u����241�j�C�܂��T�[�x�C�����X�̏d�v���Ɋւ���F�����\���ɐZ�����Ă��Ȃ�����423, 424�j���w�i�ɂ�����̂ƍl������B��Ìo�ϓI�ȑÓ����ɂ��z�������ŗǂȃT�[�x�C�����X���@�̊m���͍���̉ۑ�ł���251, 425�j�B
|
| Intensive surveillance �Q�̐��� �iLess/No intensive �Q�Ƃ̔�r�j | |||
|---|---|---|---|---|
| �ҁi�N�j | ����RCT*�� (�Ǘᐔ�j | �Ĕ��������� | �Ĕ����؏���** | �S���S��** |
| Renehan�i2002�j | 5 �i1,342 ��j | –8.5 �J���m–9.4�`–7.6�n | — | 0.81 �m0.70�`0.94�n |
| Figueredo�i2003�j | 6 �i1,679 ��j | — | — | 0.80 �m0.70�`0.91�n |
| Renehan�i2005�j | 6 �i1,679 ��j | — | 2.12 �m1.43�`3.15�n | 0.76 �m0.67�`0.86�n |
| Jeffery�i2007�j | 8 �i2,141 ��j | –6.8 �J���m–11.1�`–2.4�n | 2.41 �m1.63�`3.54�n | 0.73 �m0.59�`0.91�n |
| Tjandra�i2007�j | 8 �i2,923 ��j | –5.9 �J���m–8.7�`–3.1�n | 2.81 �m1.65�`4.79�n | 0.74 �m0.59�`0.93�n |
�������_������r�����@�����I�b�Y��C�m�@�n�F95���M�����
| ASCO�i2005 �N�ja�j | ESMO�i2012 �N�ja�j | NCCN�iVersion 3. 2013�j | |||
|---|---|---|---|---|---|
| Stage Ⅰ | Stage Ⅱ | Stage Ⅲ | |||
| ��f�Ɛf�@ | 3 �N�ԁF3�`6M ���G 4�`5 �N�F6M �� |
3 �N�ԁF3M ���G 4�`5 �N�F6M �� |
—b�j |
2 �N�ԁF3�`6M ���G 3�`5 �N�F6M �� |
|
| CEA | 3 �N�ȏ�F3M �� �mstage�U�C�V�n |
3 �N�ԁF3M ���G 4�`5 �N�F6M �� |
—b�j |
2 �N�ԁF3�`6M ���G 3�`5 �N�F6M �� |
|
| ����/�����i/���Ձj CT |
3 �N�ԁF1Y �� �m�����X�N���n |
1 �N���mstage�U�C�V�n | — |
5 �N�ԁF1Y �� �m�����X�N���n |
5 �N�ԁF1Y �� |
| ���������g���� | — |
3�`6M�� | — |
||
| ����������c�j | 3 �N�ځB�ȍ~5Y �� | 1 �N�ڂ�3Y�� | 1 �N�ڂ�3 �N�ځB�Ȍ�5Y �� |
||
| �����iS ���j ������ �m�������n |
5 �N�ԁF6M �� | 3 �N�ԁF3�`6M �� 4�`5 �N�F6�`12M �� |
5 �N�ԁF6M �� |
||
a�j�������ł�5 �N�ȍ~�̃T�[�x�C�����X���l������ꍇ�����邱�Ƃ��L����Ă���Gb�j�������ł́CStage�T�� ������I�Ȗ�f�E�f�@��CEA ����iT2 ���j�����������Gc�j�p�O��������o�ߒ��̑B����̏C��`�w �I�f���ɂ���ẮC��薧�Ȍ����Ԋu�����������B
CQ 20-2�F �咰�������؏���ɑ��d����i�����咰������ё����킪��j�̃T�[�x�C�����X�͗L�����H
- �@�咰���؏��Ǘ�ɂ�����َ����咰���̔����p�x�͈�ʏW�c��荂���C����I�ȑ咰�����������̗L������������Ă���B�i�����x�E�G�r�f���X���x��1B�j
- �A����C�d�������W�I�Ƃ����p��T�[�x�C�����X�̗L�����͎�����Ă��Ȃ��B���f�̕K�v�����[�����C����I�Ȍ��f�����߂�̂��Ó��ł���B�i�����x�E�G�r�f���X���x��2C�j
�咰���ɂ́C�咰�������C�d������̍����������X�N��L�����`���咰��������B����f�Âɂ����ẮC��`���咰�����ӕʂ��邱�Ƃ��d�v�ł���C��`���咰���ɑ��Ă͓K�ȃJ�E���Z�����O�̂��Ƃɑ��d����̃T�[�x�C�����X�����{����K�v������i�w��`���咰���f�ÃK�C�h���C���x�Q�Ɓj256�j�B
��ʓI�ɁC�َ����咰���̔����p�x��1.5�`3���Ƃ����250, 253, 254, 426�j�B����͈�ʏW�c�Ɣ�r�����ꍇ��1.3�`1.5 �{�ƍ���253, 254, 426�j�C�咰���늳���َ͈����咰���̊댯���q�ł���B����I�ȓ����������ɂ�蔭�������َ����咰���̖�90���������؏��\�ł���250�j�C�َ����咰����W�I�Ƃ����p��T�[�x�C�����X�͗L�p�ƍl������B
���������p��̑咰�����������̃X�P�W���[���̓K�C�h���C���ɂ��قȂ�iCQ 20-1 �\2�j114, 242, 243�j�B�َ����咰���̖��͏p��2 �N�ȓ��ɔ��������250�j�B�咰���̏����p���ɑ���������������p�x��2�`7���Ɣ�r�I����250, 254�j�C�p�㑁���ɔ��������َ����咰���ɂ͏p�O�����Ō��������������咰�����܂܂��ƍl������B�p�㏉��̑咰�����������̎��K�{�s�����͏p�O�����̎��ɍ��E����邪427�j�C��ʓI�ɂ͏p��1 �N���̌�������������112, 243, 428, 429�j�C�p�O�ɑS�咰�̊ώ@���s�\�ł������Ǘ�ɂ͂�葁���̎��{���]�܂���243�j�B
����C�d�������W�I�Ƃ���T�[�x�C�����X���U�����咰���ɍs�����Ƃ̑Ó����͏\���Ɍ�����Ă��Ȃ��B�{�M�ɂ�����َ����d������̔����p�x��1�`5���Ƃ����254, 430-435�j�B����ʂɂ́C�݂��ő��ł���i1�`3���j254, 430-434, 436, 437�j�C�x��̑�������ɑ����Ƃ��������254, 431, 437�j�B�ߔN�C�咰���p��̏d�������p�x�͈�ʏW�c�̜늳��������\�����w�E��������邪437�j�C�U�����咰���Ǘ�ɂ�����d������̃T�[�x�C�����X�̗L�������ؖ������R�z�[�g�����͂Ȃ��B�܂��C�O���B��438-441�j�C�q�{�̊�433, 439-442�j�C������433, 439, 440, 442�j�C����439�j�C������440, 441, 443, 444�j�C�����̍b��B��433, 440�j�Ȃǂ̔����p�x�������Ƃ�������邪�C�����͉��Ă���̕ł���C��`���咰���Ƃ̊֘A�����m�ł͂Ȃ��B
�ȏォ��C�d������̃T�[�x�C�����X�Ɋւ��ẮC��Ìo�ϓI���ʂ��l�������������K�v�ł���C�d���������X�N�̕]����̊m�����}���ł��邪�C����ł͑咰���p��ɏd�������W�I�Ƃ���T�[�x�C�����X�����{���鍪���͖R�����B���f�̕K�v�����[����437�j�C����I�Ȍ��f�����߂�̂��Ó��ł���254, 431, 434, 445�j�B