���f��K���g�p�@�`�f�ÃK�C�h���C��
�K�C�h���C�������̕����ԍ�����C�Y�����镶�����X�g�փ����N����܂�
���@�_
����Ö@���s����Î҂�state-of-the-art �́C�œK�Ȏ��Õ��j�̂��ƂɓK�ȖÖ@��I�����C���S�ɁC��ɂƌ��ǂ��ŏ����ɂ��Ȃ���C���Ë��x���ێ����čő���̌��ʂ����Ƃł���B�e�����ɂ����鎡�ÃK�C�h���C������������CCancer Board ���[�����Ă������ƂŁC�K�ȖÖ@�̑I�����e�ՂɂȂ����悤�ɂȂ����B����Ɋe�{�ݓ��ł͖Ö@�̃��W������o�^���ɂ��ĊǗ�����悤�ɂȂ�C�d�q�J���e�̕��y�ɂ�鎩���v�Z����������C�����Ɏ���܂ł͈�ʉ�������S�����S�ۂ���Ă��Ă���B�������C���^��̔����ɂ͌̍�������C����p�Ƃ��ďo�������ɂɑ��Ă͂���Ɍʂ̑Ή��ɂȂ邽�߁C�e��x���Ö@�͏n�m���Ă����K�v������B����Ö@�ɂ���Ĕ������鈫�S�E�q�f�ichemotherapy-induced nausea and vomiting; CINV�j�́C�Óf�̋@�����𖾂���C�����ɍ�p�����܂��J�����ꂽ����ɂ����Ă��C���҂���ɂƊ������\�I�ȕ���p�ł��邽�߁C�����K�ɐ��䂷�邱�Ƃ͏d�v�ȈӖ������B�킪���ł́C�C�O�̃K�C�h���C�����Q�l�ɁC����ɑ������K�C�h���C�����쐬���C�]�����s�Ȃ��Ă���1, 2)�B�̓o���V���Ȑ��f�Ɋւ���G�r�f���X�̐V�o������C�������܂߂����f��K���g�p�K�C�h���C��2015 �N10 ���i��2 �Łj�ꕔ�����Łiver.2.2�j�̌��J�Ɏ������B
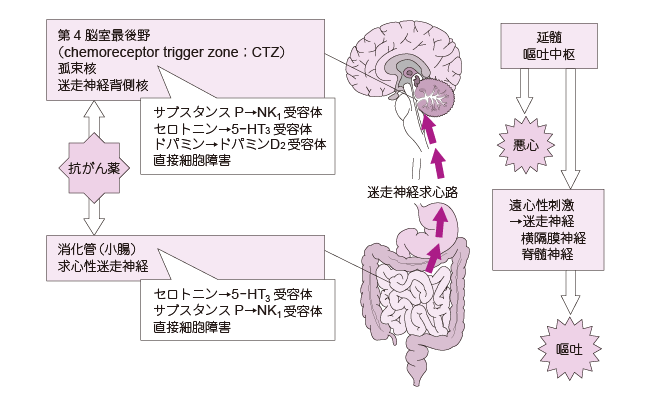
1�j���S�ƚq�f
���S�͚q�f�������ȕs�����ł���C�����q�f�����̋��S���h���̔F����\���B�܂��C�q�f�͈ݓ��e���������I�ɔr�o������^���ŁC�H�啔��������ݒꕔ�≺���H������̒o�ɂƉ��u���╠�̎��k�ɂ���Ĉ݂̓��e�����r�o��������N�������B�q�f�����ɉe�����y�ڂ��a�Ԃɔ������ċN����C���͌o�H�Ƃ��ẮC��]�玿�i���W�������i�C��ᇁC���Ǖa�ρC���_�E����Ȃǁj�C���w��e�́i��ӕ��C�z�������C�C�őf�Ȃǁj�C�O���i�p���C��]�^���C�O��a�ςȂǁj�C�����i�����`�����ǁE�S���E��������Ȃǂ̋@�B��e�́C�����ǂȂlj��w��e�̂Ȃǁj������B
���S�E�q�f�́C�}1�i�R�����ɂ�鈫�S�E�q�f�̃��J�j�Y���j�Ɏ����悤�ɁC�㕔�����ǂɗD�ʂɑ��݂���5-HT3��e�̂Ƒ�4 �]����chemoreceptor trigger zone�iCTZ�j�ɑ��݂���NK1��e��, �h�p�~��D2��e�̂������I�Ɏh������C�����̚q�f�������������邱�Ƃň��S�������C����ɉ��S���ɑ���̔������N���邱�ƂŚq�f����ƍl�����Ă���B���w��e�̂ō�p����_�o�`�B�����Ƃ��ẮC�Z���g�j���C�T�u�X�^���XP�C�h�p�~���Ȃǂ��m���Ă���C�����Ɲh�R�����܂Ȃǂ����f��Ƃ��ėp�����Ă���i�\1: �{�K�C�h���C���Ŏ��グ���Ă��鐧�f��ꗗ�j�B�܂��C�����̏�Ԃɂ��ȉ��̂悤�ȕ��ނ�����C�eCQ �ɂ݂�悤�ɁC�@����w�i���l�������Ή����s���Ă���B
- ���^��24 ���Ԉȓ��ɏo������}���̈��S�E�q�f�iacute emesis�j��CQ2
- 24 ���Ԍォ���1 �T�Ԓ��x��������x�����̈��S�E�q�f�idelayed emesis�j��CQ3
- ���f��̗\�h�I���^�ɂ�������炸��������ˏo�����S�E�q�f�ibreakthrough nausea and vomiting�j��CQ6
- �R�����̂��Ƃ��l���������ŗU�������\�������S�E�q�f�ianticipatory nausea and vomiting�j��CQ9
�}1�@�R�����ɂ�鈫�S�E�q�f�̃��J�j�Y��
| ���@�� | ��ܖ� | �܌` | �{�M���F�p�� | �Q�lCQ |
|---|---|---|---|---|
| ���t�玿�X�e���C�h | �f�L�T���^�]�� | ���ˍ� | 1 ��3.3�`16.5 mg ��1�`2 ��ɕ������ĐÒ��C�_�H�Ò�** | 1�C2�C3�C4�C 5�C6�C7�C10�C 14�C17 |
| ���� | 1��4�`20 mg��1�`2��ɕ������Čo�� | |||
| ���`���v���h�j�]���� | ���ˍ� | 250 mg ��1 ��2 ��_�H�Ò� | 1�C2�C3�C5�C 6�C14 |
|
| 5-HT3��e�̝h�R�� �i��ꐢ��j |
�A�U�Z�g���� | ���ˍ� | 10 mg�i���_���Ƃ��āj��1 ��1 ��Ò�*** | 1�C2�C3�C4�C 5�C6�C10�C14�C 16�C18 |
| ���� | 10�`15 mg�i���_���Ƃ��āj��1 ��1 ��o�� | |||
| �C���W�Z�g���� | ���� | 8 mg�i���_���Ƃ��āj��1 ��1 ��o�� | ||
| �I���_���Z�g���� | ���ˍ� | 4 mg ��1 ��1 ��ɏ��ɐÒ�*** | ||
| ���� | 4 mg ��1 ��1 ��o�� ���ʕs�\���ɂ͓��p�ʂ̒��ˉt��Ò� |
|||
| �O���j�Z�g���� | ���ˍ� | 40��g/kg ��1 ��1 ��Ò��C�_�H�Ò�*** | ||
| ���� | 2 mg ��1 ��1 ��o�� | |||
| �����Z�g���� | ���ˍ� | 0.3 mg�i���_���Ƃ��āj��1 ��1 ��Ò�*** | ||
| ���� | 0.1 mg�i���_���Ƃ��āj��1 ��1 ��o�� | |||
| �i���j | �p���m�Z�g���� | ���ˍ� | 0.75 mg ��1 ��Ò��܂��͓_�H�Ò� | |
| NK1��e�̝h�R�� | �A�v���s�^���g | �J�v�Z���� | 1 ����125 mg ���C2 ���ڈȍ~��80 mg ��1 ��1 ��o�� | 2�C3�C4�C5�C 8�C14�C16�C17�C 18 |
| �z�X�A�v���s�^���g | ���ˍ� | 150 mg��1���ڂ�1��_�H�Ò� | ||
| �h�p�~��D2��e�� �h�R�� |
�h���y���h�� | ���� | 10 mg ��1 ��3 ��H�O�o�� | 2�C6�C10�C18 |
| ���� | 60 mg ��1 ��2 ���� | |||
| ���g�N���v���~�h | ���ˍ� | 7.67 mg ��1 ��1�`2 ��ؒ��C�Ò� | 1�C2�C3�C6�C 7�C10�C18 |
|
| ���� | 1��7.67�`23.04 mg��2�`3��ɕ������ĐH�O�o�� | |||
| �x���]�W�A�[�s���n �R�s���� |
�A���v���]���� | ���� | 0.4�`0.8 mg �����ÑO��Ɠ������i���Â�1�`2���ԑO�j�Ɍo�� | 6�C9 |
| �����[�p�� | ���� | 0.5�`1.5 mg �����ÑO��Ɠ������i���Â�1�`2���ԑO�j�Ɍo�� | 1�C2�C6�C9 | |
| �t�F�m�`�A�W���n �R���_�a�� �i�h�p�~��D2��e�̝h�R��p�j |
�v���N�����y���W�� | ���ˍ� | 5 mg ��1 ��1 ��ؒ� | 1�C2�C6�C7�C 10�C18 |
| ���� | 1��5�`20 mg��1�`4��ɕ������Čo�� | |||
| �N�����v���}�W�� | ���ˍ� | 10�`50 mg�i���_���Ƃ��āj���ɏ��ɋؒ� | 18 | |
| ���� | 1 ��25�`75 mg�i���_���Ƃ��āj��2�`3 ��ɕ������Čo�� | |||
| �u�`���t�F�m���n �R���_�a�� �i�h�p�~��D2��e�̝h�R��p�j |
�n���y���h�[�� | ���ˍ� | 0.5�`2 mg ��4�`6 ���Ԃ��ƂɐÒ� | 1�C2�C6�C18 |
| ���� | 0.5�`2 mg ��4�`6 ���Ԃ��ƂɌo�� | |||
| �x���Y�C�\�I�L�T�]�[���n �R���_�a�� �i�h�p�~��D2��e�̝h�R��p�j |
���X�y���h�� | ���� �t�� |
1.0�`1.5 mg ��1 ��1 �O�Ɍo�� | 2�C18 |
| ����e�̍�p�R���_�a�� �i�h�p�~��D2�E�q�X�^�~��H1�E 5-HT3�E��e�̝h�R��p�j |
�I�����U�s�� | ���� | 5�`10 mg ��1 ��1 ��o�� | 2�C3�C6�C18 |
| �v���s���A�~���n �R�q�X�^�~���� |
�N�����t�F�j���~�� | ���ˍ� | 5 mg�i�}���C���_���Ƃ��āj��1 ��3�`4 ��Ò��C�牺�� | 18 |
| �U�� | 2�`6 mg�i�}���C���_���Ƃ��āj��1 ��2�`4 ��o�� |
�킪���ł͈��S�E�q�f�ɑ��ď��F����Ă��Ȃ���܂͔w�i�𒅐F���Ă���B�Ȃ��C�p�ʂ͐��f��Ƃ��Ĉ�ʓI�Ɏg�p�����ʂ��L�ڂ����B
*���˖̊ܗʂ̓f�L�T���^�]��3.3 mg/mL�C�����_�f�L�T���^�]���i�g���E��4 mg/mL �ł���B
**���ʕs�\���ɂ͓��p�ʂ�lj����^�B
2�j���҂ɑ��鈫�S�E�q�f�̎��Â̊�{
- ① ����Ö@�ɂ����鈫�S�E�q�f�̎��ÖڕW�͔����\�h�ł��邪�C�ߕs���Ȃ��K�Ȏ��Â��s�����Ƃ��ڕW�ł���C�ߏ�ɂȂ邱�Ƃ͐T�ނׂ��ł���
- ���^�\��̍R�����̍Óf�����X�N�ɉ����āC�K�Ȑ��f����g�p����
- ���S�E�q�f�����̃��X�N�̂�����ԁC�őP�̗\�h���s��
- ② ���f��͌o����C���˖�̂�������L�����͓����ł���
- ③ �e�퐧�f����L�̕���p���l������
- ④ ���f��̑I���́C�\�肷��R�����̍Óf�����X�N�C�ߋ��̐��f�Ö@�̌��ʁC���Ҕw�i���q���l�����Č��肷��
- ⑤ ���Âɒ��ڋN�����Ȃ����S�E�q�f�̌���
- ���ǂ̕�������⊮�S��
- �O��@�\��Q
- �]��ᇁi�]�����i��ԁj
- �d�����ُ�i���J���V�E�����ǁC��i�g���E�����ǁC�������j
- �A�ŏ�
- �I�s�I�C�h���܂ޕ��p���
- ���lj^����Ⴡi���a��ᇁC�r���N���X�`���Ȃǂ̍R�����C���A�a�������_�o��Q�Ȃǁj
- �ߏ蕪��i���z������ł̗����Ȃǁj
- ��������
- �S�����v���i�s���C�\�������S�E�q�f�j
- ⑥ ���ː����Â₪��Ö@�Ƃ͖��W�̈��S�E�q�f�ɑ��Ă����f�Ö@���s��
- ⑦ ���ܕ��p�Ö@�ɂ����Ă͍ł��Óf�����X�N�̍�����܂ɑ��鐧�f�Ö@��I������
- ⑧ �ŏ��x���X�N�R�����̓��^���C���₯������s�ǏǏ�̑i���ɑ��ẮCH2��e�̝h�R��C�܂��̓v���g���|���v�j�Q����l������
- ⑨ ���ȊǗ��Ɋւ��銳�ҋ���E�w��
- �䖝���Ȃ����Ƃ��܂߂����Ҏ��g�ɂ��Z���t�A�Z�X�����g�̔F���ƁC���ғ��L���ɂ��L�^�̐��i�Ɋւ��鋳��
- ����ɂ�����C����I�Ȑ��f��̃A�h�q�A�����X�ێ��ƁC�˔��I�Ȉ��S�E�q�f�ւ̑Ή��Ɋւ���w��
- ⑩ �����E���ɂ�����H�v���
- �������Ƃ�������
- �H�����̖ʂł́C���ʂ��𑝂₷�C�H�ׂ₷������ɂ���C�ɂ����E���t���E���x���̔z����C�ɉ������H���w���E�h�{�w���ɂ��h�{�Ǘ��̓O��
- �O�����Î��⎩��ɂ�����ɂ����⊷�C���̎��Ê��E�������̐����Ɣz��
- ⑪ ���Â̈�Ƃ��čs���Ă���C��含�����߂����E��A�g�̃`�[����Âł̎��{���d�v
3�j�{�K�C�h���C����p�������f�Ö@
�i1�j���S�E�q�f�ɑ��郊�X�N�̔c��
① �R�����ɂ�����Óf�����X�N�]��
����Ö@�ŗU������鈫�S�E�q�f�̔����p�x�́C�g�p����R�����̍Óf���ɑ傫���e������C���̒��x���`���镪�ނ͍l�Ă���Ă�����̂́C�m�����ꂽ���̂ł͂Ȃ��B�{�K�C�h���C���ł́C�C�O�̃K�C�h���C���Ɠ��l�C���f��̗\�h�I���^�Ȃ��Ŋe��R����^��24 ���Ԉȓ��ɔ������鈫�S�E�q�f�i�}���̈��S�E�q�f�j�̊����i���j�ɏ]���Ē�`���C4 �ɕ��ނ����B
- ���x�i�Óf���j���X�N�ihigh emetic risk�j: 90�����銳�҂ɔ�������
- �����x�i�Óf���j���X�N�imoderate emetic risk�j: 30�`90���̊��҂ɔ�������
- �y�x�i�Óf���j���X�N�ilow emetic risk�j: 10�`30���̊��҂ɔ�������
- �ŏ��x�i�Óf���j���X�N�iminimal emetic risk�j: �������Ă�10�������ł���
② ���̑��̍Óf���X�N
��L�̈��q�̂ق��C���Ê֘A���q�Ƃ��Ă͕��ː��Ǝˁi��CQ10�j��I�s�I�C�h�i��CQ18�j������C���Ҋ֘A���q���w�E����Ă��邪�i��CQ11�j�C�Ώ����@�͍��㌤����i�߂Ă����K�v������B
�i2�j���ˍR�����ɂ�����Óf�����X�N�]��
�R�����̎�ށC���^�ʁC���p�R�����ɂ��Óf���͈قȂ��Ă���C�{�K�C�h���C���ł��\2�i���ˍR�����̍Óf�����X�N���ށj�Ɏ����悤�ȃ��X�N���ނ��s�����B�Q�l�ɂ����C�O�̃K�C�h���C���̃R���Z���T�X���x���͍����C�킪���̃C���^�r���[�t�H�[���̌��ʂȂǂƈ�v���݂Ȃ����e�����邪2�j�C�����̃G�r�f���X���d�������쐬�ψ���̃R���Z���T�X�̂��ƂŌ��肵���B
�قƂ�ǂ̖�܂͒P�܂ł̕��ނƂȂ��Ă��邪�C�A���g���T�C�N�����n�R�����ƃV�N���z�X�t�@�~�h��2 �ܕ��p�Ö@�̏ꍇ��HEC �Ɋ܂߂��B�����̂���Ö@�ɑ��ܕ��p�Ö@���p�����Ă���C�����C�ő�̍Óf�����X�N�ɑ��鐧�f�Ö@����������邪�C��̓I�ȑΉ��͑�2 �͂̑��킪��ʂ̃��W�����ꗗ���Q�l�ɂ��ꂽ���B
�킪���ł̂ݎg�p�\�Ȗ�܂́C���F�\�����̃f�[�^�C�s�̌�̑�\�I�ȗՏ������C�����̔��� �g�p���ђ����̃f�[�^����p���ĕ��ނ��Ă��邪�C�����̕]�����@���ߔN�ƈقȂ��Ă��邱�Ƃ� �����ĕs�m�������܂܂�Ă��邱�Ƃɗ��ӂ���B
| ���� | ��܁C���W���� |
|---|---|
| ���x�i�Óf���j���X�N high emetic risk �i�Óf�p�x�@��90���j |
|
| �����x�i�Óf���j���X�N moderate emetic risk �i�Óf�p�x�@30�`90���j |
�J���{�v���`���iHEC �ɏ����������j ��J���{�v���`��
|
| �y�x�i�Óf���j���X�N low emetic risk �i�Óf�p�x�@10�`30���j |
|
| �ŏ��x�i�Óf���j���X�N minimal emetic risk �i�Óf�p�x�@��10���j |
|
��1: �p��\�L�͖{�M�����F�B
�� 2: �u ���v�͊C�O�̃K�C�h���C���ɂ͋L�ڂ��Ȃ����C�킪���ł͎g�p�\�Ȗ�܁B
��3: �����t���̖�܂�30 �N�ȏ�O�ɊJ�����ꂽ��܁i�A�����r�V���C�l�_�v���`���C�s�����r�V���������j�B
�i3�j���ˍR�����ɂ�����Óf�����X�N�ɉ��������f��̑I��
����Ö@�ɂ������{�I�Ȑ��f��Ƃ��āCNK1��e�̝h�R��C5-HT3��e�̝h�R��C�f�L�T���^�]����3 �܂�����C�������Óf�����X�N�ɂ���Ďg�������Ă����i��CQ2�C3�C���f�Ö@�A���S���Y���C���f�Ẫ_�C�A�O�����j�B�ŋ߂�QI �����ɂ����ẮC�Óf�����X�N�ɉ������K�Ȑ��f�Ö@���ǂ̒��x�s���Ă��邩�C������m���ɍs���̐�����������Ă��邩���]�����ڂƂȂ��Ă���C�{�ݑS�̂̎��g�݂ł���Ƃ����F�����K�v�ł���B
5-HT3��e�̝h�R��́C��1 ����C��2 ����Ƒ����̎�ނ����邪, �ő���̐��f���ʂ邽�߂ɍŐV�̍����Ȗ�܂��g���Ă��L�����̗D���m�łȂ��ꍇ������B�R�����̍Óf�����X�N�����łȂ�, �ǂ̉��w�Ö@���W������, �ǂ̂悤�Ȑ��f���W������p���邩��, ��ꐢ��Ƒ��̎g��������������Ă���i��CQ4�j, �L�����������ł���������ȕ���I�����K�ɐ��f�Ö@���s���Ă������Ƃ����������B
���҂ł́C�R�����ȊO�ɂ��x���Ö@�╹���ǂɑ��鎡�Ö�p���Ă���ꍇ���������߁C���ݍ�p�ɂ�邻�ꂼ��̖���̕ω��ɂ����ӂ����I���E�p�ʒ��߂��K�v�ł���i��CQ17�j�B
�i4�j�o���R�����ɂ�����Óf�����X�N�]���Ɛ��f�Ö@
�o���R�����ɂ�����Óf�����X�N�ɂ��ẮCMASCC/ESMO �K�C�h���C��2016 ���Q�l�ɍ쐬�ψ�����ŃR���Z���T�X���m�F��, ����ȊO�̖�܂ɂ��Ă͏��F�\�����̃f�[�^�C��\�I�ȗՏ������̕��������\3 �Ɏ������X�N���ނƂ����B�킪���Ŏg�p�p�x�̍����e�K�t�[���E�M�����V���E�I�e���V���iS-1�j�ł́C���S�̔����p�x��3�`54���CGrade 3/4 ��0.2�`7.1���C�q�f�̔����p�x��14�`28���CGrade 3/4 ��1.2�`4.3���ƕ���Ă���C�y�x���X�N�ɕ��ނ����B�g���t�����W���E�`�s���V���iTAS-102�j�͈��S�ƚq�f�̔����p�x�����ꂼ��48���C28���ł��邱�Ƃ��璆���x���X�N�ɁC�A���N�`�j�u�͈��S�̔����p�x��13���ł���y�x���X�N�ɕ��ނ����i��CQ2�j�B�����o�`�j�u�ł͈��S�̔����p�x��41%, Grade 3 ��2.3���ł���, �����x���X�N�ɕ��ނ����B
| ���� | ��� |
|---|---|
| ���x�i�Óf���j���X�N high emetic risk �i�Óf�p�x�@��90���j |
|
| �����x�i�Óf���j���X�N moderate emetic risk �i�Óf�p�x�@30�`90���j |
|
| �y�x�i�Óf���j���X�N low emetic risk �i�Óf�p�x�@10�`30���j |
|
| �ŏ��x�i�Óf���j���X�N minimal emetic risk �i�Óf�p�x�@��10���j |
��1: �p��\�L�͖{�M�����F�B
�� 2: �u ���v�͊C�O�̃K�C�h���C���ɂ͋L�ڂ��Ȃ����C�킪���ł͎g�p�\�Ȗ�܁B
�i5�j���f�Ö@�̕]��
����, �R�����̕���p�ł��鈫�S�E�q�f�̕]�����@�Ƃ��Ă�, CTCAE (Common Terminology Criteria for Adverse Event) v4.0-JCOG 3)���p�����Ă��邪�C����͐��f�Ö@�̕]�����@�ł͂Ȃ��i��CQ12�j�B�]���̂킪���̐��f�Ö@�ɂ�����Տ������ł́C���S�E�q�f���u�Ȃ��v�C�u�䖝�ł���v����C�u�قƂ�ǐH�ׂ��Ȃ��v�Ƃ������`�F�b�N���ڂ����҂ɒ��ČX�̎��Ì��ʂ������Ă��炤�Ȃǂ̕��@���Ƃ��Ă����B�ŋ߂̗Տ������ł́C����Ö@�{�s��0�`120 ���Ԃ̊��S���䊄���C0�`24 ���Ԃ̊��S���䊄���i�}���j�C24�`120 ���Ԃ̊��S���䊄���i�x�����j�Ȃǂ��]�����ڂƂ��ėp�����Ă���i�\4�j�B�������C��Î҂͉ߏ��]���̌X�����w�E����Ă���C���S�E�q�f�̗\�����ǂ̒��x�ł��Ă��邩�̕]�����d�v�ł���4�j�B�܂�, ���Ҏ��g�ɂ���ϕ]���ɂ����� Patient-Reported Outcome (PRO) �̏d�v�����F������Ă��Ă���, ����Տ������ɂ����銳�҂̎��ȕ]���Ɋ�Â�, �L�Q���ە]���̐��m���ƍ������x�̃O���[�f�B���O��Njy�����c�[���Ƃ���PRO-CTCAE�����J����Ă��Ă���i�\5�j, ����f�ÂƂ��ċq�ϓI�]���Ƃǂ̂悤�ɂ��Ċ֘A�Â��ĕ]�����Ă��������Ɋւ��錟�����K�v�ɂȂ�ł��낤5)�B
���S�t�� |
�q�f�Ȃ��C�~��*�Ȃ� |
���S���� |
�q�f�Ȃ��C�~��*�Ȃ��C ���S�Ȃ��C�܂��͈��S�y�x |
*�~���X�L���[����
�f���C |
����7���ԂŁC�f���C�͂���܂������H |
||||||
| �Ȃ����� | �قƂ�ǂȂ����� | �Ƃ��ǂ� | �p�ɂ� | �قƂ�ǂ��� | |||
����7���ԂŁC�f���C�͈�ԂЂǂ����łǂ̒��x�ł������H |
|||||||
| �����������Ƃ͂Ȃ����� | �y�x | �����x | ���x | �ɂ߂č��x | |||
�q�f |
����7���ԂɁC�q�f�͂���܂������H |
||||||
| �Ȃ����� | �قƂ�ǂȂ����� | �Ƃ��ǂ� | �p�ɂ� | �قƂ�ǂ��� | |||
����7���ԂŁC�q�f�͈�ԂЂǂ����łǂ̒��x�ł������H |
|||||||
| �����������Ƃ͂Ȃ����� | �y�x | �����x | ���x | �ɂ߂č��x | |||
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
- ③ Hesketh PJ, Kris MG, Basch E, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
1�j �����r���D���f��K���g�p�K�C�h���C���Ɋւ���A���P�[�g�����D���Ɖ��ÁD2015; 42: 305-11�D
2�j �n���q�M�C���c�q�q�C�����T�v�D���{�����̗Տ������Ɋ�Â��R����܂̍Óf�����X�N���ށD���Ɖ��ÁD2015; 42: 335-41�D
3�j �L�Q���ۋ��ʗp��K��v4.0���{���JCOG��(CTCAE v4.0 - JCOG�j
http://www.jcog.jp/doctor/tool/CTCAEv4J_20170912_v20_1.pdf�iaccessed January 18, 2018�j
4�j Tamura K, Aiba K, Saeki T, et al. Testing the effectiveness of antiemetic guidelines: results of a prospective registry by the CINV Study Group of Japan. Int J Clin Oncol. 2015; 20: 855-65.
5�j PRO-CTCAE™ ���{���.
https: //healthcaredelivery.cancer.gov/pro-ctcae/pro-ctcae_japanese.pdf�iaccessed January 18, 2018�j
6�j Yana T, Negoro S, Takada M, et al. Phase�U study of amrubicin in previously untreated patients with extensive-disease small cell lung cancer: West Japan Thoracic Oncology Group�iWJTOG�jstudy. Invest New Drugs. 2007; 25: 253-8.
7�j Kimura K, Yamada K, Uzuka Y, et al. Phase�T study of N4-behenoyl-1-1-beta-d-arabinofuranosylcytosine and its phase�U study in adult acute leukemia. Current chemotherapy and immunotherapy. Proceedings. 12th International Congress of Chemotherapy, pp 1306-8, 1982.
8�j ���c�a�v�D�l�_�v���`���iNedaplatin�j�ɂ��āD���Ɖ��ÁD1996; 23: 79-87�D
9�j �ˉz�DPirarubicin�iTHP-Adriamycin�j�ɂ��āD���Ɖ��ÁD1998; 15: 2819-27�D
10�j Fujiyama S, Shibata J, Maeda S, et al. Phase I clinical study of a novel lipophilic platinum complex�iSM-11355�jin patients with hepatocellular carcinoma refractory to cisplatin/lipiodol. Br J Cancer. 2003; 89: 1614-9.
11�j �ē��B�Y�DNitrosourea �n�V�K�R����ACNU�o1-�i4-Amino-2-methyl-5-pyrimidanyl�jmethyl-2-�i2-chloroethyl�j-3-nitrosourea hydrochloride�p��Phase�T�����Phase�UStudy�D���Ɖ��ÁD1977; 4: 105-18�D
12�j �����O�C���D�������ᇐ������ɂ�����MCNU �̗Տ���Ⅱ �������DChemotherapy�D1985; 33: 271-8�D
13�j �ؑ��U���D���������ɂ��Videsine sulfate �̌Ō`��ᇂɑ���Phase�UStudy�D���Ɖ��ÁD1983; 10: 2036-42�D
14�j ���R���v�D�y�v���I�}�C�V���D���Ɖ��ÁD1980; 7: 1498-504�D
15�j Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiode-refractory thyroid cancer. N Engl J Med. 2015 ; 372: 621-30.
16�j Seto T, Kiura K, Nishio M, et al. CH5424802�iRO5424802�jfor patients with LK-rearranged advanced non-small-cell lung cancer�iAF-001JP study�j: a single-arm, open-label, phase 1-2 study. Lancet Oncol. 2013; 14: 590-8.
17�j Vidula N, Rugo HS. Cycline-dependent linase 4/6 inhibitors for the treatment of breast cancer: a review of preclinical and clinical data. Clin Breast Cancer. 2016; 16: 8-17.
18) Goss G, Tsai CM, Shepherd FA, et al. Osimertinb for pretreated EGFR Thr790Met-positive advanced non-small-cell lung cancer (AURA2): a multicenter, open-label, single-arm, phase 2 study. Lancet Oncol. 2016 ; 17 : 1643-52.
19) Kantarjian HM, Shah NP, Cortes JE, et al. Dasatinib in newly diagnosed chronic-phase chronic myeloid leukemia: 2-year follow-up from a randomized phase 3 trial (DASISION). Blood. 2012; 119: 1123-29
20) Flaherty KT, Robert C, Hersy P, et al. Improved survival with MEK inhibitor in BRAF-mutated melanoma. N Engl J Med. 2012 ; 367: 107-14.
21) Dummer R, Duvic M, Scarisbrick J, et al. Final results of multicenter phase II Study of the purine nucleoside phosphorylase (PNP) inhibitor forodesine in patients with advanced cutaneous t-cell lymphomas (CTCL) (Mydosis fungoides and Sé zary syndrome). Ann of Oncol . 2014 ; 1807-12.
CQ1
�o���R�����ɂ�鈫�S�E�q�f���ǂ̂悤�Ɏ��Â��邩
�����O���[�h
| C1 | �L�������������Տ������̃v���g�R�[�����Q�Ƃ��C�u���炩�̎x���Ö@�v���u�x��v���u���ʁv�̌��������CGrade 3 �ȏ�̈��S�E�q�f���������ɓ����p����}��B |
|---|
+ �w�i�E�ړI
�ߔN�C�o�����^�̍R��������Ă��Ă���C�E�זE���R������łȂ��C�����̕��q�W�I����Տ���������Ă���B
�ȑO���킪���ł́C�o���R�����̂����t�b���s���~�W����̎g�p�p�x�������C�咰����ɂ�����UFT/���C�R�{�����C�J�y�V�^�r���C�݂���ɂ�����S-1�C�x����ɂ�����UFT �͔�r�����ɂ��p��⏕�Ö@�̗L������������Ă���B�܂��C�؏��s�\�Ĕ��݂����咰����ɑ��Ă��CS-1 ��J�y�V�^�r���CUFT/���C�R�{�����C�咰����ɂ�����TAS102�i�g���t�����W���E�`�s���V�����_���j�́C�K�C�h���C���Ő�������Ă��鎡�Â̈�ł���B�����̌o���R�����͒P��ł̍Óf�����X�N�͏��Ȃ����C�A�������ɂ�������Ǐ���B
���q�W�I��́C�o����̕������S�E�q�f�������X���ɂ���C���ł��N���]�`�j�u�C�Z���`�j�u�C�����o�`�j�u�C�p�m�r�m�X�^�b�g��30���ȏ�̍Óf�����X�N������Ƃ���Ă���iNCCN�K�C�h���C��2017�j�B
�����o���R�����̎��Ì��ʂ邽�߂ɂ́C���p�A�h�q�A�����X�Ȃ�Ȃ��悤���S�E�q�f�d�v�ł���B
+ ���
�y�x���X�N�̌o���R�����ɑ��āCMASCC/ESMO �K�C�h���C��2016 �ł́C���f��3 ��ށi5-HT3��e�̝h�R��C�f�L�T���^�]���C�h�p�~����e�̝h�R��j��P�܂Ŏg�p���邱�Ƃ����߂��Ă��邪�C�ŏ��x���X�N�ɑ��鐧�f��̗\�h�I�g�p�͐�������Ă��Ȃ��B����CNCCN �K�C�h���C��2017 �ł́C�y�x�E�ŏ��x���X�N�̌o���R�������܂߂āC���S�E�q�f���������ۂɃ��g�N���v���~�h�C�v���N�����y���W���C5-HT3��e�̝h�R��Ȃǂ̘A�����^�i�K�v�ɉ����ăI�����U�s������[�p���p�j����������Ă���B�������C�o���R�����ɑ��鐧�f��̔�r�������Ȃ����߁C�����̐�������鐧�f�Ö@�̐M���x�͒Ⴂ�B�������C�����̌o���R�����̗L�����̃G�r�f���X����������r�����̃v���g�R�[�����݂�ƁCGrade 2 �̈��S�E�q�f�����������ꍇ�ɂ͂����ނˎx���Ö@���s�����܂��͋x�C�x���Ö@�ɂ���ăR���g���[���ł��Ȃ��ꍇ�ɂ́C���^�ʂ���i�K���ʂ���C�����Grade 3 �̈��S�E�q�f�����������ꍇ�́C���^�ʂ���i�K���ʂ��邱�Ƃ���ʓI�ł���B���������āC����Ö@�̃G�r�f���X���������Տ������̃v���g�R�[�����Q�l�ɁC����Տ��Ŏg�p����Ă����܂��g�p����ق��C�H���̍H�v�C�J�E���Z�����O�Ȃǂ̎x���Ö@�����{���C�R���g���[���s�ǂ̍ۂ͋x�C�R��������i�K���ʂ��čĊJ����Ƃ������������CGrade 3 �ȏ�̈��S�E�q�f���������CGrade 2�̈��S�E�q�f���p�����Ȃ��悤�ɓ������p�����邱�Ƃ����߂���B
�܂��C���x�E�����x���X�N�̌o���R�����ɑ��āCMASCC/ESMO �K�C�h���C��2016 �ł́C5-HT3��e�̝h�R��C���t�玿�X�e���C�h��2 �ܕ��p����������Ă���BNCCN �K�C�h���C��2017 �ł́C5-HT3��e�̝h�R��̌o���A�����^����������Ă��邪�C�V�N���z�X�t�@�~�h�C�G�g�|�V�h�C�e���]���~�h�ł́C����Տ��ɂ����Ď��ÖړI����ː����Õ��p�̂��߂ɕ��t�玿�X�e���C�h�����p����Ă��邱�Ƃ������B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
CQ2
����Ö@��̋}���̈��S�E�q�f���ǂ̂悤�ɗ\�h���邩
�����O���[�h
| A | ���x���X�N�̍R�����ɂ��}���̈��S�E�q�f�ɑ��ẮC�A�v���s�^���g�i�������̓z�X�A�v���s�^���g�j��5-HT3��e�̝h�R��уf�L�T���^�]���p����B |
|---|
| A | �����x���X�N�̍R�����ɂ��}���̈��S�E�q�f�ɑ��ẮC5-HT3��e�̝h�R��ƃf�L�T���^�]���p���C����̍R�������g�p����ꍇ�́C���ꂼ��̊��҂̏ɉ����ăA�v���s�^���g��lj��E���p����B |
|---|
| B | �J���{�v���`���iAUC��4�j�ɑ��Ă͍��x���X�N�̍R�����ɏ����āC�A�v���s�^���g�i�������̓z�X�A�v���s�^���g�j��5-HT3 ��e�̝h�R��уf�L�T���^�]���p����B |
|---|
+ �w�i�E�ړI
�R�����̍Óf�����X�N�́C���x�C�����x�C�y�x�C�ŏ��x��4 �i�K�ɕ��ނ����B�ǍD�Ȏ��ÃA�h�q�A�����X�āC���Â��~���ɐi�߂邽�߂ɂ��C�Óf�����X�N�̓K���ȕ]���ƌX�̏Ǘ�ɉ������\�h�I�Ώ����s���K�v������B
+ ���
�R����^��C24 ���Ԉȓ��ɏo������}���q�f�́C�R�����̎��ÃA�h�q�A�����X��W����ł��傫�ȗv���̈�ł���C���̗\�h���f���ʂ̐��ۂ͒x�����q�f�̎��Ì��ʂɂ��e�����y�ڂ�1�j�B���������āC���ɍÓf�����X�N�����x����ђ����x�̍R����^�ɍۂ��ẮC�}���q�f�𖢑R�ɖh���C����ɒx�����q�f�̎��Ô�������ǍD�ɕۂ��߂ɂ��C�ϋɓI�Ȑ��f��̓��^���s���K�v������B�ȉ��ɋ}���q�f�̗\�h��ړI�Ƃ��āC�R����^�O�ɍs���ׂ��Ώ����Óf�����X�N�ʂɊT������B
1�j���x���X�N
NK1��e�̝h�R��ł���A�v���s�^���g125 mg �o�����^2�j�������̓z�X�A�v���s�^���g150 mg �Ö������^��5-HT3��e�̝h�R��уf�L�T���^�]��9.9 mg �Ò��i12 mg �o���j��3 �ܕ��p�����������B��1 �����5-HT3��e�̝h�R��ƃf�L�T���^�]����2 �ܕ��p�ɔ�ׁC�A�v���s�^���g��������3 �܂p���邱�ƂŐ��f��p�̒��������P��������Ă���3�j�`5�j�B��1 �����5-HT3��e�̝h�R��i��CQ4 �Q�Ɓj�́C�P�܊Ԃ̒��ڔ�r����уf�L�T���^�]�����p���ł̔�r�ɂ����āC��܊Ԃ܂����̓��^�o�H�ɂ���Č��ʂɑ傫�ȍ��͂Ȃ�6�j�`8�j�C�p�ʂⓊ�^�̉e�����Ȃ����Ƃ���9�j�`12�j�C�R����^�J�n�O�ɕK�v�ʂ�P�^�Ƃ���B��2 ����5-HT3��e�̝h�R��̃p���m�Z�g�����́C�P�܊Ԃ̒��ڔ�r����уf�L�T���^�]�����p���ł̔�r�ɂ����āC�}���q�f�̗\�h���ʂ͑���܂Ɠ����ł��邪�C�x�����q�f�̗\�h�ɂ����ėD��Ă���13�j14�j�i��CQ3 �Q�Ɓj�B�f�L�T���^�]���̗p�ʁi��CQ5 �Q�Ɓj�ɂ��ẮC��1 �����5-HT3��e�̝h�R��Ƃ�2 �ܕ��p�ł�13.2�`16.5 mg ��Ò��i16�`20 mg ���o���j�Ƃ���Ă������C�A�v���s�^���g�Ƃ̕��p�ł́C�A�v���s�^���g��CYP3A4 ��j�Q���邱�Ƃɂ��f�L�T���^�]���̔Z�x-���ԋȐ����ʐρiarea under the concentration-time curve; AUC�j���������邽�߁C3 �ܕ��p�ł�9.9 mg �Ò��i12 mg �o���j�Ɍ��ʂ���B�������C���t�玿�X�e���C�h���R�����Ƃ��ē��^�����CHOP �Ö@�Ȃǂł̓��W�������̃X�e���C�h�͌��ʂ��Ă͂Ȃ�Ȃ��B�A�v���s�^���g�̓��^���Ԃ�3 ���Ԃ����������B�z�X�A�v���s�^���g�̓A�v���s�^���g�̐��n�������コ���������_���v���h���b�O�ł���C�Ö������^��ɑ̓��̒E�����_���y�f�ɂ���đ��₩�Ɋ����{�̂ł���A�v���s�^���g�ɕϊ������B�z�X�A�v���s�^���g�̓I���_���Z�g�����C�f�L�T���^�]���Ƃ�3 �ܕ��p�ŃA�v���s�^���g�Ƃ̓�������������Ă���15�j�C5-HT3��e�̝h�R��ƃf�L�T���^�]�����p���ł̍R����^30 ���O�C150 mg �̒P��g�p�����������B�������C����p�Ƃ��Ē��˕��ʒ�/����/���𐫐Ö����̕p�x���������Ƃɗ��ӂ��ׂ��ł���B
NCCN �K�C�h���C�� 2015 �ł́C�A�v���s�^���g�̑���ɑ���e�̍�p�R���_�a��iMARTA�j�ł���I�����U�s�����p���m�Z�g�����ƃf�L�T���^�]����3 �ܕ��p�ŗp����I�v�V�����������ꂽ�B����ɓ�2017�ł́C�V���ɃA�v���s�^���g�i�܂��̓z�X�A�v���s�^���g�j�C�p���m�Z�g�����C�f�L�T���^�]����3�ܕ��p�ɃI�����U�s���������郌�W���������ꂽ�B�����́C�V�X�v���`����AC�Ö@���܂ލ��x���X�N�R����^�ɍۂ��C�I�����U�s�����C�p���m�Z�g�����ƃf�L�T���^�]�����p���ɂ����ăA�v���s�^���g�Ɠ����ł��邱�Ƃ������ꂽ��V�������_������r����16�j��C�A�v���s�^���g�i�܂��̓z�X�A�v���s�^���g�j�C�p���m�Z�g�����C�f�L�T���^�]����3�ܕ��p�ɃI�����U�s����������L�p���������ꂽ��III�������_������r����17�j�̌��ʂ��Ă���BASCO �K�C�h���C��2017 �ł��I�����U�s����������4�ܕ��p�������Ö@�Ƃ��Ēlj����ꂽ�B�I�����U�s���͂킪���ł������̗Տ��������s��ꂽ18)-21)�B�I�����U�s���͌��m�\���ɂ��2017 �N6 ������C���̐��f��Ƃ̕��p�ɂ����Đ��l�ł�5�r ��1 ��1 ��o�����^�i���ҏ�Ԃɂ��ő�1��10�r �܂ő��ʉ\�j�C�ő�6 ���Ԃ�ڈ��Ƃ��Đ攭�i�ƈꕔ�̌㔭�i�ŕی����ɂĎg�p���\�ƂȂ����B�{�M�ɂ����鐄���p�ʁC�g�p���@�ɂ��Ă͖������ؒi�K�ł��邽�߁C�K�Ȋ��҂ɐT�d�ɓ��^���邱�Ƃ��]�܂��B�T�d���^���ׂ����҂Ƃ��ẮC���A�a���҂Ȃ�тɍ��������邢�͔얞���̓��A�a�̊댯���q��L���銳�҂ł���C�g�p�ɍۂ��Ă͕���p�̌X���⌌���㏸�ɏ\�����ӂ���B����҂ւ̓��^���T�d�ɍs���ׂ��ł���B��p�_���d������h�p�~��D2 ��e�̝h�R��h���y���h���C���g�N���v���~�h�C�n���y���h�[���C���X�y���h���ȂǂƂ̕��p�͊��߂�ꂸ�C�܂��C������Ƃ̕��p�ɂ͒��ӂ�v����B���^�ʂɊւ��Ă̓����_������Ⅱ �������ł͂��邪�C���x���X�N�R����^�ɑ�3�ܕ��p�ɉ������I�����U�s��5 �r ��10 �r�ł͒x�����̈��S�E�q�f�̐���ɂ����ē����ł������Ƃ̕�����21�j�B
2�j�����x���X�N
��{�I��5-HT3��e�̝h�R��ƃf�L�T���^�]��6.6�`9.9 mg ��Ò��i8�`12 mg ���o���j��2 �ܕ��p�Ƃ��邪�C�ꕔ�̍R�����i�J���{�v���`���C�C�z�X�t�@�~�h�C�C���m�e�J���C���g�g���L�T�[�g���j�𓊗^����ꍇ�ɂ̓A�v���s�^���g125 mg �o�����^�������̓z�X�A�v���s�^���g150 mg �Ö������^�̕��p����������C���̍ۂɂ̓f�L�T���^�]�������ʁi�Ò�: 3.3�`4.95 mg�C�o��: 4�`6 mg�j����i�����f�Ẫ_�C�A�O����② �Q�Ɓj�B�܂��C�킪���ł�400 �����I�L�T���v���`�����^���҂ɑ����III�������_������r�������s���C5-HT3��e�̝h�R��ƃf�L�T���^�]�����p���ɂ����āC�A�v���s�^���g/�z�X�A�v���s�^���g�Q���R���g���[���Q���S���Ê��ԁC���ɒx�����̈��S�E�q�f�̐���ɗD��邱�Ƃ������ꂽ22�j�B
�Ȃ��z�X�A�v���s�^���g�̊C�O��III�������_������r�����Ƃ��āC�����x���X�N�̐��f�Âɂ�����5-HT3 ��e�̝h�R��ƃf�L�T���^�]�����p�ɑ���z�X�A�v���s�^���g�̏�悹���ʂ�����Ă���23�j�B
�J���{�v���`���͈�ʓI�ɂ͒����x���X�N�̍R�����ɕ��ނ���邪�C���p�ʂł̎g�p�ɍۂ��Ă͓��ɍÓf�����X�N�������Ȃ邽�߁C�ʏ�̒����x���X�N�̍R�����̈��S�E�q�f�\�h�@�Ƃ͈قȂ�Ǝv����B21 �̐��f�Ö@�����̃��^�A�i���V�X24�j�ł́C�J���{�v���`�����W�����ɑ���A�v���s�^���g�g�p�ɂ����Ė��炩�ɗՏ��I�L�v�����������Ƃ���C�}���E�x�����ɂ����č��x���X�N�̍R�����ɏ��������f�Ö@���s�����Ƃ��O���[�hB�Ƃ��Đ��������B�Ȃ�NCCN�K�C�h���C���ł�AUC��4 �����x���X�N�Ƃ���Ă��邪�C���̋��E�l4�Ɋւ���G�r�f���X�͕s���ł���B
3�j�y�x���X�N�i��CQ7 �Q�Ɓj
�f�L�T���^�]��3.3�`6.6 mg �Ò��i4�`8 mg �o���j�P�ܓ��^���C�ɉ����ăv���N�����y���W���������̓��g�N���v���~�h���g�p����B����Ƀ����[�p����H2��e�̝h�R�邢�̓v���g���|���v�j�Q��̕��p�����������i�����f�Ẫ_�C�A�O����③ �Q�Ɓj�B
4�j�ŏ��x���X�N
�ŏ��x���X�N�̍R�����ɑ��Ă̐��f��͊�{�I�ɕs�v�ł���B
��܂̍Óf�����X�N���ނ͒P�܂ł̕]������{�ł��邪�C�����܂ł����Ă����^�ʁC���^�@�ɂ���ĈقȂ�C����ɋߔN�ł͂�����̈�����ᇂɂ����Ă����ܕ��p�Ö@���嗬�ƂȂ��Ă��邽�߁C�Óf�����X�N���ߏ��]���ƂȂ�Ȃ��悤�אS�̒��ӂ��ׂ��ł���B���̓_�Ɋւ��āC�A���g���T�C�N�����ƃV�N���z�X�t�@�~�h�̕��p�Ö@�ɂ��āC���ꂼ��P�܁i�V�N���z�X�t�@�~�h��1,500 mg/m2�j�ł͒����x���X�N�ɕ��ނ���邪�CNCCN �K�C�h���C��2017 �ł͍��x���X�N�Q�Ƃ��Ė��L����CMASCC/ESMO �K�C�h���C��2016 �����ASCO �K�C�h���C��2017 �ɂ����Ă��q�f�p�x���������Ƃ�������Ă���k�����_�C3�j�{�K�C�h���C����p�������f�Ö@�C�i1�j���S�E�q�f�ɑ��郊�X�N�̔c���Q�Ɓl�B����ɁC�R���������ɂ킽���Ď{�s���郌�W�����̏ꍇ�C��܂̓��^�����ɉ����ċ}���q�f�ƒx�����q�f���d������ꍇ������C���Ȗ��Ȏ��Ìv�悪�]�܂��B���̈��Ƃ��ă����p��ɂ�����ESHAP �Ö@�ł́C1 ���ڂ���4 ���ڂ͒����x���X�N�Ƃ��đΏ����C���p�ʃV�^���r�������^�����5 ���ڈȍ~�͍��x���X�N�Ƃ��đΏ�����B
�y�Q�Ɓz ���Ăł́C�V�KNK1��e�̝h�R��Ƃ��āC���������A�v���s�^���g��蒷��Netupitant �ƃp���m�Z�g�����̍��܂ł���NEPA�CRolapitant ���g�p����Ă���B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② Berger MJ, Ettinger DS, Aston J, et al. NCCN Guidelines Insights: Antiemesis, Version 2.2017. J Natl Compr Canc Netw. 2017; 15: 883-893.
- ③ MASCC/ESMO Antiemetic Guidelines 2016
- ④ Hesketh PJ, Kris MG, Basch E, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
CQ3
����Ö@��̒x�����̈��S�E�q�f���ǂ̂悤�ɗ\�h���邩
�����O���[�h
| A | ���x���X�N�̍R�����ɂ��x�����q�f�ɑ��ẮCNK1��e�̝h�R��A�v���s�^���g�ƃf�L�T���^�]���p����B |
|---|
| A | �����x���X�N�̍R�����ɂ��x�����q�f�ɑ��ẮC�f�L�T���^�]����P�ƂŎg�p����B�Ǘ�ɉ����ăA�v���s�^���g�ƃf�L�T���^�]���p�C��������5-HT3��e�̝h�R��C�A�v���s�^���g��P�ƂŎg�p����B |
|---|
| B | �J���{�v���`���iAUC��4�j�ɑ��Ă͍��x���X�N�̍R�����ɏ����āC�A�v���s�^���g�ƃf�L�T���^�]���p����B |
|---|
+ �w�i�E�ړI
�x�����q�f�́C�R����^��24 ���Ԉȍ~�ɔ���������́C�ƒ�`����Ă���C���̃R���g���[���́C���҂�QOL �ێ��C����ɐ��_�I����⎡�Âɑ���ӗ~�̌���̂��߂ɂ��K�v�s���ł���B��܂̍Óf�����X�N��K���ɕ]�����C�G�r�f���X�Ɋ�Â������f��̓K�Ȏg�p����������K�v������B
+ ���
ASCO �K�C�h���C��2017 �ɂ��C�x�����q�f�́C���x�Ƃ��Ă͌y�x�Ȃ��̂��������C�}���q�f�̑Ώ����s�\���ȂƂ��ɋN����₷���Ƃ����B���ÂƂ��Ă͕��t�玿�X�e���C�h�i�o���f�L�T���^�]���j����������Ă���C���g�N���v���~�h��5-HT3��e�̝h�R��Ƃ����p�����B�������C�f�L�T���^�]���ɉ���5-HT3��e�̝h�R��p���Ă����f���ʂ̑����͓����Ȃ��B����ɁC�}���q�f��F�߂��ꍇ�ɂ͂����2 �܂p���Ă����ʂ͕s�\���ł���Ƃ���Ă��邽��1�j�C�R�����̍Óf�����X�N�⊳�҂̏�Ԃɉ����Ă����ꂩ����̎g�p�ɂƂǂ߂�ׂ��Ǝv����B
1�j���x���X�N
�����_������r������v�[���h�A�i���V�X�̌��ʂł́C�f�L�T���^�]��4�`8 mg �o�����^�i2�`3 ���ځj��NK1��e�̝h�R��ł���A�v���s�^���g80 mg �o�����^�i2�`3 ���ځj�̕��p���f�L�T���^�]���P�Ƃ��L�p�ł�����2�j�`5�j�B����2 �ܕ��p�́C5-HT3��e�̝h�R��ƃf�L�T���^�]���̕��p�ɔ�ׂĂ��L�ӂɒx�����q�f��}�����Ă���i21�� vs.36���Cp��0.001�j6�j�CASCO �K�C�h���C��2017�CMASCC/ESMO �K�C�h���C��2016 �Ő�������Ă���B
�܂��CMASCC/ESMO �K�C�h���C��2016 �ł�5-HT3��e�̝h�R��ƃf�L�T���^�]�� �i12 mg �Ɍ��ʁ�CQ2 �Q�Ɓj�ƃA�v���s�^���g�ɂ��3 �ܕ��p�Ö@���C���x���X�N�̍R�����ɂ��}���q�f�Ɠ��l�ɒx�����q�f�ɑ��Ă���������Ă���B
��1 ����̊e5-HT3��e�̝h�R��̐��f���ʂɍ��͂Ȃ��Ƃ���Ă��邪7�j8�j�C�킪���ōs��ꂽ���x���X�N�̍R����^�ɑ���C��2 �����5-HT3��e�̝h�R��p���m�Z�g����9�j10�j�ƃf�L�T���^�]���̕��p�Q�ƃO���j�Z�g�����ƃf�L�T���^�]���̕��p�Q�̐��f���ʂ�����������III�������_������r�����ɂ����āC�p���m�Z�g�����ƃf�L�T���^�]���̕��p�Q���L�ӂɒx�����q�f��}���������Ƃ�������Ă���11�j�i�����f�Ẫ_�C�A�O����① �Q�Ɓj�B�܂��C���x���X�N�̍R����^�ɑ���p���m�Z�g�����C�f�L�T���^�]���C�A�v���s�^���g���p�Q�ƁC�O���j�Z�g�����C�f�L�T���^�]���C�A�v���s�^���g���p�Q�̐��f���ʂ̔�r���s������III�������_������r�����iTRIPLE �����j������C��v�]�����ڂł͂Ȃ����p���m�Z�g�����Q���x�����ɂ����ėL�ӂɈ��S�E�q�f��}���������Ƃ������ꂽ12�j�B
���x���X�N�̍R�����̂Ȃ��ŁC�A���g���T�C�N�����n�R�����ƃV�N���z�X�t�@�~�h���܂ރ��W�����͍����ƂȂ�Տ����������̍��x���X�N�R�����Ƃ͈قȂ�B
�A���g���T�C�N����+�V�N���z�X�t�@�~�h���p(AC�j�Ö@�ɂ����ăA�v���s�^���g���g�p���Ȃ��Տ������̃G�r�f���X����C2 ���ڈȍ~�̃f�L�T���^�]���̏�悹���ʂ͏ؖ�����Ă��Ȃ�13�j�B����ɃX�e���C�h�̕���p��������ړI�ŁCAC �Ö@�ɑ���2�`3 ���ڂ̃X�e���C�h�g�p���s��Ȃ�steroid sparing �Ƃ������^�@�́C�X�e���C�h�ʏ�g�p�ɑ������C�O�̑�III�������_������r�����Ŏ�����Ă���13�j14�j�B�{�M�ł��C�A�v���s�^���g�i�܂��̓z�X�A�v���s�^���g�j�p������III�������ɂ����āCAC�Ö@���܂ލ��x���X�N�R�����ɑ���steroid sparing ���\�ł��邱�Ƃ������ꂽ14)�B�������g�p���ꂽ5-HT3��e�̝h�R��̓p���m�Z�g�����݂̂ł��邱�Ƃɗ��ӂ���K�v�͂���B���������āCAC �Ö@�ɂ����ẮCsteroid sparing �͑I�����̈�ƂȂ�i��CQ5 �Q�Ɓj�B
�܂�MASCC �̃K�C�h���C���ł́C�@NK1 ��e�̝h�R����g�p���Ȃ��ꍇ�̓X�e���C�h��3���ԁC�ANK1 ��e�̝h�R����g�p����ꍇ�̓X�e���C�h��1 ���Ԏg�p�����搂��Ă��邪�C�@Aapro ��̘_���ł́CNK1 ��e�̝h�R����g�p���Ȃ��ꍇ�ł��C�p���m�Z�g�����p����Ƃ�����������steroid sparing ���\�ł���ƕ���Ă���C�A�Ɋւ��ẮC2�`3 ���ڂ̃X�e���C�h��2�`3 ���ڂ̃A�v���s�^���g�Ɠ����ł���15�j�Ƃ���������C���ƂȂ�G�r�f���X�̔w�i������ɒ��ӂ��K�v�ł���B�{�M�ɂ�����steroid sparing �Ɋւ���ł��C�p���m�Z�g�������p���̕�16�j��C�A�v���s�^���g�ƃp���m�Z�g������2 �ܕ��p��17�j�ȂǏ������قȂ邽�ߗ��ӂ���K�v������B
CHOP �Ö@�����x�Óf�����X�N�ɕ��ނ���Ă���B���������Տ��ł͐��f��Ƃ���2 �ܕ��p���s����X���ɂ���B����͍��p�ʂ̃v���h�j�]������5 ���ԓ��^���邽�ߒx�����̈��S�q�f���Ⴂ�ƍl�����Ă��邽�߂ł���C���ۂɉ䂪���ōs��ꂽCINV �ώ@�����ł́C79%��2 �ܕ��p���s���Ă���18�j�BCHOP �Ö@�ɑ���NK1 ��e�̝h�R��̗L�����ɂ��ẮC1 �R�[�X�ڂ�2 �ܕ��p���s���C2 �R�[�X�ڂ���NK1 ��e�̝h�R�����悹���鎎��������Ă���19�j�B�܂���2 �����5-HT3��e�̝h�R��̗L�����ɂ��Č��������������̑O�����������{�M������Ă���20�j 21�j�B2 �ܕ��p�C3 �ܕ��p�̂ǂ��炪�ǂ����ɂ��Ẵ����_������r�����́C��II�������ł̕����Ȃ�22�j�C����̌������K�v�ł���B
�y�Q�Ɓz 2015ASCO ����ŕ��ꂽ������ɑ���A���g���T�C�N�����n�R�����ƃV�N���z�X�t�@�~�h���܂ރ��W�����ɑ���f�L�T���^�]��/�z�X�A�v���s�^���g���p���ł̃O���j�Z�g�����ƃp���m�Z�g�����̔�r���s�����킪���̑�III�������_������r�����iWJOG6811B �����j�ł́C��v�]�����ڂł���x�������S�E�q�f�̊��S���䊄���ɂ����ė��Q�ԂɗL�Ӎ��͔F�߂��Ȃ�������23�j�C�]�����ڂł̓p���m�Z�g�����Q���x�����ɂ����ėL�ӂɈ��S��}�������B
2�j�����x���X�N
5-HT3��e�̝h�R��������̓f�L�T���^�]���Ƃ̕��p�́C�e�P�ƗÖ@�ƌ��ʂɍ��͂Ȃ�24�j25�j�C��p�Ό��ʂɂ�����5-HT3��e�̝h�R��̗L�p���͋^�킵���Ƃ���Ă���i�p���m�Z�g�����͂��̌����Ɋ܂܂�Ă��Ȃ��j26�j�B�������C�̉��ȂǂŃf�L�T���^�]�����g�p�ł��Ȃ��ꍇ�́C5-HT3��e�̝h�R���p���邱�Ƃ�����B����ɒx�����q�f�ɂ�����p���m�Z�g�����P�Ɠ��^�̗L�p����dolasetron �Ƃ̔�r�Ŗ��炩�ɂ�����III�������_������r�����̌��ʂ�����C�x�����q�f�ɑ���p���m�Z�g�����P�Ǝg�p�́C�����_�ł̓I�v�V�����̈�ƍl������27�j�i�Ȃ��C�����ł����P�ƗÖ@�Ƃ͒x�����q�f�ɑ�����̂ł���C�}���q�f�ɑ���Ö@�Ɋւ��Ă�CQ2 ���Q�Ƃ��ꂽ���j�B5-HT3��e�̝h�R��ƕ��t�玿�X�e���C�h�͐��f���ʁCQOL ���P���ʂɂ����ē����ł���ƕ�����III�������_������r����������28�j�BMASCC/ESMO �K�C�h���C��2016�CASCO �K�C�h���C��2017 �ł́C�����x���X�N�R�����ɂ��x�����q�f�ɑ��āC�O�q�����p���m�Z�g�����ƃf�L�T���^�]���̕��p�Ö@����������Ă���i�����f�Ẫ_�C�A�O����② �Q�Ɓj�B
�A�v���s�^���g�ƃf�L�T���^�]���̕��p�������̓A�v���s�^���g�P�Ɠ��^�̒x�����q�f�ɑ���L�p����NCCN �K�C�h���C��2017 ��C���r���[29�j�Ŏ�����Ă���B�X�̗Տ������ł́C�����x���X�N�ɑ���A�v���s�^���g���܂�3 �܂̌��ʂ��݂������_������r����������30)�B���݂͍��x���X�N�ɕ��ނ����AC �Ö@�����܂܂�Ă��鎎���ł��邪�CAC �Ö@�ȊO�̒����x���X�N�ɂ����Ă��ꎟ�]�����ڂł���u5 ���Ԛq�f�Ȃ��v�̊������L�ӂɃA�v���s�^���g�Q�ō��������B�������C����̓T�u�O���[�v��͂ł���_�ɒ��ӂ��K�v�ł���B�킪���ł��C��d�ӌ��ł͂Ȃ����Ƃɗ��ӂ���K�v�����邪�C�I�L�T���v���`���x�[�X�̍R������p����咰����Ǘ�ɂ����āC5-HT3��e�̝h�R��ƃf�L�T���^�]���̕��p�Ö@�ɃA�v���s�^���g/�z�X�A�v���s�^���g�̏�悹���ʂ��C�S���Ԃ���ђx�����ɂ�����q�f���䊄���ŏؖ�������III�������_������r�����iSENRI ����31�j�j�̕�����B����ɁCAC �Ö@�����O���������x���X�N���đ�1 ����5-HT3��e�̝h�R��i�I���_���Z�g�����C1�`3 ���ځj�C�f�L�T���^�]���i1���ڂ̂݁j��2 �ܕ��p�Q�ɑ��ăz�X�A�v���s�^���g���p�̌��ʂ����������_������r����������32�j�B7 ���ȏ�̊��҂ɂ����ăJ���{�v���`���C�I�L�T���v���`�����܂ރ��W�������g�p����Ă����B�����ł͑ΏƌQ�̃I���_���Z�g�����i1�`3 ���ځj�C�f�L�T���^�]���i1���ڂ̂݁j��2 �ܕ��p�Q�ɔ�ׂāC��v�]�����ڂł��銮�S�q�f���䊄����3�ܕ��p�Q�ŗL�ӂɍ��������i77.1�� vs. 66.9���j�B
�����͒j���ɔ�Óf���X�N���������Ƃ��m���Ă���i��CQ11�Q�Ɓj�B�{�M�̌ċz��̈�ƕw�l�ȗ̈�ɂ����鐧�f�Ö@�̑�II�������̕ł́C�����J���{�v���`����p���Ă��C�A�v���s�^���g���܂�3�ܐ��f�Ö@��p�����ꍇ�C�S���Ԛq�f���S���䊄���́C�ċz��̈�ł�8�����x�ł���̂ɑ��C�w�l�ȗ̈�ł�6�����x�ł�����33�j�`36�j�B�܂��C�w�l�ȗ̈�̈�����ᇂŃJ���{�v���`����p����ۂɁC��1����5-HT3��e�̝h�R��ƃf�L�T���^�]���݂̂�p�����Q�ɔ�ׁC�����ɃA�v���s�^���g���������Q�ł́C�u�g�H���␅�����ۂ�Ȃ��������S�h���Ȃ��v�Ɓu�T���Ԛq�f�Ȃ��v�̊��������ꂼ��L�ӂɍ�������33�j�B�������C�����]�����ڂƂ��Đ��f���ʂ��݂������ł���C2,3 ���ڂɂ̓f�L�T���^�]�����p�����Ă��Ȃ��Ƃ�������������B
�ȏ���C�X�̍R�����Ƃ��Ă͒����x���X�N�ɕ��ނ���邪�x�������S�E�q�f�����ɂȂ�ȂǍÓf�����X�N�̍������W�������g�p����ۂɂ́CNK1��e�̝h�R���p���邱�Ƃ��l������B
�J���{�v���`���Ö@�ɂ����Ă͋}���E�x�����ɂ����č��x���X�N�̍R�����ɏ��������f�Ö@���s�����Ƃ��O���[�hB�Ƃ��Đ��������B�i��CQ2�j
�܂��C�����x���X�N�R�����ɑ���2�`3 ���ڂ̃X�e���C�h�g�p���s��Ȃ�steroid sparing �͂킪���̑�III�������_������r�����ł��\�ł������Ƃ̕�����16�j�B
3�j�y�x���X�N�E�ŏ��x���X�N
�����_������r�����͍s���Ă��炸�C��ʓI�ɂ͌y�x���X�N�E�ŏ��x���X�N�R�����ɑ��Đ��f��͐�������Ȃ��i�����f�Ẫ_�C�A�O����③ �Q�Ɓj�B
�ߔN�C����e�̍�p�R���_�a��iMARTA�j�ł���I�����U�s�����C���x����ђ����x���X�N�R�����ɂ��x�����ł̈��S�E�q�f�̃R���g���[���ɗL�p�ł���Ƃ̕������Ȃ���Ă���30�j37�j�`44�j�B�킪���ɂ����Ă��Տ��������ʂ���������Ă���45�j�`48�j�C���Ăł̃R���Z���T�X��C�Տ��I�Ӌ`����2017 �N6 ������W���I���f�Ö@�ɕ��p�Ƃ��Ďg�p�ł���悤�ɂȂ����i��CQ2�CCQ13 �Q�Ɓj�B�x�������S�E�q�f�̐�����s�����߂̗L���Ȗ�܂Ƃ��Ă킪���ł̂���Ȃ錤�������҂����B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② Berger MJ, Ettinger DS, Aston J, et al. NCCN Guidelines Insights: Antiemesis, Version 2.2017. J Natl Compr Canc Netw. 2017; 15: 883-893.
- ③ MASCC/ESMO Antiemetic Guidelines 2016
- ④ Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
- ⑤ ���{�����w��ҁD�Ȋw�I�����Ɋ�Â������f�ÃK�C�h���C�� ① ���Õ� 2015 �N�ŁC �����o�ŁC�����C2015�D
- ⑥ Hesketh PJ. Chemotherapy-induced nausea and vomiting. N Engl J Med. 2008; 358: 2482-94.
- ⑦ Naeim A, Dy SM, Lorenz KA, et al. Evidence-based recommendations for cancer nausea and vomiting. J Clin Oncol. 2008; 26: 3903-10.
�Q�l����
CQ4
��1/2 �����5-HT3��e�̝h�R����ǂ̂悤�Ɏg�������邩
�����O���[�h
| C1 | ���x���X�N�R�����i50 mg/m2�����̃V�X�v���`���������j�ɑ���CINV �̗\�h�Ƃ��āCNK1��e�̝h�R��{5-HT3 ��e�̝h�R��i1 ���ځj�{�f�L�T���^�]���i1�`4 ���ځj��3 �ܕ��p�ɂ́C��2 ����5-HT3��e�̝h�R�D�܂��B |
|---|
| C1 | �����x���X�N�ɕ��ނ����R�����ł��邪�C�Óf���̍������W�����ɑ���CINV �̗\�h�Ƃ��āCNK1��e�̝h�R���p����ꍇ�ɂ͑�1 �����5-HT3��e�̝h�R��������CNK1��e�̝h�R���p���Ȃ��ꍇ�ɂ͑�2 �����5-HT3��e�̝h�R�D�܂��B |
|---|
+ �w�i�E�ړI
���܂��܂Ȑ��f���y�������Ƃɔ����C�}�����̈��S�E�q�f�̃R���g���[���͔�r�I�ǍD�ƂȂ������߁C�x�������S�E�q�f�ւ̑V���ȉۑ�ł���Ƃ�����1�j�B�x�������S�E�q�f�́C���x���X�N�̍R�����iHEC�j��p����ꍇ�����łȂ��C�����x���X�N�̍R�����iMEC�j�ɂ����Ă����p�Ȃǂɂ��Óf���̍������W������p����ꍇ�ɖ��ƂȂ�B
�x�������S�E�q�f�ɑ��鐧�f��Ƃ��āC�f�L�T���^�]���C5-HT3��e�̝h�R��CNK1��e�̝h�R����i��CQ3 �Q�Ɓj�B�ߔN�C��2 �����5-HT3��e�̝h�R��i�p���m�Z�g�����j���Տ���������CASCO�i2011 �N�j�CMASCC/ESMO�i2010 �N�j�̃K�C�h���C���ł́CHEC �ɂ̓A�v���s�^���g�i�z�X�A�v���s�^���g�j�{5-HT3��e�̝h�R��{�f�L�T���^�]����3 �ܕ��p�𐄏����C��2����5-HT3��e�̝h�R��ł���p���m�Z�g�������D�܂����Ƃ��Ă����B
��1 ����Ƒ�2 �����5-HT3��e�̝h�R����r�������܂��܂ȗՏ��������s��ꂽ���C�ȉ��Ɏ����悤��3 �ܕ��p���f�Ö@�ɂ����ẮC��1 ����ɔ�ׂđ�2 ���オ���炩�ɗD��Ă��邱�Ƃ������m����G�r�f���X�͂Ȃ��B�������C�x�������S�E�q�f�̗\�h�ړI�ɐ��f���I������ۂɂ́C�R����Ƃ̍Óf���̃��X�N���ނɂƂǂ܂炸���W�����̍Óf�����X�N��F�����āC���҂̃��X�N�i��CQ11 �Q�Ɓj�╹���ǂ��l�����C�܂���ܔ���������āC�f�L�T���^�]���CNK1��e�̝h�R��̎g�p����ё�1 ����܂��͑�2 �����5-HT3��e�̝h�R���I������K�v������B
�Óf�����X�N�͍R����Ƃɒ�߂��C���f����g�p���Ȃ��ꍇ��30�`90���̊����ň��S�E�q�f����������̂�MEC �ɕ��ނ����BMEC �ɕ��ނ����R�����͂��ꎩ�̂̍Óf�����X�N�̕����傫�������łȂ��C���p�Ö@���܂߂����W�����̒��ɂ́C��1 ����5-HT3��e�̝h�R��ƃf�L�T���^�]����p����݂̂łقƂ�Lj��S�E�q�f�������Ȃ����̂��������ŁCHEC ���x�������S�E�q�f�̃��X�N���������̂�����1�j�B���̂悤��MEC �ɕ��ނ����R������p�������ׂẴ��W�����ɑ��āC��������鐧�f��̑g�ݍ��킹��1 �Ɍ��邱�Ƃ͖���������Ǝv����B�{�K�C�h���C���ł͂��ꂼ��̃��W�������ƂɍÓf�����X�N���L�ڂ���Ă���i�����X�N���ނ���݂����킪��ʂ̃��W�����ꗗ�Q�Ɓj�B�t�ɁC90������Óf�p�x������Ƃ����HEC �ɕ��ނ����R������p�������W�����ɂ��C�������ăV�X�v���`����p���郌�W�����ȂǁCHEC �ɕ��ނ����R������p�������W�����ɂ��C�������ăV�X�v���`����p���郌�W�����ȂǁCMEC �ȉ��̍Óf�����X�N�ɂȂ���̂�����B�܂��C���ґ��̈��q�Ƃ��āC���ʂ�N����S�E�q�f�̃��X�N�Ƃ��Ēm���Ă���i��CQ11 �Q�Ɓj�B�����X�N�̊��҂ɂ́C��܂��Ƃɒ�߂�ꂽ���X�N������i�K�������X�N�ɑ��鐧�f�Ö@��p����ȂǁC���L����CINV ��h��������l�����邱�Ƃ����߂���B����ɁC���A�a�Ȃǂ̕����ǂ��l������K�v������B
�Ȃ��C�{���ł́C�m����G�r�f���X���Ȃ��R���Z���T�X�������Ȃ��C�܂��͎Q�Ɖ\�ȗՏ������f�[�^���Ȃ��ꍇ�ɂ́C��ܔ���������đ�1 ������u��������v�Ƃ����B�t�ɁC��2 ���オ��1 �����薾�炩�ɗL���ȃG�r�f���X�͂Ȃ����C�]�����ڂ�T�u�Z�b�g��͂̌��ʂɂ��R���Z���T�X��������ꍇ�ɂ́C��2 ������u�D�܂��v�Ƃ����B
+ ���
1�j�P�܂�HEC �ɕ��ނ�����܂�p����ꍇ
�i1�jHEC�i�V�X�v���`���ł����50 mg/m2�ȏ�j
HEC�i�V�X�v���`���ł����50 mg/m2�ȏ�j��p����ꍇ�ɂ́CNK1��e�̝h�R��{5-HT3 ��e�̝h�R��i1 ���ځj�{�f�L�T���^�]���i1�`4 ���ځj��3 �ܕ��p����������i��CQ2 �Q�Ɓj�C��2�����5-HT3 ��e�̝h�R�D�܂��B
NK1 ��e�̝h�R�o�ꂷ��ȑO�ɍs��ꂽ�����ł́C��1 ����5-HT3 ��e�̝h�R��ɔ�ׁC�p���m�Z�g�����̓��ɒx�����ɂ����鐧�f���ʂ̗D�z���������ꂽ2�j3�j�B���̌�CTRIPLE ����4�j�ɂ�����NK1 ��e�̝h�R���HEC �ɑ��ĕ��p�����ꍇ�̑�2 ����5-HT3 ��e�̝h�R��i�p���m�Z�g�����j�̑�1 ����5-HT3 ��e�̝h�R��i�O���j�Z�g�����j�ɑ���D�z�����������ꂽ�B
TRIPLE �����́C���p�ʁi50 mg/m2�ȏ�j�̃V�X�v���`�����܂ލR����Â��s���ۂ̃A�v���s�^���g�C�f�L�T���^�]���C5-HT3 ��e�̝h�R���3 �ܕ��p�̐��f�Ö@�ɂ����āC��2 ����5-HT3��e�̝h�R��i�p���m�Z�g�����j�̑�1 ����5-HT3 ��e�̝h�R��i�O���j�Z�g�����j�ɑ���D�z����������ړI�ŁC800 �����銳�҂�g�ݓ��ꂽ�Տ������ł���B�ꎟ�]�����ڂł���5 ���Ԃ̚q�f���S���䊄���i�q�f�Ɛ��f��̒lj������Ȃ��̊����j�ł́C�L�Ӎ��͂Ȃ����̂̃p���m�Z�g�����Q���ǍD�ȌX���ɂ���i�p���m�Z�g�����Q66���C�O���j�Z�g�����Q59���Cp��0.0539�j�C�]�����ڂł���x�����̈��S�E�q�f�ł��p���m�Z�g�����Q���ǍD�ł������i�p���m�Z�g�����Q67���C�O���j�Z�g�����Q59���Cp��0.0142�j�B
�i2�j50 mg/m2�����̃V�X�v���`�����p���W����
50 mg/m2�����̃V�X�v���`����50 mg/m2�ȏ�Ɣ�ׁC�Óf�����Ⴂ���Ƃ��m���Ă���i��CQ8 �Q�Ɓj�B�V�X�v���`�����A�����^�@�i100 mg/m2��4�`5 ���ԁj�ŗp����ꍇ�ɂ́C�V�X�v���`�����^�O�ɑ�1 �����5-HT3��e�̝h�R��ƃf�L�T���^�]����A�����^����B�܂��C�V�X�v���`���̕����Ԍ����^�@�i��50 mg/m2���T1 ��C���j�ɂ�����NK1��e�̝h�R���p����ꍇ�ɂ́C��1 ����5-HT3��e�̝h�R��̎g�p�����������B
2�j�P�܂�MEC �ɕ��ނ�����܂�p����ꍇ
�i1�j ���p�ɂ��Óf�������܂郌�W�����ɑ��āCNK1��e�̝h�R��p����ꍇ
NK1 ��e�̝h�R��p����ꍇ�ɂ́C5-HT3��e�̝h�R����1 ����Ƃ��邩��2 ����Ƃ��邩�ɂ��ẴG�r�f���X���Ȃ����߁C�]���ʂ��Ìo�ϖʂ��l������1�����5-HT3 ��e�̝h�R���������B�������C���҂̈��S�E�q�f���X�N�C�����ǁC��ܔ�Ȃǂ��l������5-HT3 ��e�̝h�R���I�����ׂ��ł���B
�i2�j���p�ɂ��Óf�������܂郌�W�����ɑ��āCNK1��e�̝h�R��p���Ȃ��ꍇ
MEC �ɕ��ނ����R�����ł��邪�x�������S�E�q�f�����ɂȂ�Óf�����X�N�̍������W�������g�p����ۂ�NK1 ��e�̝h�R��p���Ȃ��ꍇ�ɂ́C�p���m�Z�g�������D�܂��B
�����̃����_������r�����Ƃ�������͂������^�A�i���V�X�̌��ʁCMEC �ɂ����đ�1 ����5-HT3��e�̝h�R��ɔ�ב�2 �����5-HT3��e�̝h�R��̐��f��p�ɂ�����D�z����������Ă���5�j�B�������C�X�̗Տ������ɂ����āC�f�L�T���^�]�������p����Ă��Ȃ��C���邢�͕��p���Ă��銄�����Ⴂ�Ȃǂ̖��_���w�E����Ă���C�f�L�T���^�]����p��������MEC �ɑ���p���m�Z�g�����̗D�z���������m����G�r�f���X���Ȃ����Ƃɒ��ӂ��K�v�ł���B
�܂��C���A�a�Ȃǂ̕����ǂɂ���ăf�L�T���^�]���̎g�p�����������ꍇ�C�p���m�Z�g�����ɂ��2�`3 ���ڂ̃f�L�T���^�]�����ȗ��ł���6�j7�j�B
�i3�j���̑���MEC ��p����ꍇ
��L�̂悤�ɁCMEC �ɕ��ނ����R������p�����Óf���̍����Ȃ����W�����ɑ��C�ϋɓI�ɑ�2 �����5-HT3��e�̝h�R��𐄏�����m����G�r�f���X�͂Ȃ��B���������āC�f�L�T���^�]���i1�`3 ���ځj�Ƃ̕��p�ɂ����āC��1 ����5-HT3��e�̝h�R��i1 ���ځj�����������B�������C���A�a�Ȃǂ̕����ǂɂ���ăf�L�T���^�]���̎g�p�����������ꍇ�C2�`3 ���ڂ̃f�L�T���^�]�����ȗ�����ړI�Ńp���m�Z�g������p����I����������6�j7�j�B
+ �Q�l�ɂ�������
- ① MASCC/ESMO Antiemetic Guidelines 2016
- ② Hesketh PJ, Kris MG, Basch E, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ5
���S�E�q�f�̗\�h�ɑ��ĕ��t�玿�X�e���C�h�͊��߂��邩
�����O���[�h
| A | ����Ö@�ɂ�鈫�S�E�q�f��Ƃ��ĕ��t�玿�X�e���C�h�͗L���ł���B�������C�R�����̍Óf�����X�N���ނƁC���p���鐧�f��ɉ������p�@�E�p�ʂł̓��^���s�����Ƃ����������B |
|---|
+ �w�i�E�ړI
���t�玿�X�e���C�h�͍R����^�ɔ������S�E�q�f�ɑ��鐧�f��Ƃ��Ė�25 �N�O ����L�������ؖ�����Ă���1�j�B���������̍�p�@���ɂ��ẮC�R����^���̐��f��Ƃ��ĊJ�����ꂽ5-HT3��e�̝h�R��CNK1��e�̝h�R��قǂɂ͉𖾂���Ă��Ȃ��B�������̕��t�玿�X�e���C�h��̂����C�f�L�T���^�]������у��`���v���h�j�]�����́C�R����^���̐��f���ʂ��ł��悭��������Ă���2�j3�j�B�Ȃ��C�f�L�T���^�]���͍R����^�ɔ������S�E�q�f�̌��\�E���ʂ�L���Ă���B��̕��t�玿�X�e���C�h�ł���B
+ ���
���S�E�q�f��Ƃ��ĕ��t�玿�X�e���C�h�́C�P�܂���ѕ��p�Ö@�Ƃ��ėL���ł���C�R�����̍Óf�����X�N�ɉ����Ďg�p����B�킪���ɂ�����f�L�T���^�]���̏��F�p�ʂ́C���܂ł�1 ��4�`20 mg ��1�`2 ���C1 ���ő�20 mg�C���ˍ܂ł�1 ��3.3�`16.5 mg ��1�`2 ���C1 ���ő�16.5 mg �܂łƂ���Ă���B���Ẵ����_������r�����̌��ʂ���}�����ɂ̓f�L�T���^�]��20 mg ��W�����^�ʂƂ��邪�C����ɍ��p�ʂ̌��ʂɊւ��Ă��̗D�z���͏ؖ�����Ă��Ȃ��B�킪���ɂ����鏭����̑�Ⅱ �������i1�`3 ���ڂ�32 mg/m2��Ò��j�ɂ�����20 mg �ȏ�̍��p�ʃf�L�T���^�]���𐄏����邾���̌��ʂ͓����Ă��Ȃ�4�j�B
1�j���x���X�N�R�������܂ރ��W����
�}�����S�E�q�f�ɑ��āC�\�h�I��5-HT3��e�̝h�R��ƕ��p���ăf�L�T���^�]��13.2�`16.5 mg ��Ò��i16�`20 mg ���o���j���^����B�������CNK1��e�̝h�R��A�v���s�^���g�������̓z�X�A�v���s�^���g���p���ɂ́C����炪CYP3A4 �̑j�Q��p��L���邽�߁CCYP3A4 �ɂ��f�L�T���^�]���̑�ӂ��j�Q����邱�Ƃ��l�����ăf�L�T���^�]�������ʂ���i�Ò�: 9.9 mg�C�o��: 12 mg�j5�j�B
�x�������S�E�q�f�ɑ��āC�\�h�I�Ƀf�L�T���^�]����2�`4 ���ڂɓ��^���邪�C�A�v���s�^���g���p���ɂ͑��ݍ�p���l������8 mg ���o���i6.6 mg ��Ò��j���^����B�Ȃ��C�z�X�A�v���s�^���g�ł̓f�L�T���^�]���Ƃ̑��ݍ�p�̊��Ԃ��Z���i��CQ17 �Q�Ɓj�B��̓I�Ȏg�p�ɍۂ��Ă����f�Ẫ_�C�A�O����① ���Q�Ƃ��ꂽ���i��1 ���ڐ� �������^�C2 ���ڈȍ~�͌o�����^�̗Ꭶ�ł���j�B
2�j�����x���X�N�R�������܂ރ��W����
�}�����S�E�q�f�ɑ��āC�\�h�I��5-HT3��e�̝h�R��ƕ��p���ăf�L�T���^�]��6.6�`9.9 mg ��Ò��i8�`12 mg ���o���j���^����B�A�v���s�^���g�Ƃ̕��p���ɂ̓f�L�T���^�]�������ʂ�3.3�`4.95 mg ��Ò��i4�`6 mg ���o���j�Ƃ���B
�x�������S�E�q�f�ɑ��āC�A�v���s�^���g�p���ɂ�2�`3 ���ڂɃf�L�T���^�]��8 mg ���o���i6.6 mg ��Ò��j���^����B�p���m�Z�g������1 ���ڂ�0.25 mg ��������0.75 mg ���^�������҂ɑ���2�`3 ���ڂ̃f�L�T���^�]�����^�ɂ��ẮC���^�ȗ��ł̔��������Ă���6�j�`8�j�B���������āC���t�玿�X�e���C�h�g�p���l�����ׂ����҂ɂ����ẮC5-HT3��e�̝h�R��Ƀp���m�Z�g������p���邱�ƂŃf�L�T���^�]�����^���ȗ����邱�Ƃ��ł��邪�C���̓_�ɂ��ď\���ɃR���Z���T�X�͓����Ă��Ȃ��B������ɂ���C�K�p���҂̃��X�N���q�Ɋ�Â����肪�K�v�ł���i��CQ3 �Q�Ɓj�B��̓I�Ȏg�p�ɍۂ��Ă����f�Ẫ_�C�A�O����② ���Q�Ƃ��ꂽ���i��1 ���ڐÖ������^�C2 ���ڈȍ~�͌o�����^�C���邢�͑�1 ���ڐÖ������^�݂̂̏ꍇ�̗Ꭶ�ł���j�B
3�j�y�x���X�N�R�������܂ރ��W����
�\�h�I�ɁC�f�L�T���^�]���P�܂��邢��5-HT3��e�̝h�R��ƕ��p����B���̍ۂ̓f�L�T���^�]��3.3�`6.6 mg ��Ò��i4�`8 mg ���o���j���^����B�R�����̗p�ʕ������^�ɑ��ẮC�\�h�I�Ȕ������^���s�����Ƃ��ł���B��̓I�Ȏg�p�ɍۂ��Ă����f�Ẫ_�C�A�O����③ ���Q�Ƃ��ꂽ���i��1 ���ڐÖ������^�݂̗̂Ꭶ�ł���j�B
4�j�ŏ��x���X�N�R�������܂ރ��W����
�\�h�I�ȕ��t�玿�X�e���C�h���^�͕s�v�ł���B
5�j�\�������S�E�q�f
�\�h�I�ȕ��t�玿�X�e���C�h�̗L�p���͖��炩�łȂ��B
6�j���̑�
����Ö@���W�������̂ɕ��t�玿�X�e���C�h���܂ޏꍇ�́C���f��Ƃ��Ẵf�L�T���^�]���͒lj����Ȃ��B
�{�K�C�h���C���̐����ɏ]���C����Ö@���̐��f��Ƃ��ĒZ���Ԏg�p���镛�t�玿�X�e���C�h�̈��S���Ɋւ��Ă͋��e�͈͓��Ƃ���Ă��邪�C���̕���p�ɂ��ď\������������Ŏg�p����iAppendix ���f��̕���p�Q�Ɓj�B
�R�����ɂ��ˏo���̈��S�E�q�f�Ǐ�ɑ��āC���ÓI�lj���Ƃ��Ẵf�L�T���^�]���̖����͏ؖ�����Ă��Ȃ��i��CQ6 �Q�Ɓj�B
���j�f�L�T���^�]���i���˖�j�̓��^�ʕ\���ɂ��Ă��u���f�Ẫ_�C�A�O�������߁v���Q�Ƃ��ꂽ���B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
- ③ Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
- ④ Naeim A, Dy SM, Lorenz KA, et al. Evidence-based recommendations for cancer nausea and vomiting. J Clin Oncol. 2008; 26: 3903-10.
- ⑤ Hesketh PJ. Chemotherapy-induced nausea and vomiting. N Engl J Med. 2008; 358: 2482-94.
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ6
�ˏo�����S�E�q�f���ǂ̂悤�Ɏ��Â��邩
�����O���[�h
| B | ��p�@���̈قȂ鐧�f����C�莞���^����B�܂��C5-HT3��e�̝h�R���\�h�Ɏg�p�����ꍇ�C�\�h�ɗp�������̂ƈقȂ�5-HT3��e�̝h�R��ɕύX����B
�k�����f�Ö@�A���S���Y��③ �Q�Ɓl |
|---|
+ �w�i�E�ړI
���f��̗\�h�I���^���\���s���Ă����S�E�q�f�������E�p������ꍇ��ˏo�����S�E�q�f�ibreakthrough nausea and vomiting�j�ƒ�`����B�ˏo�����S�E�q�f�̎��Â͍���ł��邽�߁C����Ö@�̏���{�s���ɂ����Ă͈��S�E�q�f�\�h���\���ɍs���B�܂����S�E�q�f�������ꍇ�ɂ́C����Ö@�ɂ�鈫�S�E�q�f���C����ȊO�̕a�Ԃɂ����̂����ӕʂ���K�v������i��CQ15 �Q�Ɓj�B
+ ���
��ʌ����͍�p�@���̈قȂ邻�̑��̐��f���lj����^���邱�Ƃł���B�\�h�I���^�Ŏg�p����邱�Ƃ̑���5-HT3��e�̝h�R��ȊO�ň��S�E�q�f�����P������Ƃ��āC�h�p�~����e�̝h�R��i���g�N���v���~�h�C�n���y���h�[���j�C���t�玿�X�e���C�h�C�x���]�W�A�[�s���n�R�s����i�����[�p���C�A���v���]�����j�Ȃǂ�����Ă���B�i�s���҂ɂ����鈫�S�E�q�f�ɑ��鐧�f��̃V�X�e�}�e�B�b�N�E���r���[�ł́C�����_������r�����ɂ����ă��g�N���v���~�h���v���Z�{�����D��Ă���C5-HT3��e�̝h�R��ł���I���_���Z�g�����ƃ��g�N���v���~�h�͓����̌��ʂł������B�������C�t�����͈��S�ɑ�23�`36���C�q�f�ɑ�18�`52���Ƃ�������ᗦ�ł�����1�j�B���x�܂��͒����x���X�N�̖Ö@���{�s�����i96 ���j��Ɉ��S�E�q�f����������39 ����Ώۂɍs�����C�ˏo�����S�E�q�f�ɑ���O�����̃p�C���b�g�����ł́C�v���N�����y���W�����g�p����24 ���̃f�[�^�������������ʁC���^4 ���Ԍ�̈��S�X�R�A�͕���75����������2�j�B�܂��C���x���X�N�̖Ö@���{�s������ɓˏo�����S�E�q�f�������������҂�ΏۂɁC�I�����U�s���i10 mg 1 ��1 ��3 ���ԁj�܂��̓��g�N���v���~�h�i10 mg 1 ��3 ��3 ���ԁj�𓊗^������d�ӌ������_���������ł́C72 ���Ԃ̊ώ@���Ԓ��ɃI�����U�s���Q���L�ӂɈ��S�E�q�f��}������3�j�B�܂��C�I�����U�s����CINV �ɑ���V�X�e�}�e�B�b�N�E���r���[�ł́C�ˏo�����S�E�q�f�ɑ��Ă̗L������������Ă���4�j�BNCCN �K�C�h���C��2017 ��ASCO �K�C�h���C��2017 �ł̓I�����U�s�����\�h���^����Ă��Ȃ���Ύg�p���������邱�ƁC���łɎg�p���Ă�����̑��̍�p�@�����قȂ��܂����p���邱�ƁC�܂��K�v�����^�ł͂Ȃ��莞���^���s�����Ƃ����߂��Ă���B
5-HT3��e�̝h�R��ɂ��ẮC�\�h�ɗp�������̂ƈقȂ�5-HT3��e�̝h�R����g�p���������B���x���X�N�̖Ö@���s���C�I���_���Z�g����8 mg�i�Ò��j�ƃf�L�T���^�]��10 mg�i�Ò��j���g�p������Ɉ��S�E�q�f�������������҂�ΏۂɁC���̂܂��Â𑱂���Q�ƃO���j�Z�g����3 mg�i�Ò��j�ƃf�L�T���^�]��10 mg�i�Ò��j�ɕύX����Q�œ�d�ӌ������_������r�������s�����ł́C���S�E�q�f�̊��S���䊄�����݂�ƃO���j�Z�g�����ɕύX�����Q�ŗL�ӂɍ��������i5�� vs. 47���j5�j�B��2 �����5-HT3 ��e�̝h�R��ł���p���m�Z�g�����́C�}���q�f�̗\�h�����łȂ��x�����q�f�̗\�h�ɂ��L���ł��邱�Ƃ�����Ă���i�x�����q�f���S���䊄��: �O���j�Z�g�����Q44.5�� vs. �p���m�Z�g�����Q56.8���j6�j�B�������ɂ킽��R�����𓊗^���銳�҂�ΏۂɁC�p���m�Z�g����0.25 mg�i�Ò��j�ƃf�L�T���^�]��8 mg�i�Ò��j���p�ň��S�E�q�f�̗\�h���s������ɓˏo�����S�E�q�f�����������Ǘ�ɑ��āC�p���m�Z�g������72 ���Ԍ�ɓ��^�����ꍇ�̐��тƁC�I���_���Z�g����8 mg�i�Ò��j�ƃf�L�T���^�]��8 mg�i�Ò��j���p�̏ꍇ�ł̐��сk�ˏo�����S�E�q�f�����������Ǘ�ɑ��Ă̓��g�N���v���~�h20 mg�i�Ò��j���g�p�l���q�X�g���J���R���g���[���Ƃ��Ĕ�r�����B���̌��ʁC�p���m�Z�g�������^�Q�ł͒lj����^�ŋ~�ςł����ǗႪ67���ł���̂ɑ��C�q�X�g���J���R���g���[���ł�22���ł������ip��0.04�j7�j�B�������C�p���m�Z�g�����Ɋւ��邱�̌����́C�����_������r�����̌��ʂł͂Ȃ����߁C����̃G�r�f���X���݂Ȃ��猟�����ׂ��ł���B
����̂���Ö@�{�s�O�ɂ́C���S�E�q�f�̗\�h�I���^�������܂��͕s�\���ł��������̌����ɂ��ďڍ������s���B���̍ہC���S�E�q�f�̌���������Ö@�ȊO�i��CQ15 �Q�Ɓj�Ȃ̂��ۂ����m�F����B����̍R�������g�p����ۂ́C��荂���Óf�����X�N�ɏ����ė\�h���^���s���B����Ö@�̖ړI���Ǐ�ɘa�ł���ꍇ�́C����̍R�����͌��ʂ��邩�Óf�����X�N�̒Ⴂ�R�����ւ̕ύX���l����B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
- ③ 2017 UpToDate Version 78.0�gPrevention and treatment of chemotherapy-induced nausea and vomiting in adults�h
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ7
�y�x�������͍ŏ��x���X�N�̍R�����Ő������}���̈��S�E�q�f��
�ǂ̂悤�Ɏ��Â��邩
�ǂ̂悤�Ɏ��Â��邩
�����O���[�h
| B | �y�x���X�N�R�����̏ꍇ�ɂ́C�p�����܂ƏǗ�ɂ��C�f�L�T���^�]���̓K�������肷�ׂ��ł���B |
|---|
| C2 | �ŏ��x���X�N�R�����̏ꍇ�́C�f�L�T���^�]���̃��[�`���g�p�͐�������Ȃ��B |
|---|
+ �w�i�E�ړI
�y�x�E�ŏ��x���X�N�̍R�����ɂ��}���̈��S�E�q�f�ɑ��ẮC��ʓI�ɂ͐ϋɓI�ȗ\�h��͐�������Ă��Ȃ��B�������C���S�E�q�f���������銳�҂��F�߂���B�G�r�f���X���x���̍������Â͑��݂��Ȃ����\���ȑΉ������߂���B
+ ���
�y�x���X�N�R�����̋}�����S�E�q�f�ɑ��ẮC�����_������r�����͍s���Ă��Ȃ��B���x�E�����x���X�N�̍R�����ɑ��鐧�f���ʂ��琄���������ʁC�y�x���X�N�R�����ɂ��}���̈��S�E�q�f�̗\�h���ÂƂ��āCASCO �K�C�h���C��2017�CMASCC/ESMO �K�C�h���C��2016 �ł̓f�L�T���^�]��4�`8 mg �P�Ɠ��^����������Ă���1�j2�j�B�܂��C�v���N�����y���W��3�j���邢�̓��g�N���v���~�h���I�v�V�����̈�ł���i�����f��ꗗ�Q�Ɓj�B�ŏ��x���X�N�R�����ɑ��Ă͐��f��̗\�h���^�͐�������Ȃ��B�K�v�ɉ����Čy�x���X�N�R�����ɏ������Ή����l����ׂ��ł��낤�i�����f�Ẫ_�C�A�O����③ �Q�Ɓj�B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② Berger MJ, Ettinger DS, Aston J, et al. NCCN Guidelines Insights: Antiemesis, Version 2.2017. J Natl Compr Canc Netw. 2017; 15: 883-893.
- ③ MASCC/ESMO Antiemetic Guidelines 2016
- ④ Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
- ⑤ ���{�����w��ҁD�Ȋw�I�����Ɋ�Â������f�ÃK�C�h���C�� ① ���Õ�2015 �N�ŁC �����o�ŁC�����C2015�D
- ⑥ Hesketh PJ. Chemotherapy-induced nausea and vomiting. N Engl J Med. 2008; 358: 2482-94.
- ⑦ Naeim A, Dy SM, Lorenz KA, et al. Evidence-based recommendations for cancer nausea and vomiting. J Clin Oncol. 2008; 26: 3903-10.
�Q�l����
| �i �j�G�r�f���X���x�� |
|
1�j Warr D, Oliver T, and members of the Systemic Treatment Disease Site Group. The Role of Neurokinin-1 Receptor Antagonists in the Prevention of Emesis due to High-dose Cisplatin. Cancer Care Ontario. 2005. |
�iⅠ �j |
|
2�j Ioannidis JP, Hesketh PJ, Lau J. Contribution of dexamethasone to control of chemotherapy- induced nausea and vomiting: a meta-analysis of randomized evidence. J Clin Oncol. 2000; 18: 3409-22. |
�iⅠ �j |
|
3�j Ettinger DS, Bierman PJ, Bradbury B, et al. Antiemesis. J Natl Compr Canc Netw. 2007; 5: 12-33. |
�iⅠ �j |
CQ8
�V�X�v���`�������^����ꍇ�̈��S�E�q�f�ɂǂ̂悤�ȑΏ������邩
�����O���[�h
| B | ���x���X�N�ɑ��鐧�f�Ö@�����������B |
|---|
+ �w�i�E�ړI
�V�X�v���`���͑����̂����ɂ����āC3�`4 �T�Ԗ��̊Ԍ����^�@�i��50 mg/m2�j�����p�����B�܂��C��z�W�L�������p�����זE��ᇂł͕����A�����^�@�i100 mg/m2 ��4�`5 ���ԁj���G�r�f���X�Ƃ��Ċm������Ă���B�V�X�v���`���͍Óf��p��������܂ł��邽�߁C�������^�̏ꍇ�ł��Ԍ����^�@�̏ꍇ�Ɠ��l�̐��f�Ö@���K�v�ł���Ɛ��������B
+ ���
�V�X�v���`���͑����̂����ɂ����āC3�`4 �T�Ԗ��ɊԌ����^�i��50 mg/m2�j�����ꍇ���������C�������̂����ɂ����ẮC�V�X�v���`���i��50 mg/m2�j�̕����Ԍ����^�������͕����A�����^�̃G�r�f���X���m������Ă���B�����̑�\�I�Ȃ����Ƃ��āC�_��������z�W�L�������p��C��זE�����1�j2�j�BASCO �K�C�h���C��2017�CMASCC/ESMO �K�C�h���C��2016 , NCCN�K�C�h���C��2017 �ł́C�V�X�v���`���͗p�ʂɊW�Ȃ��C���x���X�N�ɕ��ނ���Ă���B
ASCO�CMASCC/ESMO�CNCCN �K�C�h���C���ł́C���x����шꕔ�̒����x���X�N�R�����𓊗^���銳�҂ɑ��āCNK1��e�̝h�R��ł���A�v���s�^���g����уz�X�A�v���s�^���g�̎g�p����������Ă���B�����_������r�����ɂ����ăA�v���s�^���g����уz�X�A�v���s�^���g���p�̎傽��G�r�f���X������̂́C�V�X�v���`����70 mg/m2�̏ꍇ�ł���3�j�`6�j�C��p�ʃV�X�v���`���̃G�r�f���X�́C��זE���Ώۂ�5 ���ԘA����p�ʃV�X�v���`�����^���̃A�v���s�^���g�̏�悹���ʂ����������K�͂̑�III�������_������r����7�j�C�q�{���Ώۂɉ��w���ː����i�V�X�v���`�� 40mg/m2���T���^�j�Ƀz�X�A�v���s�^���g�̏�悹���ʂ���������III�������_��������8�j�Ƌ͂��ł���B����C�I�����U�s���́C�V�X�v���`����������AC �Ö@�ɑ��C�p���m�Z�g�����ƃf�L�T���^�]����2�ܕ��p���ɁC�A�v���s�^���g�Ƃ̗L�ӂȍ����Ȃ�9�j�C�f�L�T���^�]����5HT3��e�̝h�R��y�уA�v���s�^���g��3 �ܕ��p���ɁC�v���Z�{�ɑ���D�z���������ꂽ10�j�B�������̓V�X�v���`����70 mg/m2��ΏۂƂ��Ă��邽�߁C��p�ʂ̃V�X�v���`���ɑ���I�����U�s���̃G�r�f���X�͖R�����B��p�ʃV�X�v���`�����g�p���邻�̑��̂����i�_�����j�ɑ��ẮC���҂�QOL �ɊӂݓK�ȑΉ����K�v�ł���B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
- ② Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ9
�\�������S�E�q�f���ǂ̂悤�ɗ\�h�����Â��邩
�����O���[�h
| B | �\�������S�E�q�f�ɑ���őP�̑�́C����Ö@�{�s���̋}������ђx�����q�f�̊��S����ł���C���҂Ɉ��S�E�q�f���o�������Ȃ����Ƃł���B |
|---|
| B | �\�������S�E�q�f�ɑ��āC�x���]�W�A�[�s���n�R�s���L���ł���B |
|---|
| B | �\�������S�E�q�f�ɑ��āC�S���w�I���Ö@���L���ł���B
�k�����f�Ö@�A���S���Y��④ �Q�Ɓl |
|---|
+ �w�i�E�ړI
����Ö@����ː��Ö@�����Ƃ��Ɉ��S�E�q�f���o���������҂ł́C����̂���Ö@����ː��Ö@����O����C���S��q�f�������邱�Ƃ�����C������u�\�������S�E�q�f�ianticipatory nausea and vomiting�j�v�Ƃ����B
+ ���
�\�������S�E�q�f�Ƃ́C����Ö@����ː��Ö@���Ĉ��S�E�q�f���ЂƂ��ьo���������҂ɂ����āC�u�����Â��v�̋@������p���Ĕ������錻�ۂ�����1�j�`3�j�B
�Ⴆ�C����Ö@������Ɉ��S��q�f���J��Ԃ��o�����邤���ɁC���ۂ̍R����^���n�܂�O����i����Ö@�̑O���ⓖ�����C�a�@�ɒ����Ă��瓙�j�C����Ö@�̂��Ƃ��l������a�@�ɗ����肵�������ŁC���S���Â�����q�f�����肷��悤�ɂȂ�ꍇ���w���Ă���B
�\�������S�E�q�f�̕p�x�́C����20�����x�܂ł���Ƃ̒������ʂł��������C�ߔN�̐��f�Ö@�̐i���Ō������C�\�������S��13.8���ȉ�6�j7�j�C�\�����q�f��2.3���ȉ�6�j�ƂȂ��Ă���B����Ö@�̃T�C�N���������Ȃ�قǗ\�������S�E�q�f�̃��X�N�͍��܂�B�܂��C����Ö@�I������\�������S�E�q�f�̏Ǐ��������Ƃ�����B�\�������S�E�q�f�ɑ���őP�̑�́C����Ö@����ː��Ö@�̍ۂɁC�ŏ����爫�S�E�q�f�������Ȃ����Ƃł���2�j�`5�j�B���̂��߂ɂ͌v�悵�Ă��鎡�Â̍Óf����K�ɕ]�����ēI�m�Ȑ��f�Ö@���s�����Ƃł���B�v�悵�Ă��鎡�Â̍Óf�����X�N��艺�ʂ̕s�K���Ȑ��f�Ö@���s���Ă͂Ȃ�Ȃ��B
NCCN �K�C�h���C���ł́C�\�������S�q�f�̗U���ƂȂ肤�鋭������������邱�Ƃ𐄏����Ă���B
�\�������S�E�q�f�ɑ��ăx���]�W�A�[�s���n�R�s���L���ł���CNCCN �K�C�h���C��2017�CMASCC/ESMO �K�C�h���C��2016 �ł���������Ă���B�\�������S�E�q�f�̗\�h�Ƀ����[�p����8�j�C�\�������S�̗\�h�ɃA���v���]�������L���ł���9�j���Ƃ��m�F����Ă���B
������
- �����[�p��: 1 ��0.5�`1.5 mg ���o�����^
- �A���v���]����: 1 ��0.4�`0.8 mg ��1 ��2�`3 ��o�����^
����Ö@�Ȃ������ː��Ö@�̎��{�O��C����ѓ������Â�1�`2 ���ԑO�ɓ��^����B�Ȃ��C�K�v�ɉ����đ��ʉi1 ��3 mg �܂Łj�B����҂ł͒�p�ʁi1 ��0.5 mg�j����J�n���邱�ƁB�������CCINV �ɑ�����\�E���ʂ�L���Ă��炸�ی��K�p�O�ł���B
����Ö@�Ȃ������ː��Ö@�̎��{�O�邩�瓊�^����B�ʏ�1 ��0.2�`0.4mg ��1 ��3 ��J�n���C�K�v�ɉ����ď��X�ɑ��ʉB����҂���Ր������Ȃ�тɏd�NJ̏�Q���҂ł́C1 ��0.2 mg �� 1 ��2�`3 �^����J�n���C1 ��1.2 mg ���Ȃ����ƁB�������CCINV �ɑ�����\�E���ʂ�L���Ă��炸�ی��K�p�O�ł���B
�Ȃ��C�x���]�W�A�[�s���n�R�s����i�����[�p���C�A���v���]�����j�̌��ʂ́C����Ö@���p�����邤���ɁC���シ��X��������B
�܂��C�x���]�W�A�[�s���n�R�s����𐔃J���ȏ�ɂ킽���ĘA���g�p�����ꍇ�́C�Q�����������Œ��~���邱�ƁB
�C�O�ł͐S���w�I���Ö@�Ƃ��āC�n���I�E����1�j����N�Z�[�V���������݂��C�L�������m�F����Ă���B�܂��C�����ŃC���[�W�����@��p����Ö��Ö@�̗L����������Ă���10�j�B�������C�킪���ł͂����̐S���I���Î�i�����{�ł���{�݂́C���������Ă���̂�����ł���B
+ �Q�l�ɂ�������
- ① NCCN NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
- ② Hesketh PJ, Kris MG, Basch E, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ10
���ː����Âɂ�鈫�S�E�q�f���ǂ̂悤�Ɏ��Â��邩
�����O���[�h
| A | ���ː����Âɂ�鈫�S�E�q�f�͕��ː��Ǝ˕��ʂɂ�蔭���p�x���قȂ�B���ː��Ǝ˕��ʂɂ�胊�X�N���ނ��Ȃ���C����ɉ��������f�Ö@����������Ă���B |
|---|
+ �w�i�E�ړI
���ː����Âɂ�鈫�S�E�q�f�̂��߂Ɏ��Ìp��������ƂȂ�����CQOL �̒ቺ�������炷���Ƃ�����B�Óf�����X�N�ɉ����ēK�ɑΉ����邱�Ƃ͕��ː����Ð��s��d�v�ł���BASCO �����MASCC �ł͕��ː��̏Ǝ˕��ʂɂ�舫�S�E�q�f�̃��X�N���ށi�\1�j���s���C����ɉ��������f�Ö@����������Ă���B
| ���S�E�q�f�̃��X�N���� �i�p�x�j |
���ː��Ǝ˕��� | ���Õ��@ |
|---|---|---|
| ���x�i��90���j | �S�g�ƎˁiTBI�j�C�S�����p�ߏƎˁiTNI�j | �\�h�I5-HT3��e�̝h�R��{�f�L�T���^�]�� |
| �����x�i60�`90���j | �㕠���C���g�ƎˁiHBI�j�C�㔼�g�ƎˁiUBI�j | �\�h�I5-HT3��e�̝h�R��}�f�L�T���^�]�� |
| �y�x�i30�`59���j | ���W�C���W�Ґ��C���C���������C���� | �\�h�I�܂��͏Ǐ���5-HT3��e�̝h�R�� |
| �ŏ��x�i��30���j | �l���C���[ | �Ǐ���̃h�p�~����e�̝h�R�� �܂���5-HT3��e�̝h�R�� |
+ ���
���ː����Âɂ��d�ĂȈ��S�E�q�f�̂��ߎ��Ìp��������ɂȂ邱�Ƃ�����B���Ëx�~�C���Ò��~�̏ꍇ�ɂ́C�������ɉe�������������ቺ����B���Ìp�����\�ł���ꍇ�ł��C���S�E�q�f���\���ɐ���ł��Ȃ��Ɗ��҂�QOL �͒ቺ����1�j�`4�j�B
���ː����Âɂ�鈫�S�E�q�f�̕p�x�C�d�ēx�́C1 ����ʁC�����ʁC���ʗ��C�����C�Ǝ˖�e�ρC�Ǝ˕��ʁC���ґ̈ʁC���ː����ÑO�E���Ò��̕��p���Â��͂��߂Ƃ�����ː����È��q����ъ��҂̑S�g��Ԃɉe�������5�j�B���ː����Ê���1,020 ���̑O�����ώ@�����ɂ��ƁC���S�E�q�f�̔����p�x��27.9���i���S�̂�16.9���C�q�f�̂�0.8���C���S����њq�f10.2���j�ł�����6�j�B���S�E�q�f�Ɋ֗^������ː����È��q�ł́C�Ǝ˖�̑傫���i��400 cm2�j�ƏƎ˕��ʂ��L�ӂȈ��q�ł������B�Ǝ˕��ʕʂ̈��S�E�q�f�������́C���B22.8���C���Օ�24.1���C����30.5���C����31.0���C�]35.0���C�㕠��50.0���C�畆/�l��14.3���ł������B���̕ł��C���S��������39���i���B31���C����/����63���C�c�u36���C����46���C�O���B/�N��33���C�]45���C���̑�29���j�C�q�f��������7���i����/����15���j�Ƃقړ��l�̌��ʂł�����4�j�B�S�g�Ǝˁitotal body irradiation; TBI�j�̈��S�E�q�f��������80�`100���ƍł�����7�j�B
5-HT3��e�̝h�R��́C�v���Z�{�⑼�̐��f����͕��ː��ɂ��q�f��L�ӂɗ\�h���Ă��邱�Ƃ����^�A�i���V�X�ɂ�莦����Ă���8�j�BTBI �ł�5-HT3��e�̝h�R��̗\�h�I���^�ɂ�鈫�S�E�q�f�̊��S���䊄����50�`90���ƃv���Z�{���L��������������9�j�B�㕠���Ǝ˂ɂ�����5-HT3��e�̝h�R��̗\�h�I���^�ƃ��g�N���v���~�h�C�v���N�����y���W�����邢�̓v���Z�{�̗\�h�I���^�Ƃ̕����̑�III�������_������r�����ł́C�������5-HT3��e�̝h�R��ň��S�E�q�f���������Ⴉ����9�j�B�܂��C15 ��ȏ�̏㕠���Ǝ˗��Ώۂɂ�������̏Ǝ˂ł̃I���_���Z�g�����P�ƂƎ��ÊJ�n����5 �����Ǝ˂܂ł̃f�L�T���^�]���Ƃ̕��p�̔�r�����ł́C�f�L�T���^�]���Ƃ̕��p�ň��S�E�q�f�̌y����������Ă���2�j�B
ASCO �K�C�h���C��2017 �����MASCC/ESMO �K�C�h���C��2016 �ł͕��ː��Ǝ˕��ʂɂ�郊�X�N���ށi�\1�j��������C����ɉ��������f�Ö@�𐄏����Ă���B�����x���X�N�ł�ASCO �ł�5-HT3��e�̝h�R��ɕ����Ǝˏ����i1�`5 �����j�̃f�L�T���^�]�����p�𐄏����Ă��邪�CMASCC �ł̓f�L�T���^�]�����p���Ǘ�ɉ����čs�����Ƃ𐄏����Ă���BNCCN �K�C�h���C��2017 �ł�TBI ����я㕠���Ǝ˂ł͖��ƎˑO�̃O���j�Z�g�������邢�̓I���_���Z�g�����P�܂܂��̓f�L�T���^�]���Ƃ̕��p�𐄏����Ă���B
���w���ː��Ö@�ł́C���ː����Â̂ق������X�N�������ꍇ�ȊO�́C�R�����̃��X�N���ނɉ������������@�őΉ�����B
�킪���ł̓O���j�Z�g������TBI �݂̂ɕ��ː��Ǝ˂ɔ���������Ǐ�i���S�E�q�f�j�̌��\�E���ʂ�L���Ă������C2011 �N11 ���ɕ��ː��ƎˑS�ʂ�ΏۂƂ��Č��\���lj����ꂽ�B����5-HT3��e�̝h�R��͂��܂����ː��Ǝ˂ɑ�����\�E���ʂ�L���Ă��Ȃ��B�܂��h�p�~����e�̝h�R��ŕ��ː��Ǝ˂ɔ���������Ǐ�i���S�E�q�f�j�̌��\�E���ʂ�L���Ă���̂̓��g�N���v���~�h�݂̂ł���B�킪���̓���f�Âł́C���̑��̃h�p�~����e�̝h�R��p��L�����܁i�v���N�����y���W���C�h���y���h���j��f�L�T���^�]�����g�p����邱�Ƃ������B
���ː����Âɂ�鈫�S�E�q�f�́C�R�����ɂ����̂Ɣ�ׂĔ����p�x���Ⴍ�C�d�ēx���Ⴂ���Ƃ��瑽���̕��ː���ᇈ�͎��Ԃ����ߏ��]�����Ă���C����f�Âɂ�����Ή��͏\���Ƃ͂����Ȃ�4�j6�j10�j�B���ː����Ê��҂ւ̐��f�^�̊����͒Ⴍ�C17���ɂ̂ݐ��f���^���ꂽ�i�\�h�I���^12.4���C�����㓊�^4.6���j�Ƃ�����6�j��C���S�������҂ւ̓��^��39���i�R�q�X�^�~����40���C�h�p�~����e�̝h�R��37���C5-HT3��e�̝h�R��17���j�ł������Ƃ���������4�j�B���S�������҂�1/3 �͏Ǐ�ɘa���s�\���ł���K�Ȑ��f�Ö@��]��ł���4�j�B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
- ③ Hesketh PJ, Kris MG, Basch E, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ11
���S�E�q�f�Ɗ֘A������q�ɂ͂ǂ̂悤�Ȃ��̂����邩
�����O���[�h
| C1 | ���Ê֘A���q�Ɗ��Ҋ֘A���q������B���Ê֘A���q�Ƃ��ẮC�R�����̎�ނ���ѓ��^�ʁC���ː��Ǝ˕��ʓ����֗^���C���Ҋ֘A���q�Ƃ��ẮC�N��C���ʁC�����K���C����̕a�ԁC����������������B |
|---|
+ �w�i�E�ړI
����Ö@�ɔ������S�E�q�f�͍R�����̎�ނɑ傫���ˑ����邪�C����ȊO�̈��q���������Ă����K�v������B���������ÑO�ɔc�����邱�Ƃɂ��C�I�m�Ȑ��f�Ö@���{�s������B
+ ���
���S�E�q�f�Ɋ֘A������q�Ƃ��āC���Ê֘A���q�Ɗ��Ҋ֘A���q������B���Ê֘A���q�Ƃ��ẮC����Ö@�ɔ������̂ƕ��ː����Âɔ������̂�2 ��ʂ����B�O�҂ł͍R�����̎�ނ���ѓ��^�ʂ��֗^���C��҂ł͏Ǝ˖삪�ő�̌���v���ł���B
����C���Ҋ֘A���q�Ƃ��ẮC�N��C���ʁC�����K��������1�j�B���Ȃ킿�C����Ö@�{�s���ɁC�����C��N�ł���ꍇ�́C���S�E�q�f�̔����p�x����荂���Ƃ���Ă���B�܂��C�����K���i�L�j�̓V�X�v���`���ɔ������S�E�q�f�̔����p�x�͒Ⴂ�ƕ���Ă���B�����֘A���q�̐����w�I���J�j�Y���ɂ��Ă͕s���ł���B���{�Ŏ��{���ꂽ�C���x�E�����x���X�N�R����^�Ǘ��ΏۂƂ������f��̑�Ⅱ ���C��III�������_������r�����̓�����͂ł́C�}�����q�f�����ۂƊ֘A������q�Ƃ��ẮC���ʁi�����j�C�N��i��N�j�C�����K���i���j�C�i�����i���j���C�x�����q�f�����ۂƊ֘A������q�Ƃ��ẮC���ʁi�����j�����o���ꂽ4�j�B����C���x����ђ����x���X�N�R����^�ɋN������}������ђx�������S�E�q�f�̔�������ѐ��f�Ö@�̎��ۂɂ��āC�������Ŏ��{�������Ԓ����iCINV �ώ@�����j�ł́C�}�������S����њq�f�����ۂƊ֘A������q�Ƃ��ẮC���ʁi�����j�C�N��i��N�j���C�x�������S����њq�f�����ۂƊ֘A������q�Ƃ��ẮC���ʁi�����j�����o���ꂽ3�j�B�I�L�T���v���`�����^�咰�����ΏۂɃA�v���s�^���g/�z�X�A�v���s�^���g�̏�悹���ʂ������������_������III�������iSENRI �����j�̃��X�N���q��͂ɂ��ƁC�A�v���s�^���g�̐��f���ʂ͏����ł�荂������4�j�B���̑��̍Óf���q�Ƃ��āCNCCN �K�C�h���C��2017 �ɂ́C�����ǕǁC�O��@�\��Q�C�]�]�ځC�d���������C�A�ŏǁC�I�s�I�C�h���܂߂����p��C�݃A�g�j�[�C���_�I���������������Ă���B
���Ê֘A���q�̓��X�N���ނ��Ȃ���C���ꂼ��ɑ���������鐧�f��͌��܂��Ă���B����C���x�Óf�����X�N��܂ɂ�鈫�S�E�q�f�ɑ��銳�Ҋ֘A���q��]�����ēK�Ȑ��f�Ö@���s�����߂�, �\���X�R�A�̊J�������݂��Ă���CDranitsaris ��͍R����^��5���Ԃɂ�����Grade 2 �ȏ��CINV �́C7 �̈��q�̏d�ݕt����ݒ肷�邱�Ƃŗ\���\�ƕ��Ă���5�j�B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ12
���S�E�q�f�̓K�ȕ]���͂ǂ̂悤�ɍs����
�����O���[�h
| A | ���҂̏Ǐ�ɂ��Ă͊O�����҂ł͎�f���ƂɁC���@���҂ł͓��@��24 ���Ԉȓ��ɕ]�����邱�Ƃ����������B |
|---|
| C1 | ���Ó��L�Ȃǂ�p���C���҂ƈ�Ï]���҂ŏ������L�ł���̐��̂��Ƃŕ]�����s���B |
|---|
| C1 | CINV �̓K�Ȋɘa�̂��߂ɂ́C���ÑO�̃x�[�X���C���]�����玡�Â̌o�߂�ʂ��Čp�������]�������{����B |
|---|
+ �w�i�E�ړI
���҂̈��S�E�q�f�̕]���C���f��g�p�ɔ����]���Ɋւ��āC���炩�ȃR���Z���T�X��G�r�f���X�͂Ȃ��B�������C�K�Ȑ��f�Ö@�̂��߂ɂ́C���f��g�p�O�̈��S�E�q�f�̃��X�N�A�Z�X�����g�C�g�p��̓K�ȕ]�����s���ł���B�{���ł́C����Ö@���邪�҂ւ̐��f��g�p�Ɋւ���]�����@�𒆐S�Ɍ����C���S�E�q�f��K�ɊǗ����邽�߂̕]�����@�ɂ��Č��������B
+ ���
���҂̈��S�E�q�f�̔������͂��ꂼ��31���C20���ƍ����ɔ������邱�Ƃ�����Ă���1�j�B�Ǐ�ɘa�̂��߂ɂ͊��҂̋�ɂ�]�����邱�Ƃ��d�v�ł���CNCCN �̊ɘa�P�A�K�C�h���C��2017 �ɂ����ẮC�u���ׂĂ̂��҂ɂ��ċ�Ɋɘa��Â̕K�v���Ɋւ���X�N���[�j���O���C���f���C�K���ȊԊu�Œ���I�ɁC����ɗՏ��I�K�v���ɉ����Ď��{����v���Ƃ���������Ă���B
�������C����Ö@����ː��Ö@���̊��҂��o�����鈫�S�E�q�f�ɂ��Ĉ�Î҂͉ߏ��]����ߑ�]�����Ă��邱�Ƃ�������Ă���2�j3�j�C���҂̋�ɂ̊ɘa�C���ʓI�Ȑ��f�Ö@�̂��߂ɂ́C�K�ȕ]�����d�v�ł���B
1�j�Ǐ�̒�`
���S�E�q�f�̏Ǐ�ɂ��Ă��\1 �̒ʂ�ɒ�`����Ă���B�����̒��ł����S�̊ɘa���ł�����Ƃ����Ă���B
| ���S�inausea�j | ���J���J����q�f�̏Փ� |
| �q�f�ivomiting�j | �ݓ��e��������t�����ɔr�o����邱�� |
| ��q�f�iretching�j | �q�f���˂͋N���邪�f�����r�o����Ȃ����� |
2�j���S�E�q�f�̕]�����@
2008 �N��RAND Cancer Quality-Assessing Symptoms Side Effects and Indicators of Supportive Treatment Project �ł́C�u���ׂĂ̂��҂�ΏۂƂ��C�O�����҂͗��@���ƂɁC���@���҂͓��@��24 ���Ԉȓ��ɏǏ��]������v���Ƃ���������Ă���4�j�B
CINV �̓K�Ȋɘa�̂��߂ɂ́C���ÑO�̃x�[�X���C���]�����玡�Â̌o�߂�ʂ��Čp�������]�������{���邱�Ƃ���������Ă���B�]���̎����Ƃ��āCNCCN �K�C�h���C��2015�ł́C���Ȃ��Ƃ����x���X�N�R�����ł�3 ���ԁC�����x���X�N�R�����ł�2 ���Ԃ̒��ӂ�v����ƂȂ��Ă��邪�C�V�X�v���`����p���Ă���ꍇ�́C6 ���Ԃ̒��ӂ�v����Ƃ�����C���{�l�̑��l�ȃ��W�����ɂ����钲���ł�2 ���ڂ��7 ���ڂ̂ق����Ǐ����Ƃ�����3�j�����邱�ƂȂǂ���C���Â��p�����Ă�����Ԃ́C��ɕ]�����s�����Ƃ��d�v�ł���B
�K�Ȉ��S�E�q�f�̕]���ɂ����ẮC��Î҂Ɗ��҂̏Ǐ�̔F���͈قȂ�Ƃ�����2�j3�j�܂��C��Î҂ɂ��q�ϓI�]���ƂƂ��Ɋ��҂̎�ϓI�]�����܂߂邱�Ƃ��K�v�ł���B
���҂̎�ϓI�]���̑O��Ƃ��āC���҂ɑ��ĕ]���̖ړI�C���e����@�ɂ��Ă킩��₷���������C���S�E�q�f�̕]���ւ̋��͂����߂邱�Ƃ��d�v�ł���B�����̓��e�́C���ÑO�Ɏ��{�������X�N�A�Z�X�����g�k�����_3�j�́i1�j�u���S�E�q�f�ɑ��郊�X�N�̔c���v�CCQ11 �Q�Ɓl����яǏ�ʂ̑Ή��i��CQ2�C3�C6�C9 �Q�Ɓj�C�K�Ȑ��f�p�����Ȃ����Ƃɔ������҂̈��S�E�q�f�ɂ���ɂ̑J���C���f��̉ߏ蓊�^�ɂ��֔�Ȃǂ̋�ɑ����ł���B
����Ö@�̌o�߂ɂ�鈫�S�E�q�f�̕]���̃|�C���g���CCQ �̐������e�܂��\2 �ɂ܂Ƃ߂��B
| ���� | �Ǐ�̎�� | �]���̃|�C���g |
|---|---|---|
| ���ÑO | — | ���S�E�q�f�̌����̊ӕʂ��K�v�ł���iCQ11�CCQ15�j�B���X�N�A�Z�X�����g�Ƃ��ẮC���S�E�q�f�̊֘A���q�iCQ11�j�C�R�����̍Óf�����X�N�k���_3�j�́i1�j�l�̕]�������{���邱�Ƃ��K�v�ł���B |
| �R����^�� 24 ���Ԉȓ� |
�}�����S�E�q�f | 24 ���Ԉȓ��ɏ������鈫�S�E�q�f�ł���iCQ2�j�B���X�N�A�Z�X�����g�k���_3�j�́i1�j�CCQ11�l�܂��]�����s���B |
| �R����^�� 24 ���Ԉȍ~ |
�x�������S�E�q�f | 24 ���Ԉȍ~�ɔ������鈫�S�E�q�f�ł���iCQ3�j�B���҂�QOL ��_�I����C���Âɑ���ӗ~�ւ̉e��������iCQ3�j�C�Ǐ�̒��x�ƕ����ĕ]�����s���B |
| ���f��̗\�h�I ���^�� |
�ˏo�����S�E�q�f | ���f��̗\�h�I���^���\���s���Ă����S�E�q�f�������E�p������Ǐ�ł���iCQ6�j�B�]���ɂ́C���S�E�q�f�̌����̍ĕ]�����s���ƂƂ��ɁC�\�h�Ƃ��ėp���鐧�f������҂��\��ʂ�ɗp���Ă��������m�F���C���f���ύX�����ꍇ�͂��̌��ʂɂ��ĕ]�����s���B |
| ���Ìo���̂��� ���҂̎��ÑO |
�\�������S�E�q�f | ����Ö@����ː��Ö@�ɂ�舫�S�E�q�f���o���������҂����̎��Â̑O�Ɉ��S�E�q�f����Ǐ�ł���iCQ9�j�B�����Âɂ����鈫�S�E�q�f���C���_�I�ȗv���ȂǍ����X�N���҂�]�����C�K�ȑΏ����K�v�ł���B |
3�j���S�E�q�f�̕]���ɗp������ړx
��Î҂Ɗ��҂̔F���̈Ⴂ���Ȃ������߁C�Ǐ�̕]���ɂ́C���҂���ё��E��̈�Î҂����]���[�ȂNj��ʂ̂��̂�����p���邱�Ƃ��K�v�ł���B
�i1�j���Âɔ������S�E�q�f�̋q�ϓI�ȕ]��
���Âɔ������S�E�q�f�̋q�ϓI�ȕ]���ɂ́C�L�Q���ۋ��ʗp��K��v4.0 ���{���JCOG �Łi����: CTCAE v4.0-JCOG�j����ʓI�ɗp�����Ă���i�\3�j�B
| CTCAE v4.0 Term ���{�� | Grade 1 | Grade 2 | Grade 3 | Grade 4 | Grade 5 |
|---|---|---|---|---|---|
| ���S | �ېH�K���ɉe���̂Ȃ��H�~�ቺ | �����ȑ̏d�����C�E���܂��͉h�{������Ȃ��o���ێ�ʂ̌��� | �J�����[�␅���̌o���ێ悪�s�\��; �o�ljh�{/TPN/���@��v���� | — | — |
| �q�f | 24 ���Ԃ�1�`2�G�s�\�[�h�̚q�f�i5 ���ȏ�Ԋu���J�������̂����ꂼ��1 �G�s�\�[�h�Ƃ���j | 24 ���Ԃ�3�`5 �G�s�\�[�h�̚q�f�i5 ���ȏ�Ԋu���J�������̂����ꂼ��1 �G�s�\�[�h�Ƃ���j | 24 ���Ԃ�6 �G�s�\�[�h�ȏ�̚q�f�i5 ���ȏ�Ԋu���J�������̂����ꂼ��1 �G�s�\�[�h�Ƃ���j; TPN �܂��͓��@��v���� | ������������; �ً}���u��v���� | ���S |
�o�T: �L�Q���ۋ��ʗp��K��v4.0 ���{���JCOG ��
�O���[�h�iGrade�j�������Ȃ�قǏǏ����Ȃ邪�C�]���́C���ÑO��̐H���ێ�ʂ̕ω��C�̏d�̌����C�E����h�{��ԂȂǂ̐����w�I�Ȏw�W��p���čs����B���̂��߁C���ÑO�̕��i�̐H���K���⎡�ÑO�̉h�{��Ԃ���ƂȂ��ԂƂ��Ĕc�����C���Ì�̏�ԂƔ�r���]�����s���B
�q�f�́u1 �G�s�\�[�h�v�Ƃ́C1 ��q�f�������Ƃ��w���̂ł͂Ȃ��C�q�f����̈�A�̌o�߂̂��Ƃł���C�Z���ԂɘA������2�C3 ��̚q�f���������Ƃ��Ă��C����́u1 �G�s�\�[�h�v�Ƃ��ăJ�E���g�����B
�i2�j���҂̎�ϓI�]��
① �]���ɗp����ړx
���S�́C��ϓI�ȏǏ�ł���C�ȉ��̕��@�ŕ]�����邱�Ƃ��ł���B��������ɂ݂̕]���ɕp�p����邪�C���S�E�q�f�ɂ��p�����Ă���B
Visual Analogue Scale�iVAS�j�́C�Ǐ�̋����ɂ���100 mm �̐���ɋL�ڂ��Ă��炤���̂ŁC�ȕւŒZ���ԂŋL�ډ\�ł��邪�C������d�b�ł̕]���ɂ͗p���邱�Ƃ��ł��Ȃ��i�}1a�j�B���܂��܂Ȍ������ŗp�����C�M�����������B�������C����҂ŔF�m�@�\���ቺ���Ă���ꍇ�ɂ͗���������B�܂��C�S���I���q���Ǐ�Ɋ֘A���Ă���ꍇ�͕s�����ł���ƕ���Ă���5�j�B
Numerical Rating Scale�iNRS�j�́C���܂Ŋ������ň��̏Ǐ��10�C�ǏȂ���Ԃ�0 �Ƃ��Č��݂͉��_�����Ă��炤���̂ł���5�j�i�}1b�j�B
Verbal Rating Scale�iVRS�j�͏Ǐ�̋��������i�K�ڂɂ����邩�ŕ]��������@�ł���i�}1c�j�B���t�������ł��Ȃ������ɂ͓K���Ȃ�5�j�B
�t�F�[�X�X�P�[���́C���t�ŏǏ�̋�����\���������ɐl�Ԃ̕\��Ŏ��������̂ŁC�����ŕp�p����C6 �i�K�ŕ\����Wong-Baker Face Scale ���ł��悭�g�p����Ă���6�j�i�}1d�j�B
② PRO-CTCAE™ ���{���
�L�Q���ۋ��ʗp��K��v4.0 ���{���JCOG �Łi����: CTCAE v4.0-JCOG�j�́C��ϓI�]���Ɋ��p���邽�߂ɁC���҂��L���ł���PRO-CTCAETM ���J������7�j�C���{��ł̑Ó����������ꂽ8�j 9�j�B�{�ړx�́C�S80���ڂ��Ȃ邪�C���̒��ŁC�u�f���C�v�E�u�q�f�v�Ɋւ���]�����ڂ��ݒ肳��Ă���(���_ �\5 �Q��)�B
③ ���Â�QOL ��I�ړx�ɂ����鈫�S�E�q�f�̕]��
���Â��銳�҂�QOL �𑪒肷��ړx�Ɋ܂܂�鈫�S�E�q�f�̕]���͈ȉ��̒ʂ�ł���i�\4�j�B
European Organization for Research and Treatment of Cancer: Quality of Life Questionnaire: Core 30�iEORTC QLQ-C30�Cver. 3.0�j�́C�@�\��5 ���ʂƏǏ�3 ���ʁC��I�Ȍ��N���/QOL ��1 ���ʁC����т��҂Ɉ�ʓI�ɐ����邻�̑��̏Ǐ�i�ċz����C�H�~�s�U�C�s���C�֔�C�����j�ƁC�����̌o�ϖʂւ̉e����]�����鍀�ڂ��܂܂�Ă���9�j10�j�B
Functional Assessment of Cancer Therapy-General�iFACT-G�j�́C���҂� QOL ��g�̖ʁC�Љ��/�Ƒ��ʁC��ʁC�@�\�ʂ�4 �����ɂ��đ��肷����̂ł���11�j12�j�B
���{�ŊJ�����ꂽQOL �ړx�ł���C����Ö@�ɂ�����QOL �����[�iQuality of Life Questionnaire for Cancer Patients Treated with Anticancer Drugs: QOL-ACD�j�́C�������C�g�̏C���_�E�S����ԁC�Љ��4 �̈�𑪒肷����̂ł���13)�B
| �ړx�� ���S�E�q�f�Ɋ֘A���鎿�⍀�� | ������]������p�� | |
|---|---|---|
| EORTC QLQ-C30 �E�f���C������܂������B�E�f���܂������B |
1�D�܂������Ȃ��@2�D��������@3�D���� 4�D�ƂĂ����� |
|
| FACT-G �E�f���C������B |
1�D�܂��������Ă͂܂�Ȃ� 3�D�������Ă͂܂� 5�D���ɂ悭���Ă͂܂� |
2�D�킸���ɂ��Ă͂܂� 4�D���Ȃ肠�Ă͂܂� |
| QOL-ACD �E�f�����Ƃ�����܂������B |
1�D�悭�f�����`5�D�S���f���Ȃ����� ��5�i�K |
|
④ ���S�E�q�f�ɓ��ٓI�Ȏ���[
���݁C���S�E�q�f����ٓI�ɑ��肷�邽�߂ɓ��{��ł����p�ł��鎿��[�́C�\5 �̒ʂ�ł���B
MAT�iMASCC Antiemesis Tool�j�́CMASCC �̈��S�E�q�f�̑���ړx�ł���C�}������ђx�����i24 ���Ԉȓ�����ю��Ì�4 ���ԁj�̈��S�E�q�f�̕p�x�Ƌ��x�𑪒肵�C�i�s���ҁC����Ö@�{�s���҂�Ώۂɗp�����Ă���14�j�`16�j�B
Index of Nausea�CVomiting�Cand Retching�iINVR�j�́C���S�E�q�f�E��q�f�iretching�j���ꂼ��̕p�x�C�������ԁC�d�Ǔx�C��ɂ̒��x�𑪒�ł��C����Ö@���Ă��銳�ҁC�����҂�Ώۂɗp�����Ă���17�j18�j�B���{��ł͈��S�E�q�f�݂̂̍\���ł���B
| ���� | ���� |
|---|---|
| MASCC �̕]���ړx���{��ŁiMASCC Antiemesis Tool; MAT�j | �}������ђx�����i24 ���Ԉȓ�����ю��Ì�4 ���ԁj�̈��S�E�q�f�̕p�x�Ƌ��x�̑���ɗp���邱�Ƃ��ł���B |
| ���S�E�q�f�̎w�W���{��ŁiIndex of Nausea, Vomiting, and Retching; INVR�j | �����ł́C���S�E�q�f�E��q�f�iretching�j���ꂼ��̕p�x�C�������ԁC�d�Ǔx�C��ɂ̒��x�𑪒�ł��邪�C���{��ł͈��S�E�q�f�݂̂̋L�ڂƂȂ��Ă���B |
4�j���f��̕���Ɋւ���]��
���Â�CINV ������ɂ���K�͒����ɂ��ƁC���{�ɂ����鐧�f��K���g�p�K�C�h���C�����痦�́C�}�����S�E�q�f�ł�74���C�x�������S�E�q�f�ł�95���ł���C���Ăɂ����钲���ɔ�r���C�������痦�ł��邱�Ƃ����ꂽ3�j�B
���f��̎g�p�ɂ��ẮC�o���������C���҂̎��ȊǗ����d�v�ƂȂ��Ă��邱�Ƃ�C�x�����̈��S�E�q�f�Ƃ��āC7 ���ڂ̏Ǐ�̋���������Ă��邱��3�j�Ȃǂ���C�w���ʂ�ɕ��Ă��邩��]������K�v������B
5�j���f��̎��Ì���
���f��̎��Ì��ʂ̒�`�ɂ��ẮC���_-�\4 ���Q�l�Ƃ���B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Palliative Care-ver. 1, 2017
- ② NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ③ Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
- ④ ONS�iOncology Nursing Society�j, Chemotherapy and Biotherapy Guidelines and Recommendations for Practice�iFourth Edition�j, 2014
- ⑤ ONS�iOncology Nursing Society�jPutting Evidence into Practice�iPEP�j: Improving Oncology Patient Outcomes, 2014
- ⑥ NCI Common Terminology Criteria for adverse events�iCTCAE�jver. 4
- ⑦ ���{�ɘa��Êw��ҁD�����u�ɂ̖Ö@�Ɋւ���K�C�h���C���@2014�N�ŁD�����o�ŁC�����C2014�D
�Q�l����
| �i �j�G�r�f���X���x�� |
|
1�j Teunissen SC, Wesker W, Kruitwagen C, et al. Symptom prevalence in patients with incurable cancer: a systematic review. J Pain Symptom Manage. 2007; 34: 94-104. |
�iⅠ �j |
|
2�j Vidall C, Ferná ndez-Ortega P, Cortinovis D, et al. Impact and management of chemotherapy/radiotherapy-induced nausea and vomiting and the perceptual gap between oncologists/oncology nurses and patients: a cross-sectional multinational survey. Support Care Cancer. 2015. |
�iⅣ �j |
|
3�j Tamura K, Aiba K, Saeki T, et al. Testing the effectiveness of antiemetic guidelines: results of a prospective registry by the CINV Study Group of Japan. Int J Clin Oncol. 2015; 20: 855-65 |
�iIII�j |
|
4�j Naeim A, Dy SM, Lorenz KA, et al. Evidence-based recommendations for cancer nausea and vomiting. J Clin Oncol. 2008; 26: 3903-10. |
�iⅣ �j |
|
5�j Hawker GA, Mian S, Kendzerska T, et al. Measures of adult pain: Visual Analog Scale for Pain�iVAS Pain�j, Numeric Rating Scale for Pain�iNRS Pain�j, McGill Pain Questionnaire �iMPQ�j, Short-Form McGill Pain Questionnaire�iSF-MPQ�j, Chronic Pain Grade Scale �iCPGS�j, Short Form-36 Bodily Pain Scale�iSF-36 BPS�j, and Measure of Intermittent and Constant Osteoarthritis Pain�iICOAP�j. Arthritis Care Res�iHoboken�j. 2011; 63 Suppl 11: S240-52. |
�iⅠ �j |
|
6�j Collins SL, Moore RA, McQuay HJ. The visual analogue pain intensity scale: what is moderate pain in millimetres? Pain. 1997; 72: 95-7. |
�iⅥ �j |
|
7�j PRO-CTCAE™ ���{���. |
|
|
8�j Miyaji T, Iioka Y, Kuroda Y, et al. Japanese translation and linguistic validation of the US National Cancer Institute�fs Patient-Reported Outcomes version of the Common Terminology Criteria for Adverse Events�iPRO-CTCAE�j, Journal of Patient-Reported Outcomes ,2017; 1: 8 DOI 10.1186/s41687-017-0012-7 |
�iⅥ �j |
|
9�j Aaronson NK, Ahmedzai S, Bergman B, et al. The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst. 1993; 85: 365-76. |
�iⅥ �j |
|
10�j Kobayashi K, Takeda F, Teramukai S, et al. A cross-validation of the European Organization for Research and Treatment of Cancer QLQ-C30�iEORTC QLQ-C30�jfor Japanese with lung cancer. Eur J Cancer. 1998; 34: 810-5. |
�iⅣ �j |
|
11�j Cella DF, Tulsky DS, Gray G, et al. The Functional Assessment of Cancer Therapy scale: development and validation of the general measure. J Clin Oncol. 1993; 11: 570-9. |
�iⅣ �j |
|
12�j Fumimoto H, Kobayashi K, Chang CH, et al. Cross-cultural validation of an international questionnaire, the General Measure of the Functional Assessment of Cancer Therapy scale�iFACT-G�j, for Japanese. Qual Life Res. 2001; 10: 701-9. |
�iⅣ �j |
|
13�j Development of quality of life questionnaire in Japan: quality of life assessment of cancer patients receiving chemotherapy. Psychooncology. 1999; 8: 355-63. |
�iⅣ �j |
|
14�j Multinonal Association of Supportive Care in Cancer: MASCC antiemesis too�il MAT�j |
�iⅣ �j |
|
15�j Molassiotis A, Coventry PA, Stricker CT, et al. Validation and psychometric assessment of a short clinical scale to measure chemotherapy-induced nausea and vomiting: the MASCC antiemesis tool. J Pain Symptom Manage. 2007; 34: 148-59. |
�iⅣ �j |
|
16�j Matsuda Y, Okita K, Furuhata T, et al. Evaluation of the validity of chemotherapy- induced nausea and vomiting assessment in outpatients using the Japanese version of the MASCC antiemesis tool. Support Care Cancer. 2015; 23: 331-9. |
�iⅣ �j |
|
17�j Rhodes VA, McDaniel RW. The Index of Nausea, Vomiting, and Retching: a new format of the Index of Nausea and Vomiting. Oncol Nurs Forum. 1999; 26: 889-94. |
�iⅣ �j |
|
18�j Arakawa S. Relaxation to reduce nausea, vomiting, and anxiety induced by chemotherapy in Japanese patients. Cancer Nurs. 1997; 20: 342-9. |
�iⅤ �j |
CQ13
�ʉ@���Ò��̈��S�E�q�f�̃}�l�[�W�����g���s���ɂ͂ǂ�����悢��
�����O���[�h
| C1 | ��������鎡�Â͂Ȃ����C�ݑ���Ò��̈��S�E�q�f�̃}�l�[�W�����g�͏d�v�ł��邽�߁C�G�r�f���X�Ɋ�Â������Â��s���B |
|---|
+ �w�i�E�ړI
�ߔN�C�R����Â͊O���ɂ����Ď{�s����@������Ă���C�ʉ@���Ì�̍ݑ�ł̊��҂̈��S�E�q�f�̃}�l�[�W�����g�͋ɂ߂ďd�v�ł���B�ݑ�ł̐ϋɓI�Ȉ��S�E�q�f�̃}�l�[�W�����g���s�����Ƃ͊��҂̎��Ð��т�QOL �ɒ�������d�v�ȉۑ�ł���B
+ ���
�����C�R�����ɂ�鎡�Â��O���ɂ����Ď{�s����@������Ă���C���ÏI����ɁC��ÃX�^�b�t�̖ڂ̓͂��Ȃ��ݑ�ɂ����鈫�S�E�q�f���}�l�[�W�����g���邱�Ƃ͊��҂�QOL �ɒ�������d�v�Ȗ��ł���B�ݑ�̊��҂ɂ��Đ��m�ȏǏj�^�����O���s�����Ƃ͍���ł���C�ݑ�̈��S�����҂̐����ɋy�ڂ��e���͑傫��1�j�Ǝv����B�܂����҂́C��Ís�ׂ̒��Œx�����̈��S�̃R���g���[�����ŗD�悷�邱�Ƃ�]�ނƂ���C�O�ł̕�����2�j�B
����ɂ킪���ł́C����Ö@�ɂ��U�����ꂽ���S�E�q�f�Ɋւ��鑽�{������K�̓A���P�[�g�����ł́C�}���������x�����̈��S�E�q�f�̃R���g���[�����C���҂ɂƂ��ďd�v�ȊS���ł��邱�Ƃ�������C���҂̈��S�E�q�f�R���g���[���ɂ����鐧�f�Ö@�̕K�v�������߂Ė��炩�ɂ��ꂽ3�j�B
�{�K�C�h���C���ł͂��ꂼ��̍Óf�����X�N�ɉ����āC�}�����C�x�����̈��S�E�q�f�̃R���g���[���𐄏����Ă���C�x�����ɂ��Ă���{�I�ɂ�CQ3�CCQ6�CCQ7�CCQ9 ���̍����Q�l�ɃG�r�f���X�Ɋ�Â������Â��s�����Ƃ����������B�������C�x�����̐��f�Ö@�Ƀ^�[�Q�b�g���i��L�p���������������_������r�����͐������s���Ă���킯�łȂ��C�܂����f�Ö@�ɂ��Ă������̃I�v�V�������Œ���̃G�r�f���X�Ɋ�Â��Ē��Ă���̂�����ł���B
�������O�q�̂悤�ɐϋɓI�ɒx�����̈��S�E�q�f�̃R���g���[�����s�����Ƃ͂��̕K�v������d�v�ȉۑ�ł���C���S�E�q�f�̃}�l�[�W�����g�́C���f���ōs���̂ł͂Ȃ��C�\���ȏǏj�^�����O�Ɋ�Â����R�����̒��~�E���ʁC�X�^�b�t�ɂ�镨�S���ʂ̊��҃T�|�[�g���d�v�ł��邱�Ƃ͘_��҂��Ȃ��B
�܂��]���C�Տ������ɂ����Đ��f��̗L�p����]�������v�]�����ڂƂ��ċ}�����̈��S�E�q�f�̐��䊄����ݒ肷����̂������������C�ߔN�ł͎�v�]�����ڂƂ��Ēx�����̈��S�E�q�f�̊��S���䊄����䊄����ݒ肷��Տ������������Ă���C����̌����Ɋ��҂������B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② MASCC/ESMO Antiemetic Guidelines 2016
- ② Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2017; 35: 3240-61.
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ14
�������Âɂ����鈫�S�E�q�f�ɂǂ̂悤�ȑΏ������邩
�����O���[�h
| B | �����ɂ����Ă����l�Ɠ��l�i5-HT3��e�̝h�R��уf�L�T���T�]���}NK1 ��e�̝h�R��j�̐��f�Ö@����������C�Տ���\���Ȑ��f���ʂ�������B�������C�g�p��܂̖{�M�ł̏��F���e�i�����K����p�ʁj���m�F����K�v������B |
|---|
+ �w�i�E�ړI
�������̈�����ᇂَ͑������i�����ԗt�n�R���̓����̂ł���C�����̑����͖Ö@�Ɋ����ɂ߂č����C���t��ᇂ݂̂Ȃ炸�C�Ō`����ɂ����Ă����̎��Âɂ����ĖÖ@�����̎�̂ƂȂ鎾���������B�]���āC�K�Ȑ��f��̎g�p�����Ð��s��C�ɂ߂ďd�v�ł���B
�����̖��̍�����ᇌQ�ɕp�p������܂́C�h�L�\���r�V���C�V�X�v���`���C�G�g�|�V�h�C�V�N���z�X�t�@�~�h�C�C�z�X�t�@�~�h�C�A�N�`�m�}�C�V��D�C��ʃ��\�g���L�T�[�g�C��ʃV�^���r�����C���x���璆���x�Óf�����X�N�̖�܂��啔���ł���B���������āC���f��̓K�Ȏg�p�����҂�QOL ��ǍD�Ɉێ����C���ʓI�Ȏ��Ê����ɕK�{�ł���B
+ ���
�������̈�����ᇖÖ@�ɂ����鐧�f��ɂ��ẮC���̋H�����C����ɔ����̎Z���̖�肩��C���̍����G�r�f���X�͋ɂ߂ď��Ȃ�1, 2�j�B�������CASCO ��MASCC/ESMO �̃K�C�h���C���ɂ��C�����ɐ�������鐧�f�@���L�ڂ���Ă���B�����͏������瓾��ꂽ�����̃G�r�f���X�ƁC���l�̈�Ŋm�����Ă��鐧�f�@����̉�㈂ɂ���ďq�ׂ��Ă��邪�C��ʗՏ���C�[���ȐM����������3�j�B�����ł��邱�Ƃ����S�E�q�f�̃��X�N���q�ɂȂ邩�ǂ����ɂ��Ă͔�r�����������̂ŃG�r�f���X�Ƃ�������͖̂������C�o���I�ɐ��l��萧�f�R���g���[���͗e�Ղł���B
�����ł͚q�C�̒��x�̕]�������ɍ���ł���B�Ƃ��Ɏ��Ȃ̏Ǐ�����ꉻ����̂�����ȗc�᎙�ł́C���̕\��C�S�g��ԁC�ېH�s���C����ɂ͗��e�i���ɕ�e�j�̊����Ă���䂪�q�̋�ɁC���𑍍��I�ɔ��f����K�v������B�c�᎙�͈�Î҂Ɍ��C��Ȃ��̂ŁC��ɁE�q�C�̔c���͂ނ���e�Ղł���Ƃ�������B
���S�E�q�f�̊댯���q�́C① �ߋ��̂���Ö@�ł̈��S�E�q�f�̋L���C② �Ԑ������₷�������C③ �s�ǂ�PS�C④ �Љ�o�ϓI�ɕn���ƒ�̏����C⑤ ���e�̈���s���C�Ȃǂ���������B���l�����l�ł��邪�C① �̏����t�����ł��Ώ�����Ȉ��S�E�q�f�C�Ђ��Ă͎��Ë��ۂɂȂ���₷���C����̈��S�E�q�f��͔Z���ɍs�����Ƃ��d�v�ł���B
�{�e�ł͊�{�I�ɋ}���̈��S�E�q�f��ɂ��ďq�ׂĂ���B��������̖Ö@���W�����̑����́C�����Ԍp���I�ɑ��ܕ��p���^�����u���b�N�����G�ɑg�ݍ��킳�����̂������C�}�����q�f�ƒx�����q�f�����݂��C���̋�ʂ͐��l�̈�̊O���ʉ@���Â�蕡�G�ł���C�}���C�x�����̋�ʂ͗Տ��I�ɂقڈӖ����Ȃ��B�{�K�C�h���C���ł����l�̈�ł͢�x�������S�E�q�f����d�_�I�Șb��ł��邪�C�����ł͏�q�̂悤�Ȏ��������C�x�����q�f�ɑ��鐧�f���͕s�\���ł���3�j�B�܂��C�����������������x�����q�f�ɑ�����ʂ����҂������5-HT3��e�̝h�R��ł���p���m�Z�g�����́CMASCC/ESMO �̃K�C�h���C���ł͏����ɂ���������CFDA ��2014 �N�ɂ͊��ɏ����K����F�߂Ă���B�������C�{�M�ł͏����K�����Ȃ��B���̂悤�ɐ����ɂ́CASCO ��MASCC/ESMO �̃K�C�h���C���ɏ]���đΉ�����悤�ɋL�ڂ���Ă��Ă��C�{�M�ł̖����K���ɏ]���ƕK�����������̃K�C�h���C���ɂ͏����ł��Ȃ����Ƃ����ӂ��ׂ��ł���B
�O�ł̖{�K�C�h���C�����s���ɂ́C�{�M�ł�NK1�� �e�̝h�R��A�v���s�^���g�̏����K����12 �Έȏ�̏����Ɍ����Ă������C�Ò���z�X�A�v���s�^���g�́C2016�N�ɂ悤�₭�C����6 �����ȏ�̏����ɓK���g�傳�ꂽ�B
�܂��C�ߔN�C���^���_�a��ł���I�����U�s���̐��f��p�����ڂ���Ă���4�j���{�M�ł͐��l�̈��2017 �N 12 �� �Ɍ��\�E���ʂ̒lj����F��������ł���C�����ւ̎g�p�͏��F����Ă��Ȃ��B�܂��C�����ɑ���I�����U�s���̗L�����E���S���ɑ��錟�͋ɂ߂Č����Ă���3�j�C�L�����͎�����Ă�����̂́C���̈�ʓI�g�p�͍���̉ۑ�ł���B
�{�M�ł�5-HT3 ��e�̝h�R��g�p�́C���̏��F��������葁�������_�C����ѕ��ː����Â̚q�C�ւ̓K�������邱�Ƃɗv��������Ǝv���邪�C�I���_���Z�g�����ɔ�r���C�O���j�Z�g�������L���p�����Ă���B�ʏ�̗p�ʂł͖��ɂȂ�Ȃ��ƍl�����邪�C���p�ʂ̃I���_���Z�g������QT �����𗈂����Ƃ��m���Ă���_�����ӂ��Ă����ׂ��_�ł���i��CQ17�j�B
���Տ��ɂ����Ă̊�{�I���f���W�����́C5-HT3 ��e�̝h�R��уf�L�T���T�]���}NK1 ��e�̝h�R��ł��邱�Ƃɕς��͂Ȃ��B��̓I�ɂ͑����̏ꍇ�C5-HT3 �h�R��i�O���j�Z�g�����Ȃ����I���_���Z�g�����j�ƃf�L�T���T�]���ɁC�Óf���̍������W������q�f���₷�������ɂ̓A�v���s�^���g�i�z�X�A�v���s�^���g�j��������C�Ƃ������^�@����ʓI�ł���C�قڏ[���Ȑ��f���ʂ�������B�p�ʂ͊����̑̏d�C�̕\�ʐς���і{�M�̏��F�p�ʂɏ]���B���Ã��W�����ɕ��t�玿�R���`�R�C�h���܂܂�Ă���ꍇ����������̂ŁC���̗p�ʂ����Ă��āC���f��Ƃ��Ẵf�L�T���T�]���p�ʂȂ������^�̓K�ۂ����肷��B�����CINV�ɑ���I�����U�s�����^�͌��ʂ����҂���邪�����_�i2017 �N12 ���j�ł́C�����ł���ɂ͂Ȃ��B
+ �Q�l�ɂ�������
- ① Dupuis LL, Sung L, Molassiotis A, et al. 2016 updated MASCC/ESMO consensus recommendations: Prevention of acute chemotherapy-induced nausea and vomiting in children. Support Care Cancer. 2017
- ② Hesketh PJ, Kris MG, Basch E, et al. Antiemetics: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol. 2017; 35: 3240-61.
- ③ atel P, Robinson PD, Thackray J, et al. Guideline for prevention of acute chemotherapy-induced nausea and vomiting in pediatric cancer patients: A focused update. Periatr Blood Cancer. 2017
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ15
�H�~�s�U�C���Ă��C�����s�ǁC���S�͋�ʂł��邩�C
�܂����S�E�q�f�����������̕a�Ԃɂ͂ǂ̂悤�Ȃ��̂����邩
�܂����S�E�q�f�����������̕a�Ԃɂ͂ǂ̂悤�Ȃ��̂����邩
�����O���[�h
| B | �H�~�s�U�C���Ă��C�����s�ǁC���S���ӕʂł���G�r�f���X�͂Ȃ��B�����̏Ǐ����������ꍇ�̓v���g���|���v�j�Q��܂���H2��e�̝h�R��̓��^����������B |
|---|
| C1 | ���f����g�p����ۂ́C�{������ɋL�ڂ���a�Ԃ����ɂ߂������œK����܂���������B |
|---|
+ �w�i�E�ړI
���f����g�p����ۂɂ͂��̓K�������ɂ߂ē��^����B�{���ł͂���Ö@�ȊO�̌����ɂ�舫�S�E�q�f���������a�Ԃɂ��Ă܂Ƃ߂��B
+ ���
1�j�H�~�s�U�C���Ă��C�����s�ǁC���S�ɂ���
�H�~�s�U�́C����Ö@��̈��S�ɂ����̂����łȂ��C���o�S���̏�Q�□�o�ω��������ɂȂ�B�܂��������̐i�s�ɂ���Ă��N����B���Ă��͈ݎ_�̋t���ɂ���ċN���邱�Ƃ������C�t�����H�����ł݂���B�����s�ǂ́C��Ɉ݉��Ȃǂ̏����펾��������ǂ̋@�\��Q�ɂ݂���Ǐ�ł���C�H���E�H��ɋN���鋹�Ă��C�㕠���̖c�����E�s��������������B�����̏Ǐ�́C���S������C�����̏Ǐ����ɋN���邱�Ƃ�����̂Ŋӕʂ�����ł���B�v���g���|���v�j�Q��܂���H2��e�̝h�R��̓��^����������1�j�B
2�j����Ö@�ȊO�̌����ň��S�E�q�f���������a��
���҂ł͂���Ö@�ȊO�ɂ��C�ȉ��Ɏ����悤�ȕa�Ԃň��S�E�q�f����B
- ���ǂ̕�������⊮�S��
- �O��@�\��Q
- �]�����i�Ǐ�
- �d�����ُ�i���J���V�E�����ǁC��i�g���E�����ǁC�������j
- �A�ŏ�
- �I�s�I�C�h���܂ޕ��p���
- ���lj^����Ⴡi���a��ᇁC�r���N���X�`���Ȃǂ̍R�����C���A�a�������_�o��Q�Ȃǁj
- �ߏ蕪��i�����ł̗����Ȃǁj
- ��������
- �S�����v���i�s���C�\�������S�E�q�f�j
���ɓ���̈��S�E�q�f�������ꍇ�ɂ͏�L�̕a�Ԃ��l���C�ڍׂȖ�f�Ɛf�@���s���������ō̌���摜�������{�s���ӕʂ��邱�Ƃ��K�v�ł���B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② 2017 UpToDate Version 78.0�gPrevention and treatment of chemotherapy-induced nausea and vomiting in adults�h
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ16
�܌`�̈Ⴄ��܂��ǂ̂悤�Ɏg�������邩
�����O���[�h
| B | ���f��͍܌`�ɂ����ʂ̍��ق͂Ȃ����߁C��������g�p���Ă��\��Ȃ��B�q�f�̂��ߌo�����^������ȏꍇ�͒��˖���l������B |
|---|
+ �w�i�E�ړI
���f����g�p����ۂ͊��҂̕a�ԁE�a��ɂ��܌`���l���ē��^����B�{���ł͍܌`��I������ۂ̗��ӓ_�Ɨ��p�\�ȍ܌`�ɂ��Ă܂Ƃ߂��B
+ ���
���f��̍܌`�ɂ͏��܁C�J�v�Z���܁C�ח��܁C���ˍ܂⍿�܂�����B�����ێ换��Ȋ��҂ւ̌o�����^�ɂ͌��o����������I�������B5-HT3��e�̝h�R��̌o����̓����_������r�����ɂĒ��˖�Ɣ�ׂď��F�p�ʂŌ��ʂɍ��͂Ȃ�1�j�B�����̏ꍇ�͓���������ȏꍇ���������˖���g�p����i��CQ14 �Q�Ɓj�BNK1��e�̝h�R��A�v���s�^���g�͐��ɕs�n�̂��߁C�����_���v���h���b�O�ł���z�X�A�v���s�^���g�Ƃ��Ē��ː��܉�����Ă���B�z�X�A�v���s�^���g150 mg �̂���Ö@1 ���ڂ̒P��Ö������^�́C�A�v���s�^���g��3 ���Ԍo�����^�i1 ����125 mg�C2�`3 ����80 mg�j�Ɠ����̌��ʂ�L���Ă���2�j�B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② 2017 UpToDate Version 78.0�gPrevention and treatment of chemotherapy-induced nausea and vomiting in adults�h
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ17
�ԑ��ݍ�p���l���Ďg�p���Ȃ���Ȃ�Ȃ����f��͉���
�����O���[�h
| B | �A�v���s�^���g�C�z�X�A�v���s�^���g�́C��Ӊߒ��ɂ�����ԑ��ݍ�p������Ă���B |
|---|
+ �w�i�E�ړI
���f����g�p����ۂ́C�R�����т��̑��̕��p��Ƃ̑��ݍ�p���l������B�{���ł̓A�v���s�^���g�C�z�X�A�v���s�^���g�̑��ݍ�p�ɂ��ĉ������B
+ ���
�A�v���s�^���g�̓`�g�N���[��P450�iCytochrome P450; CYP�j3A4 �̊�ł���C�y�x���璆���x��CYP3A4 �j�Q����їU����p��L���CCYP2C9 �̗U����p���L����B���̂���CYP3A4 �����CYP2C9 �ɂ���ӂ�����܂́C�A�v���s�^���g����уz�X�A�v���s�^���g�Ƃ̕��p���ɁC��ӑj�Q�ɂ�錌���Z�x�㏸�������͑�ӗU���ɂ�錌���Z�x�ቺ���C��p�������܂��͌��シ��\�������邽�ߒ��ӂ�v����BCYP3A4 �ɂ���đ�ӂ�����܂͔��ɑ����C�s���W�h�͌����Z�x�̏㏸�ɂ��QT ������S�����s�����Ȃǂ̏d�Ăȕ���p���������邨���ꂪ���邽�߁C�A�v���s�^���g����уz�X�A�v���s�^���g�Ƃ̕��p�͋֊��Ƃ���Ă���B
CYP3A4 �ɂ���ӂ����h�Z�^�L�Z���i60�`100 mg/m2�j1�j�C�r�m�����r���i25 mg/m2�j2�j����уJ�o�W�^�L�Z���i15 mg/m2�j3�j�̖��Ԃ́C�A�v���s�^���g���p�ɂ���ėՏ��I�ȉe�����Ȃ����Ƃ�����Ă���B�V�N���z�X�t�@�~�h�̓v���h���b�O�ł���C�����̂ł���4-�q�h���L�V�̂ւ͎��CYP2B6 �ɂ��ϊ�����C�܂��V�N���z�X�t�@�~�h��4-�q�h���L�V�̂�CYP3A4 �ɂ���đ�ӂ����B�V�N���z�X�t�@�~�h�ƃA�v���s�^���g�̑��ݍ�p�Ɋւ�����Ԏ����ɂ����āC�������זE�ڐA�O���u�i60 mg/kg�j�ł̌����ł̓V�N���z�X�t�@�~�h�����4-�q�h���L�V�̂Ƃ��ɃA�v���s�^���g���p�ɂ��AUC �̗L�ӂȕϓ��͔F�߂��Ȃ������Ƃ�����4�j��C AC �Ö@�i600 mg/m2�j�ł̌����ł̓A�v���s�^���g���p���̃V�N���z�X�t�@�~�h��AUC �͑����������C4-�q�h���L�V�̂�AUC �͗L�ӂȕϓ����F�߂��Ȃ������Ƃ̕�����5�j�B�܂��C�����҂ł̃V�N���z�X�t�@�~�h�i500�`1,500 mg/m2�j���܂ރ��W�����ɑ���A�v���s�^���g�̗L�p������������K�͗Տ������in=857�j�ɂ����ẮC�A�v���s�^���g�Q�ƃv���Z�{�Q�̔��M���D���������ǂ̔��������������2.1 % �ł��������Ƃ���6�j�C���Q�ɂ�����R�����̔��I�ʂɂ͍����Ȃ��������Ƃ����@����Ă���BCYP3A4 �܂���CYP2C9�ő�ӂ���鑼�̍R�����i�C���m�e�J���C�r���N���X�`�����j�ɂ��ẮC�A�v���s�^���g��z�X�A�v���s�^���g�Ƃ̑��ݍ�p�̗L���Ȃ�тɒ��x�͂̕Ȃ����߁C�����ƃA�v���s�^���g�������̓z�X�A�v���s�^���g�p����ۂɂ͗L��������S���̕ω��ɒ��ӂ���B
�f�L�T���^�]����v���h�j�]�����Ȃǂ̕��t�玿�X�e���C�h��CYP3A4 �ɂ���đ�ӂ����B�A�v���s�^���g���p���ɂ̓f�L�T���^�]����AUC ����������7�j���߁C�A�v���s�^���g�������̓z�X�A�v���s�^���g���܂ސ��f�Ö@�ɂ�����f�L�T���^�]���͑��ݍ�p���l���������ʂɂē��^�����i��CQ5 �Q�Ɓj�B�Ȃ��C�z�X�A�v���s�^���g�̓��^��1 ���ڂ݂̂ł��邱�Ƃ���C�f�L�T���^�]���Ƃ̑��ݍ�p�iAUC �����j��2 ���ڂ܂ł����F�߂��Ȃ�8�j�B����C�R�����Ƃ��ē��^����镛�t�玿�X�e���C�h�͌��ʂ����ׂ��ł͂Ȃ��B�Ȃ��CR-CHOP �Ö@�ɂ�����v���h�j�]������AUC �̓A�v���s�^���g���p�ɂ��e�����Ȃ����Ƃ�����Ă���9�j�B
�R�����ȊO�ł́CCYP3A4 �ő�ӂ����~�_�]�����i2 mg�j��AUC ���A�v���s�^���g����уz�X�A�v���s�^���g���p�ɂ�葝�����邱�Ƃ�����Ă���8�j10�j�B�����t�@�����̓A�v���s�^���g��CYP2C9 �U����p�ɂ��CS-�����t�@�����̌����Z�x���ቺ���čR�Ìō�p�����シ��11�j���߁C�����t�@�������^���҂ɃA�v���s�^���g��z�X�A�v���s�^���g�𓊗^����ۂ̓v���g�����r�����ԁiPT-INR�j�̃��j�^�����O�𖧂ɍs���B������CYP2C9 �ő�ӂ����g���u�^�~�h�i500 mg�j���A�v���s�^���g���p�ɂ��AUC ���ቺ����10�j�B
����C�A�v���s�^���g��z�X�A�v���s�^���g�� AUC �ɉe����^�����܂�����BCYP3A4 �̑j�Q��ł���C�g���R�i�]�[���Ȃǂ̃A�]�[���n�R�^�ۖ��N�����X���}�C�V���Ȃǂ̃}�N�����C�h�n�R�ۖ�̓A�v���s�^���g�� AUC ��������B�܂�CYP3A4 �̗U����ł���J���o�}�[�s���C���t�@���s�V���C�t�F�j�g�C���̓A�v���s�^���g��AUC ��ቺ������B���������āC�����Ƃ̕��p���ɂ̓A�v���s�^���g��z�X�A�v���s�^���g�̌��ʂ������������͌��シ��\��������B
+ �Q�l�ɂ�������
- ① NCCN Clinical Practice Guidelines in Oncology-Antiemesis-ver. 2, 2017
- ② Kris MG, Hesketh PJ, Somerfield MR, et al. American Society of Clinical Oncology Guideline for antiemetics in Oncology: Update 2006. J Clin Oncol. 2006; 18: 2932-47.
- ② 2017 UpToDate Version 78.0�gPrevention and treatment of chemotherapy-induced nausea and vomiting in adults�h
�Q�l����
| �i �j�G�r�f���X���x�� |
CQ18
���Ê��ɂ����ăI�s�I�C�h���ɖ�ɂ�鈫�S�E�q�f���ǂ̂悤�Ɏ��Â��邩
�����O���[�h
| C1 | �ϋɓI�Ȃ��Â̎����ɃI�s�I�C�h���ɖ���J�n����ꍇ�C7 ���Ԓ��x�h�p�~��D2 ��e�̝h�R���p���Ĉ��S�E�q�f�ɑ���\�h���s���B |
|---|
+ �w�i�E�ړI
�����u�ɂ��̑��ɑ��ėp����I�s�I�C�h�ɂ��C�֔�C���S�E�q�f�C���C�Ƃ���������p�������B�I�s�I�C�h���ɖ�J�n����ʎ��ɖ��ƂȂ邪�C���Ɉ��S�E�q�f�́C���҂̕���A�h�q�A�����X�ɏd��ȉe����^���邽�ߗ\�h�I�ɐ��f���p����ȂǓK�ȑ�����K�v������B
+ ���
����̎��Âɂ����āC�x���Ö@�Ƃ��ẴI�s�I�C�h�͏p��C�Ö@�C���ː����ÂƂ��������Ê�����C�ϋɓI�ȍR���Â��s��Ȃ��ɘa��Â����S�ƂȂ鎞���ɂ����Ď�Ƃ��Ē��ɖړI�ɍL���p������B
�I�s�I�C�h�͎�Ƃ��ăʎ�e�̂ɍ�p�����Ɍ��ʂ��o������C�h�p�~����q�X�^�~���V���������N�����Óf��p���������B�I�s�I�C�h�ɂ�鈫�S�E�q�f�͓��^�����C���ʎ��ɐ����邱�Ƃ������C�ʏ퐔���ԂŌy������B�I�s�I�C�h�ȊO�ɂ����܂��܂Ȍ����ň��S�E�q�f�������邽�߁C�I�s�I�C�h�ȊO�ɍl������v���i��CQ15 �Q�Ɓj���ӕʂ��C���O����K�v������B
��ނɂ���Ă��قȂ邪�C�I�s�I�C�h�ɂ��20���O��Ɉ��S���C10���O��ɚq�f��������i�\1�j�B�I�s�I�C�h�ɂ�鈫�S�E�q�f�ɑ��C���{�����Ȋw��C���{�ɘa��Êw���K�C�h���C�����o����Ă���B
| �����q�l���� �o�����^ |
�t�F���^�j�� �\�t�� |
�I�L�V�R�h�� ���܌o�����^ |
�R�f�C������ �o�����^ |
|
|---|---|---|---|---|
| ���S | 22�� | 14�� | 23�� | 21�� |
| �q�f | 13�� | 7�� | 14�� | 23�� |
���{�����Ȋw��́w������і����֘A��g�p�K�C�h���C���x�i2015 �N�j�ł́C�����q�l�C�I�L�V�R�h���C�R�f�C���ɂ��āC���S���o��O�ɐ��f���\�h�I�ɗp���邱�Ƃ𐄏����Ă���B���{�ɘa��Êw��́w�����u�ɂ̖Ö@�Ɋւ���K�C�h���C���x�i2014 �N�j�ł́C�\�h�I���^��ϋɓI�ɂ͐������Ȃ����̂́C�u���҂̏�Ԃɂ���ẮC�I�s�I�C�h�̊J�n�Ɠ����ɐ��f������I�ɊJ�n���Ă��悢�v�Ƃ��Ă���B�\�h�I�ɐ��f����J�n���Ă悢�Ǘ�Ƃ��āC����Ö@���Ă���ꍇ�ȂǁC���S�E�q�f���N�����₷�����҂������Ă���B
���u�ɂ������͂����u�ɂɑ��I�s�I�C�h��p����ۂɁC���̈��S�E�q�f�ɑ���Ώ����܂��܂Ɍ�������Ă����B
�I�s�I�C�h�̎g�p�͏p��̈��S�E�q�f�ipostoperative nausea and vomiting; PONV�j�̎�v���ł���BPONV �ɑ��āC�h���y���h�[�����邢�̓f�L�T���^�]���C5-HT3��e�̝h�R��ł���I���_���Z�g������ΏƂƂ��Ĕ�r�������s���邱�Ƃ������B���Տ��ł͍Óf���X�N�ɉ������Ή������߂��Ă���B�\�h�I�ɗp���鐧�f��ɂ́C�h���y���h�[���C�n���y���h�[���C�y���t�F�i�W���C�W�t�F���q�h���~���C�X�R�|���~���C�f�L�T���^�]���C5-HT3��e�̝h�R��CNK1��e�̝h�R����C���X�N�ɉ����ĒP�܁C���邢�͕��p���ėp������2�j�B
����C�����u�ɂɑ��ăI�s�I�C�h���g�p�����ۂ̗\�h�I���f���ʂ��������G�r�f���X�͌����Ă���B��r�I���̍����Տ������Ƃ��Ă͈ȉ��̂��̂�����B���B�ōs��ꂽ�����_������r����3�j�́C�I�s�I�C�h���J�n/�ύX/���ʂ���ۂɃI���_���Z�g�������邢�̓��g�N���v���~�h��p���邱�ƂŃv���Z�{�ɔ���S�E�q�f�̐��䊄�������܂邩�ǂ��������������{���������ł���B��͉\�ȏǗᐔ��180 ���K�v�ȂƂ���C�o�^��92 ���݂̂ł������B���ʁC3 �Q�ɗL�ӂȍ��͔F�߂��Ȃ������B
�܂��I�L�V�R�h���̊J�n���Ƀv���N�����y���W���̗\�h���^�̗L�������������Տ�����������4�j�B�킪���ōs��ꂽ�����_������r�����ŁC4 ����1 �݂̂����Â��Ă����B��v�]�����ڂł���5���Ԃ̊��S�q�f���䊄���ŗ��Q�ɍ����Ȃ��C�\�h���^�̗L�����͎�����Ȃ������B�������C�P�{��120 ���K�͂́C���K�͂ȗՏ������ł��邱�Ƃɒ��ӂ��K�v�ł���B���o�͕s���ł��邱���̗Տ���������m��I�Ȍ��_���o�����Ƃ͍���ł���B
�I�s�I�C�h�ɔ������S�E�q�f�̕p�x�́C�R�����ɓ��Ă͂߂�Όy�x���X�N�ɑ�������B�����G�r�f���X�͂Ȃ����̂́C���Ê��̊��҂ɑ��ăI�s�I�C�h��p����ہC�R���Z���T�X�Ƃ��ė\�h�I���f�Ö@�𐄏�����B�ɘa�P�A�Ǘ��ΏۂƂ����O���r�����̌��ʂƁC�V�X�e�}�e�B�b�N�E���r���[����C�h�p�~����e�̝h�R��p��L����v���N�����y���W���C�n���y���h�[���������̓��g�N���v���~�h��\�h�I���f��Ƃ��ėp����B�I�s�I�C�h�ɔ������S�E�q�f�͐����őϐ����ł��邱�ƁC��L��܂Ŗ��C�C�ӂ����������\�������邱�ƁC�������^�Ő��̊X�H�Ǐ����\�������邱�Ƃ��C7 �����x�ł����̐��f��𒆎~���邱�Ƃ��]�܂����B
�\�h�I���f�Ö@���ɐ��������S�E�q�f�ɑ��ẮC�I�s�I�C�h�ȊO�ɍl������v����CQ15 ���Q�Ƃ����O���C�I�s�I�C�h�̌��ʁC���^���[�g�̕ύX�C�ʌn���̃I�s�I�C�h�ւ̕ύX���l������B���̂����œK��������C�I���_���Z�g������p����B���u�ɂɑ���I�s�I�C�h�̈��S�E�q�f�ɑ��C�v���Z�{��ΏۂƂ����I���_���Z�g������PONV �ɑ�����ʂ����^�A�i���V�X�ł��F�߂��Ă��邱��5�j�C�p��ɃI�s�I�C�h��p����ہC�I���_���Z�g���������g�N���v���~�h�ɔ�א��f���ʂŏ����Ă�������6�j�����̍����ƂȂ�B�i�s���������̂��҂ŁC�I�s�I�C�h�ɔ������̂��܂܂�������S�E�q�f�ɑ��āC�I�����U�s���C���X�y���h���C�N�����v���}�W���C�N�����t�F�j���~��������B�������C�����̗L��������������G�r�f���X�͏�����̑�Ⅱ �������ɂƂǂ܂��Ă���B
�I�s�I�C�h�ɂ�萶�������S�E�q�f�́C�I�s�I�C�h�����S�����Ȃ����n���֕ύX�i�I�s�I�C�h�X�C�b�`���O�j������C���^���[�g��ύX�����肷�邱�Ƃʼn��P����\��������B�������C�I�s�I�C�h�X�C�b�`���O�Ɋւ��郉���_������r�����͂Ȃ��B���^�A�i���V�X�ł͂Ȃ��V�X�e�}�e�B�b�N�E���r���[�ƁC����̈��S�E�q�f�Ɋւ��鏭����̑O���r�����ɂ��ƁC�����q�l����I�L�V�R�h���C�t�F���^�j���ɁC�܂��I�L�V�R�h������t�F���^�j���ɕύX���C���S�E�q�f�̉��P��F�߂Ă���7�j8�j�B
���^���[�g�ύX�ɂ��Ă����̍��������_������r�����͂Ȃ��B���K�͂̑O���r�����ł́C�����q�l�̌o������o�Ö��E�o�牺���[�g�ցC�o��t�F���^�j���������q�l�Ȃ����t�F���^�j���̌o�Ö��E�o�牺���[�g�ւ̕ύX�ň��S�E�q�f�̌y����F�߂Ă���9�j10�j�B
+ �Q�l�ɂ�������
- ① ���{�ɘa��Êw��ҁD�����u�ɂ̖Ö@�Ɋւ���K�C�h���C���@2014 �N�ŁD�����o�ŁC�����C2014�D
- ② ���{�����Ȋw��D������і����֘A��g�p�K�C�h���C���@��3 �ŁD2015�D
http://www.anesth.or.jp/guide/index.html - ② Caraceni A, Hanks G, Kaasa S, et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol. 2012; 13: e58-68.
�Q�l����
| �i �j�G�r�f���X���x�� |
Appendix�@���f��̕���p
���f��g�p���ɂ����ẮC���̕���p�������\���ɗ������Ă����Ȃ���Ȃ�Ȃ��B�Ȃ��C����p���͈��i�Y�t��������̓��肪��{�ƂȂ邪�C���f�ȊO�̌��\�E���ʂ�L�����܂ł͈قȂ�p�ʂⒷ���g�p�ɂ�镛��p���L�ڂ���Ă���B���������āC���҂ɑ��镛��p�����ɂ́C�������l�����������ł̎��ۂ̑I�����K�v�ł���B�܂��C�u��ȕ���p�v�Ɓu�����p�x�͒Ⴂ���d��ȕ���p�v�͋�ʂ��ė�������邱 �Ƃ��]�܂����B���f��̓����I�ȕ���p���\1 �Ɏ����B
���f��ɂ������Ô�ɂ��Ă��ߔNcost-effectiveness �������i�߂��Ă���C�����̍ۂɌ��y���邱�Ƃ����߂��悤�B��Îґ��Ƃ��āC���f�Ö@�ɂ��ĉ\�Ȍ�������s���C���҂̓��ӂĂ������Ƃ��d�v�ł���Ǝv����B
5-HT3��e�̝h�R��2�j: |
||
|---|---|---|
| ��ȕ���p | ���_�_�o�n | ���� |
| ������ | �֔� | |
| �����p�x�͒Ⴂ���d��ȕ���p | �Ɖu�n | �V���b�N�C�A�i�t�B���L�V�[ |
| �z�� | QT ���� | |
| ��ȕ���p | ���_�_�o�n | ���� |
| ������ | �֔� | |
| �ċz�� | ��������� | |
| ���˕��i�z�X�A�v���s�^���g�̂݁j | ���������u�ɁC�H�����^���ʒ� | |
| �����p�x�͒Ⴂ���d��ȕ���p | �畆 | �畆�S����nj�Q�iStevens-Johnson �nj�Q�j |
| �Ɖu�n | �A�i�t�B���L�V�[ | |
�f�L�T���^�]�� |
||
| ��ȕ���p | �Ɖu�n | �U�������ǁC�����ǂ̑��� |
| ���_�_�o�n | ����ԁC���K�� | |
| �����p�x�͒Ⴂ���d��ȕ���p | ��� | ������ |
�I�����U�s�� |
||
| ��ȕ���p | ���_�_�o�n | �X���C�߂܂��C�A�J�V�W�A�C�U�� |
| ������ | �֔�C�H�~���i�C���� | |
| ��� | �g���O���Z���h�㏸�C�R���X�e���[���㏸ | |
| ���̑� | �̏d���� | |
| �����p�x�͒Ⴂ���d��ȕ���p | ���_�_�o�n | �z���C���E��} |
| ��� | �������C���A�a���P�g�A�V�h�[�V�X | |
| �Ɖu�n | ��ܐ��ߕq�Ǐnj�Q | |
�t�F�m�`�A�W���n: |
||
| �����p�x�͒Ⴂ���d��ȕ���p | ���_�_�o�n | �x�����W�X�L�l�W�A�C�����nj�Q |
�x���]�W�A�[�s���n: |
||
| ��ȕ���p | ���_�_�o�n | ���C�C�߂܂� |
H2��e�̝h�R��: |
||
| ��ȕ���p | ���_�_�o�n | ���� |
| ������ | �֔�C���� | |
| �����p�x�͒Ⴂ���d��ȕ���p | �畆 | �畆�S����nj�Q�iStevens-Johnson �nj�Q�j |
| �Ɖu�n | �V���b�N�C�A�i�t�B���L�V�[ | |
�v���g���|���v�j�Q��: |
||
| ��ȕ���p | ���_�_�o�n | ���� |
| ������ | �����E��ցC���� | |
| �����p�x�͒Ⴂ���d��ȕ���p | �畆 | �畆�S����nj�Q�iStevens-Johnson �nj�Q�j�C ���Ő��\��Z���ǁiToxic Epidermal Necrolysis: TEN�j |
| �Ɖu�n | �V���b�N�C�A�i�t�B���L�V�[ | |
| ��A�� | �Ԏ����t��; | |
�Q�l����
| �i �j�G�r�f���X���x�� |
![�}1�@���S�̎�ϓI�]�����@](images/29/p73.gif)