総論
- 総説
- 日本産科婦人科学会の「医学的適応による未受精卵子,胚(受精卵)および卵巣組織の凍結・保存に関する見解」および「精子の凍結保存に関する見解」の理念を十分に理解し,遵守する。(⇒本節)
- がんに対する治療別の生殖細胞および妊孕性へ及ぼす影響の理解に努める。(⇒本節)
- 患者のがんおよび全身状態とがん治療の生殖細胞および妊孕性への影響を考慮し,妊孕性温存を考慮する。(⇒本章CQ1)
- 性腺機能の温存方法について理解に努める。(⇒本章CQ2, CQ3, 本節)
- 遺伝性腫瘍患者の妊孕性に関わる問題について理解に努める。(⇒本章CQ4)
- がん治療医およびその診療に関わる医療従事者は,がん患者(およびその家族)と相談し,必要に応じ生殖医療を専門とする医師に紹介し,妊孕性温存に関して患者の意思決定の補助を行う必要がある。(⇒本節)
小児を含む若年がん患者への治療の改善により,がんサバイバー(がん経験者)が増加している。一方で,がんに対する治療内容によっては,妊孕性(にんようせい;妊娠できる能力のこと)に影響を及ぼすことが知られており,がんサバイバーが不妊となることや性ホルモンの分泌低下を来すことが明らかとなってきている。これらのことから生殖細胞の保護や保存に対する取り組みが先進国を中心になされるようになってきた。本節では,がん患者の妊孕性温存療法施行のために必須と考えられる事項について述べる。なお,本節,および,本ガイドラインでは,がん治療後に生殖能力が損なわれた患者に対して行われる特別養子縁組の取り組み,および,提供配偶子による治療に関しては取り扱わない。
1.日本産科婦人科学会は,平成26 年4 月の日本産科婦人科学会臨時総会の承認を受け「医学的適応による未受精卵子および卵巣組織の採取・凍結・保存に関する見解」を示した(付記2)。その冒頭で「悪性腫瘍など(以下,原疾患)に罹患した女性に対し,その原疾患治療を目的として外科的療法,化学療法,放射線療法などを行うことにより,その女性が妊娠・出産を経験する前に卵巣機能が低下し,その結果,妊孕性が失われると予測される場合,妊孕性を温存する方法として,女性本人の意思に基づき,未受精卵子を採取・凍結・保存すること(以下,本法)が考えられる。本法は,原疾患治療で発生する副作用対策の一環としての医療行為と考えられるので,治療を受ける時期に挙児希望がない場合でも,本人が希望する場合には医療行為として認める必要がある。しかし,本法の実施が原疾患の予後に及ぼす影響,保存された卵子により将来において被実施者が妊娠する可能性と妊娠した場合の安全性など,未だ明らかでないことも多いため,被実施者に十分な情報提供を行い,被実施者自身が自己決定することが重要である」と述べられている。また,対象患者についての記述においては,「本法は,原疾患の治療により卵巣機能の低下が予想され,本法を施行することが被実施者の妊孕性温存と原疾患の治療の実施に著しい不利益とならないと判断されるものを対象とする」と述べられている。この日本産科婦人科学会の見解は,平成28 年6 月に胚(受精卵)の凍結保存についても言及されるなど一部が改訂されているが,上記の内容は変更がなされていない。一方,精子保存に関しては,この見解よりも早く平成19 年4 月に「精子の凍結保存に関する見解」が,日本産科婦人科学会より示されている(付記1)。「ヒト精子の凍結保存(以下本法)は人工授精ならびに体外受精などの不妊治療に広く臨床応用されている。一方,悪性腫瘍に対しては,外科的療法,化学療法,放射線療法などの治療法が進歩し,その成績が向上してきたものの,これらの医学的介入により造精機能の低下が起こりうることも明らかになりつつある。そのため,かかる治療を受ける者が将来の挙児の可能性を確保する方法として,受療者本人の意思に基づき,治療開始前に精子を凍結し保存することは,これを実施可能とする」と述べられている。
これらの見解は,がん・生殖医療に関わる医学水準および倫理的問題を考慮した現在の趨勢をまとめた理念であり,本医療に携わる医療者は,本理念を十分に理解し遵守すべきである。
なお,これらの日本産科婦人科学会の見解の全文は,総説の最後に付記するので,がん治療者を含めた本医療に携わる医療者は,閲読の上,内容を十分に理解していただきたい。
2.これらの理念をもとにがん患者に生殖医療を実施する上で,がん治療別の性腺機能へ与える影響と妊孕性温存方法については十分に理解しておくべき事項である。これらを十分に理解した場合のみ,患者に十分な情報提供が可能であり,がん患者の状態をふまえ最善の方法を患者が選択できると考えられる。
がんに対する治療には,手術療法,化学療法,放射線治療,ホルモン療法などがあるが,配偶子の形成には性差があり,形成臓器およびその体内における部位,形成過程,貯蔵の状態が異なるため,性別ごと,また,がん治療別の影響につき知る必要がある。性別,がん治療別の性腺機能への影響についてのまとめを記した(図2-1)。がん治療の子宮への影響については,本節では扱わない。

女性の生殖細胞への影響について紹介する。
骨盤内臓器の悪性腫瘍に対し腹腔からのアプローチによる手術療法のみが施行され,化学療法や放射線治療を追加治療しない場合の卵巣機能への影響に関しての研究は認められない。しかしながら,良性疾患であっても手術後の血流障害による卵巣機能への影響が懸念され1),子宮や卵巣の手術療法により,anti-Müllerian hormone(AMH;卵巣予備能の指標であり卵巣内の卵子数と概ね相関する)の低下が報告されている2)。両側卵巣を切除した場合には,卵巣機能は消失する。片側卵巣切除や卵巣部分切除およびそれらの組み合わせでは,卵巣組織内の卵子数を減少させる。これら手術による影響は,残存した卵巣組織が概してその役割を補うことが多いが,卵巣組織や卵子数の減少が著しい場合には卵巣機能不全となる。
抗がん薬には,卵子および卵巣機能に大きく影響するものと,ほとんど影響しないものがある3)。また,影響する場合にも作用点となる細胞が異なり,卵巣内の卵子に直接影響を与えるものや顆粒膜細胞などの卵子の支持細胞影響を与えるものがある3)。細胞分裂が活発な顆粒膜細胞は,多くの抗がん薬により影響を受けるため,女性ホルモンの産生を担う成熟した卵胞(卵子,顆粒膜細胞,莢膜細胞などの集合体で,卵胞の成熟とともに卵子は成熟する)の発育は障害される3)。このため女性ホルモンの産生が一時的に減少することにより無月経となる3)。これらの無月経は,化学療法による影響が,主に成熟した卵胞である場合には化学療法終了後に回復することが多い。一方,治療期間中に卵子数を減少させ,その後,生涯にわたり卵巣機能に影響を及ぼす可能性のある治療薬もある。この化学療法誘導性の無月経は,30〜76%の確率で起こるとの報告もある3)。抗がん薬別のリスク分類が紹介されている4-6)。シクロホスファミド,ブスルファンなどのアルキル化薬やシスプラチンなどの白金製剤は,卵子数を減少させる代表的なものである7-15)。これらの抗がん薬は,総使用量が増加するほど原始卵胞数は減少する12)。治療薬の量により治療後早期の永続的な卵巣機能不全(卵子消失,ホルモン産生能低下)を生じる。アルキル化薬の使用量をシクロホスファミドの使用量に換算し,卵巣への影響を予測する方法も開発されている12)。また,これらの薬物による影響は,治療を受けた年齢によっても異なり,年齢が高いほど早発卵巣不全となる率が高くなる3)。
放射線治療は,卵巣内の原始卵胞数を減少させる。直接照射される放射線被曝のみではなく,散乱した放射線被曝の影響も考慮する必要がある。これらの総被曝量が増えるほど卵巣の障害は大きくなる。2Gy の照射量で卵巣内の原始卵胞数が減少するとの報告もある13)。また,出生時で20.4Gy,30 歳時では14.3Gy 以上の照射で卵巣機能が廃絶するとの報告もあり14),年齢が高くなるほどその影響は受けやすく,早発卵巣不全となる率が高くなる14-16)。卵巣への放射線照射量と性成熟別の無月経のリスクが分類されている15)。
視床下部や下垂体への放射線照射は,ゴナドトロピンの分泌能を障害し卵巣機能不全の原因となりうる。35〜40Gy にてゴナドトロピン分泌不全が生じる。これらの治療は,卵巣組織を障害するものではないが,中枢機能が障害されるため卵巣が機能しなくなる17)。
男性の生殖細胞への影響を紹介する。
精巣腫瘍をはじめとする精巣への手術療法は,精子形成,男性ホルモン産生,精子の輸送に影響を及ぼす可能性がある。精巣がんで片側の精巣を切除し化学療法や放射線治療を施行しない場合の11 年間の追跡調査では85%で挙児可能であったとの報告があり,影響はないものと考えられる18)。両側の精巣を切除すると,精子形成と男性ホルモン産生は不可能となる。
抗がん薬には,精子形成および精巣機能に大きく影響するものと,ほとんど影響しないものがある。また,影響する場合,精巣内の精子形成のもととなる精原細胞とその支持細胞で男性ホルモンを産生するライディッヒ細胞に影響を与える19)。精原細胞は分裂が活発であるため,ライディッヒ細胞より,抗がん薬による影響を受けやすい20)。よって,化学療法終了後に男性ホルモン産生は認められていても,精子形成が障害され無精子症となっている場合がある20)。化学療法が終了した数年後に精子形成が再開することもある20)。抗がん薬別のリスク分類が紹介されている5)。シクロホスファミド,イホスファミド,ブスルファン,プロカルバジンなどのアルキル化薬およびシスプラチンなどの白金製剤は,精原細胞数を減少させる21-26)。総使用量の増加により治療後早期の永続的な造精機能障害を生じる。
放射線治療も,精原細胞とライディッヒ細胞に影響を及ぼすが,精原細胞は,放射線により感受性が高いため,化学療法と同様にホルモン産生能よりも精子形成が障害されやすい27)。健康な同胞との比較で21 歳より若い時期に精巣に直接,あるいはその近傍への放射線治療を受けた患者の11 年間の追跡調査によると,精巣に7.5Gy 以上の被曝量になると妊孕性が低下することが報告されている26)。一時的な乏精子症や無精子症は,10cGy,35cGy の照射により起こる28)。2〜4Gy 以上の照射で永続的な無精子症との報告もある28-30)。精巣への放射線照射量と性成熟別の無精子症のリスクが分類されている15)。
視床下部や下垂体への放射線照射は,ゴナドトロピンの分泌能を障害し精巣機能不全の原因となりうる31)。35〜40Gy にてゴナドトロピン分泌不全が生じる32)。
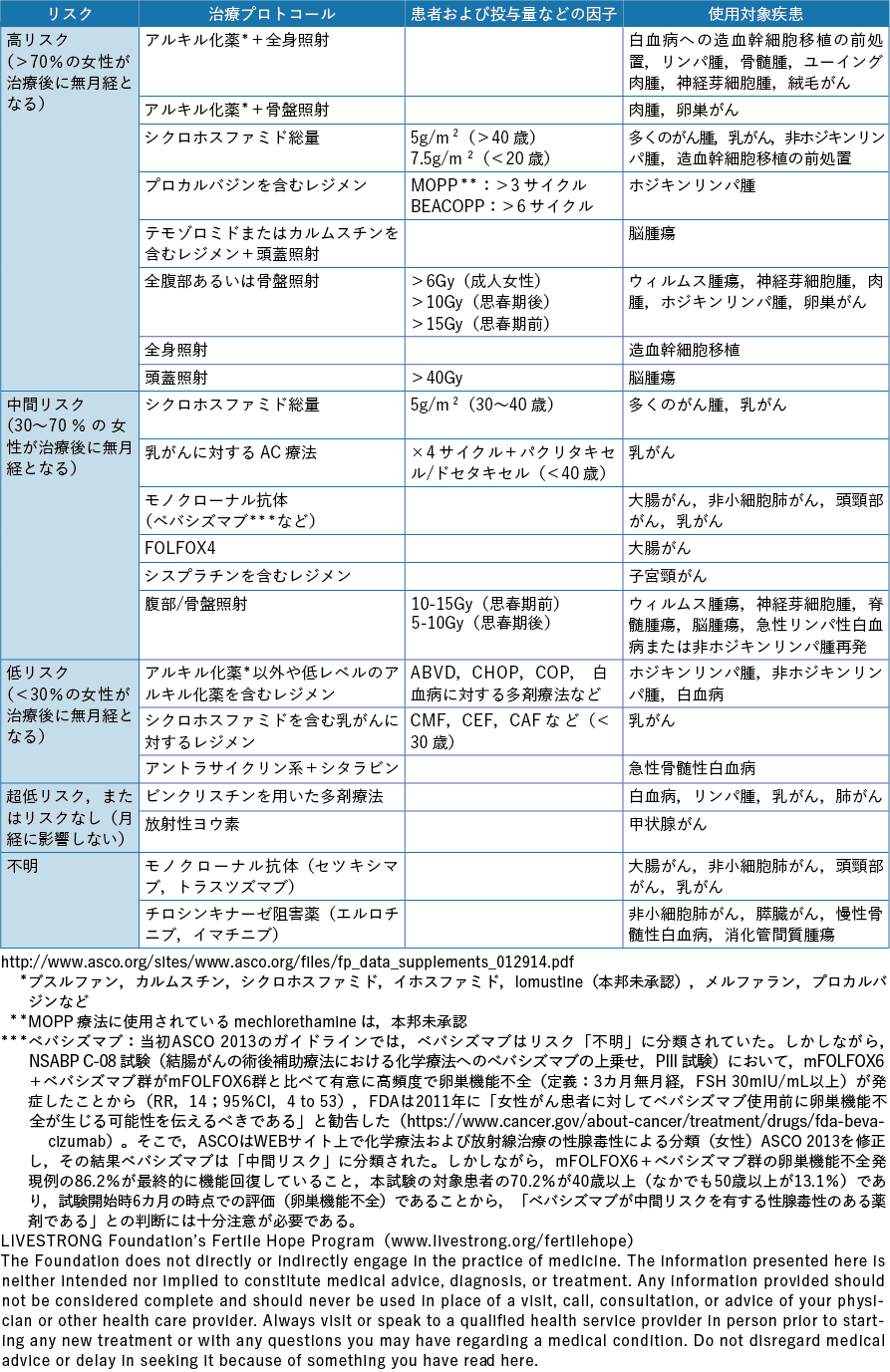
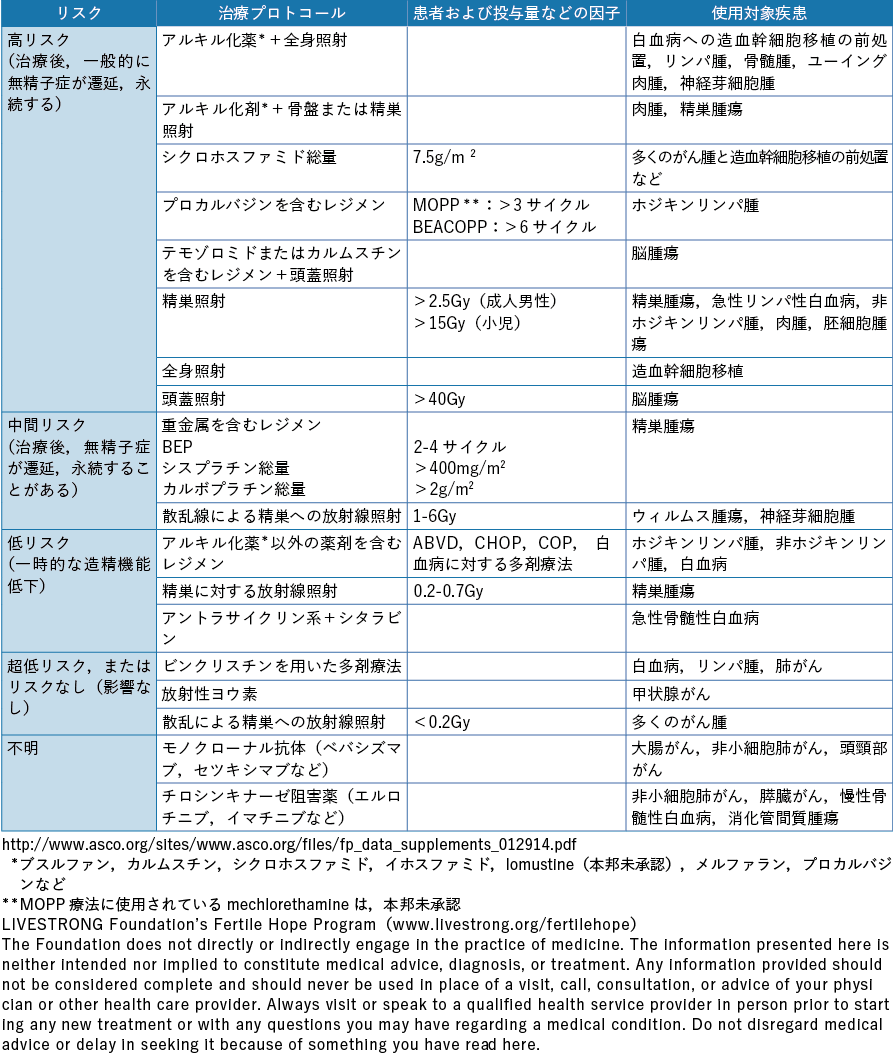
以上のようにがん治療別に生殖細胞,妊孕性の及ぼす影響を論じたが,米国臨床腫瘍学会(American Society of Clinical Oncology:ASCO)は,治療プロトコール,患者および薬物投与量など妊孕性に及ぼす因子,使用対象疾患別の不妊リスクを高リスク群,中間リスク群,低リスク群,超低リスク,不明に分類し,男女別に一覧表として情報を提供している(表2-1,表2-2)32)。
一方,甲状腺機能は,妊孕性に影響を与える因子として重要であり,がん治療により影響の出ることが知られている。これは女性および男性の両性に共通した影響である。インターフェロン(interferon:IFN)-αは,甲状腺に対する自己抗体を高率に誘導し,甲状腺機能異常症を誘発する33, 34)。また,チロシンキナーゼ阻害薬は,腫瘍細胞の成長,浸潤,転移に重要な働きをするチロシンキナーゼを阻害するが,非常に高い割合(32〜85%)で甲状腺機能低下症を誘発する33-35)。
(一部改変,WEB サイト上では2014 年1 月に一部修正あり)
(一部改変,WEB サイト上では2014 年1 月に一部修正あり)
3.患者に施行されるがん治療の生殖細胞および妊孕性への影響を理解し,患者の状態を吟味した上で妊孕性温存療法の施行につき考慮する必要がある。この内容は,本章CQ1 にて詳しく説明される。
4.性腺機能の保護や温存に関しては,生殖細胞を体内に残した状態で行われる薬物による保護や性腺位置移動,また,生殖細胞を体外に取り出す生殖細胞凍結保存が実施されている。生殖細胞凍結保存については,本章のCQ2 とCQ3 で,またgonadotropin releasing hormone(GnRH)アゴニストによる保護に関しては,各論の「乳腺」の項で詳しく説明されているので割愛する。なお,生殖細胞を体外に取り出す生殖細胞凍結保存などの妊孕性温存療法は健康保険の適用とはならない。2017 年1 月時点で,滋賀県や千葉県いすみ市などごく一部の地域では,生殖細胞の採取や凍結保存等にかかる保険適用外経費に対して助成金が補助されている。
また,卵子・胚(受精卵)凍結のための採卵に伴って種々の合併症が起こりうる。一般的に採卵は超音波イメージガイド下での経腟的な穿刺により行うため,腟壁および骨盤内の血管損傷による出血,ならびに,腸管,膀胱などの他臓器損傷のリスクがある。また,穿刺に伴って腟内細菌に起因する骨盤腹膜炎を惹起する可能性がある。採卵に先立ち排卵誘発を行う場合には,排卵誘発剤使用に伴う卵巣過剰刺激症候群(ovarian hyperstimulation syndrome:OHSS)ならびに血栓症の発症に留意する必要がある。
性腺の位置移動術は,放射線治療が必要な場合に施行される36)。卵巣位置移動術は,適応としては子宮頸がんが頻度的には最も多いと考えられるが,妊孕性温存目的ではなく女性ホルモン分泌能の維持を目的としている。妊孕性温存の観点からすると,大腸がん,悪性リンパ腫,横紋筋肉腫,ユーイング肉腫などの原発巣,あるいは転移病変が,骨盤内の卵巣付近に生じた場合に考慮することとなる。これらの治療の際には,組織型にもよるが,14〜60Gy の線量が必要であり,卵巣へ照射される場合は,卵巣内の卵子の減少は明らかである36)。以上より,患者の状態が許せば腫瘍摘出術の際,あるいは放射線治療を行う前に卵巣の位置移動術を行うことを考慮すべきである。骨盤外へ高位外側に移動させることが多いが,悪性リンパ腫など大血管周辺のリンパ節に生じる場合は,内側の中心部への移動も報告されている36)。また,この措置を行っても,卵巣の機能が必ずしも保持されないことに留意する36)。子宮頸がんで骨盤照射を施行される場合,腸骨稜より頭側1.5cm 以上の高位に卵巣を移動させた群と1.5cm 未満の移動の群間で血清follicle stimulating hormone(FSH)値の上昇(30mIU/mL 以上)している患者の割合を比較すると,頭側1.5cm 以上の高位に卵巣を移動させた群において有意に(オッズ比9.91:信頼区間1.75-56.3)卵巣機能が保持されている患者の割合が高いとの報告があり,照射部位より可能な限り離した部位に卵巣を移動し固定すべきであると考えられる37)。
精巣に関しても,放射線被曝を避けるため,一側の精巣を対側の陰囊に移動した報告がなされている38)。
(引用文献32より)
5.特定の遺伝子変異により悪性腫瘍が発生することが明らかとなってきている。この変異が親から子へ遺伝される遺伝性腫瘍について関心が高まっており,がん治療者は,遺伝性腫瘍の妊孕性に関わる問題についても理解すべきであると考えられる。本件に関しては,本章CQ4 で詳しく説明される。
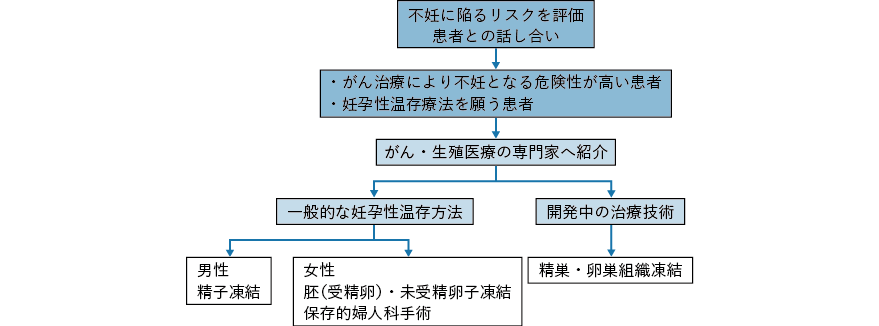
6.患者の意思決定が可能となるように配慮をしつつ最大限の情報提供がなされるべきである。そのためには,がん治療医および診療に関わる医療従事者が,がん患者が生殖可能年齢,あるいはその前の小児期にある場合に妊孕性温存療法の施行を考慮し,必要に応じて生殖医療の専門家に相談すべきであると考えられる32)。これは,2013 年に改訂されたASCO のガイドラインの中心的な内容となっている。医師のみならず,がん治療に関わる全ての医療者は,がん治療を受ける患者の不妊症に陥るリスクを評価し,患者(およびその家族:特に患者が小児の場合)とよく話し合った上で,リスクの高い患者,妊孕性温存を願う患者を抽出し,がん患者の妊孕性温存を行う専門家へ紹介するよう勧めている(図2-2)。この生殖医療を専門とする医師への紹介により患者(およびその家族)は,十分に生殖医療に関する情報を得,その受療について十分に考える機会をもつと考えられる。生殖医療の専門家から患者への説明は,生殖医療の受療にかかわらず,その後の患者の満足度が高いとの報告が認められている39)。また,いったん患者が生殖医療の受療に関し方針を決断した際には,どちらの選択を行っても,がん治療に関し著しい不利益を被らない限り,その意思は尊重されるべきである。これは,米国のOncofertility consortium でも提言されており,日本産科婦人科学会の見解と合致する。なお,挙児を希望しない患者に対しても,治療後の内分泌学的なフォローアップの必要性などに関する情報提供を行い,がんサバイバーシップの向上に努める。
以上のように,がん患者に妊孕性温存療法の施行を考慮する際には,日本産科婦人科学会の見解を遵守し,がん治療別の性腺機能へ与える影響とがんの状況を念頭に置き,妊孕性温存を行うかどうかを考える必要がある。その際には,生殖細胞の温存方法の理解が必要であり,状況により生殖医療専門医などの生殖医療を専門とする医師(産婦人科あるいは泌尿器科)への紹介により妊孕性温存の情報提供を行い,患者の意思決定の補助を行う必要がある。
引用文献
- 1)
- La Torre R, Montanino-Oliva M, Marchiani E, et al. Ovarian blood flow before and after conservative laparoscopic treatment for endometrioma. Clin Exp Obstet Gynecol. 1998; 25: 12-4
- 2)
- Iwase A, Hirokawa W, Goto M, et al. Serum anti-Müllerian hormone level2 is a useful marker for evaluating the impact of laparoscopic cystectomy on ovarian reserve. Fertil Steril. 2010; 94: 2846-9
- 3)
- Ben-Aharon I, Shalgi R. What lies behind chemotherapy-induced ovarian toxicity? Reproduction. 2012; 144: 153-63
- 4)
- Trudgen K, Ayensu-Coker L. Fertility preservation and reproductive health in the pediatric, adolescent, and young adult female cancer patient. Curr Opin Obstet Gynecol. 2014; 26: 372-80
- 5)
- Lee SJ, Schover LR, Partridge AH, et al. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol. 2006; 24: 2917-31
- 6)
- Wallace WH, Anderson RA, Irvine DS. Fertility preservation for young patients with cancer: who is at risk and what can be offered? Lancet Oncol. 2005; 6: 209-18
- 7)
- Koyama H, Wada T, Nishizawa J, et al. Cyclophosphamide-induced ovarian failure and its therapeutic significance in patients with breast cancer. Cancer. 1977; 39: 1403-9
- 8)
- Rose DP, Davis TE. Ovarian function in patients receiving adjuvant chemotherapy for breast cancer. Lancet. 1977; 1: 1174-6
- 9)
- Warne GL, Fairley KF, Hobbs JB, et al. Cyclophosphamide-induced ovarian failure. N Engl J Med. 1973; 289: 1159-62
- 10)
- Bokemeyer C, Schmoll HJ, van Rhee J, et al. Long-term gonadal toxicity after therapy for Hodgkin’s and non-Hodgkin’s lymphoma. Ann Hematol. 1994; 68: 105-10
- 11)
- Byrne J, Fears TR, Gail MH, et al. Early menopause in long-term survivors of cancer during adolescence. Am J Obstet Gynecol. 1992; 166: 788-93
- 12)
- blue DM, Kawashima T, Stovall M, et al. Fertility of female survivors of childhood cancer: a report from the childhood cancer survivor study. J Clin Oncol. 2009; 27: 2677-85
- 13)
- Wallace WH, Thomson AB, Kelsey TW. The radiosensitivity of the human oocyte. Hum Reprod. 2003; 18: 117-21
- 14)
- Wo JY, Viswanathan AN. Impact of radiotherapy on fertility, pregnancy, and neonatal outcomes in female cancer patients. Int J Radiat Oncol Biol Phys. 2009; 73: 1304-12
- 15)
- Wallace WH, Thomson AB, Saran F, et al. Predicting age of ovarian failure after radiation to a field that includes the ovaries. Int J Radiat Oncol Biol Phys. 2005; 62: 738-44
- 16)
- Rodriguez-Wallberg KA, Oktay K. Fertility preservation medicine: options for young adults and children with cancer. J Pediatr Hematol Oncol. 2010; 32: 390-6
- 17)
- Rappaport R, Brauner R, Czernichow P, et al. Effect of hypothalamic and pituitary irradiation on pubertal development in children with cranial tumors. J Clin Endocrinol Metab. 1982; 54: 1164-8
- 18)
- Huddart RA, Norman A, Moynihan C, et al. Fertility, gonadal and sexual function in survivors of testicular cancer. Br J Cancer. 2005; 93: 200-7
- 19)
- Howell SJ, Radford JA, Ryder WD, et al. Testicular function after cytotoxic chemotherapy: evidence of Leydig cell insufficiency. J Clin Oncol. 1999; 17: 1493-8
- 20)
- Howell SJ, Shalet SM. Testicular function following chemotherapy. Hum Reprod Update. 2001; 7: 363-9
- 21)
- blue DM, Liu W, Kutteh WH, et al. Cumulative alkylating agent exposure and semen parameters in adult survivors of childhood cancer: a report from the St Jude Lifetime Cohort Study. Lancet Oncol. 2014; 15: 1215-23
- 22)
- Thomson AB, Campbell AJ, Irvine DC, et al. Semen quality and spermatozoal DNA integrity in survivors of childhood cancer: a case-control study. Lancet 2002; 360: 361-7
- 23)
- Aubier F, Flamant F, Brauner R, et al. Male gonadal function after chemotherapy for solid tumors in childhood. J Clin Oncol. 1989; 7: 304-9
- 24)
- Williams D, Crofton PM, Levitt G. Does isosfamide affect gonadal function? Pediatr Blood Cancer. 2008; 50: 347-51
- 25)
- Lampe H, Horwich A, Norman A, et al. Fertility after chemotherapy for testicular germ cell cancers. J Clin Oncol. 1997; 15: 239-45
- 26)
- blue DM, Kawashima T, Stovall M, et al. Fertility of male survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. J Clin Oncol. 2010; 28: 332-9
- 27)
- Shalet SM, Tsatsoulis A, Whitehead E, et al. Vulnerability of the human Leydig cell to radiation damage is dependent upon age. J Endocrinol. 1989; 120: 161-5
- 28)
- Ash P. The influence of radiation on fertility in man. Br J Radiol. 1980; 53: 271-8
- 29)
- Shalet SM. Effect of irradiation treatment on gonadal function in men treated for germ cell cancer. Eur Urol. 1993; 23: 148-51
- 30)
- Kinsella TJ, Trivette G, Rowland J, et al. Long-term follow-up of testicular function following radiation therapy for early-stage Hodgkin’s disease. J Clin Oncol. 1989; 7: 718-24
- 31)
- Schmiegelow M, Lassen S, Poulsen HS, et al. Gonadal status in male survivors following childhood brain tumors. J Clin Endocrinol Metab. 2001; 86: 2446-52
- 32)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10
- 33)
- Gogas H, Ioannovich J, Dafni U, et al. Prognostic significance of autoimmunity during treatment of melanoma with interferon. N Engl J Med. 2006; 354: 709-18
- 34)
- Carella C, Mazziotti G, Amato G, et al. Clinical review 169: Interferon-alpha-related thyroid disease: pathophysiological, epidemiological, and clinical aspects. J Clin Endocrinol Metab. 2004; 89: 3656-61
- 35)
- Funakoshi T, Shimada YJ. Risk of hypothyroidism in patients with cancer treated with sunitinib: a systematic review and meta-analysis. Acta Oncol. 2013; 52: 691-702
- 36)
- Irtan S, Orbach D, Helfre S, et al. Ovarian transposition in prepubescent and adolescent girls with cancer. Lancet Oncol. 2013; 14: e601-8
- 37)
- Hwang JH, Yoo HJ, Park SH, et al. Association between the location of transposed ovary and ovarian function in patients with uterine cervical cancer treated with(postoperative or primary)pelvic radiotherapy. Fertil Steril. 2012; 97: 1387-93
- 38)
- Arango O, Bielsa O, Lorente JA, et al. Hemiscrotectomy with contralateral testicular transposition for scrotal cancer. J Urol. 2002; 168: 1406-7
- 39)
- Letourneau JM, Ebbel EE, Katz PP, et al. Pretreatment fertility counseling and fertility preservation improve quality of life in reproductive age women with cancer. Cancer. 2012; 118: 1710-7
付記1 精子の凍結保存に関する見解
日本産科婦人科学会
日本産科婦人科学会
ヒト精子の凍結保存(以下本法)は人工授精ならびに体外受精などの不妊治療に広く臨床応用されている。
一方,悪性腫瘍に対しては,外科的療法,化学療法,放射線療法などの治療法が進歩し,その成績が向上してきたものの,これらの医学的介入により造精機能の低下が起こりうることも明らかになりつつある。そのため,かかる治療を受ける者が将来の挙児の可能性を確保する方法として,受療者本人の意思に基づき,治療開始前に精子を凍結し保存することは,これを実施可能とする。
なお,本法の実施にあたっては以下の点に留意して行う。
精子の凍結保存を希望する者が成人の場合には,本人の同意に基づいて実施する。精子の凍結保存を希望する者が未成年者の場合には,本人および親権者の同意を得て,精子の凍結保存を実施することができ,成人に達した時点で,本人の凍結保存継続の意思を確認する。
凍結保存精子を使用する場合には,その時点で本人の生存および意思を確認する。
凍結精子は,本人から廃棄の意思が表明されるか,あるいは本人が死亡した場合,廃棄される。
凍結保存精子の売買は認めない。
本法の実施にあたっては,精子凍結保存の方法ならびに成績,凍結保存精子の保存期間と廃棄,凍結した精子を用いた生殖補助医療に関して予想される成績と副作用などについて,文書を用いて説明し,了解を得た上で同意を取得し,同意文書を保管する。
医学的介入により造精機能低下の可能性がある場合は,罹患疾患の治療と造精機能の低下との関連,罹患疾患の治癒率について
も文書を用いて説明する。
(平成19 年4 月発表,理事長 吉村泰典,倫理委員会委員長 星合 昊)
http://www.jsog.or.jp/about_us/view/html/kaikoku/H19_4_seishitouketsuhozon.html
付記2 医学的適応による未受精卵子,胚(受精卵)および卵巣組織の凍結・保存に関する見解
日本産科婦人科学会
日本産科婦人科学会
本会倫理委員会は,「医学的適応による未受精卵子および卵巣組織の採取・凍結・保存に関する見解」(平成26 年4 月)に,胚の凍結・保存を含めた上で,通常の生殖医療とは異なる留意点があるため,平成27 年度より綿密な協議を重ねてまいりました。各界の意見を十分に聴取しました結果,改定案をとりまとめ,機関誌68 巻4 号に掲載し,会員の意見を聴取した上で,理事会に答申致しました。理事会(第1 回理事会・平成28 年6 月4 日)ならびに総会(平成28 年6 月25 日)はこれを承認しましたので,会告の改定としてここに会員にお知らせ致します。
平成28 年6 月
公益社団法人 日本産科婦人科学会
理事長 藤井 知行
倫理委員会委員長 苛原 稔
———————————–
日本産科婦人科学会(以下,本会)倫理委員会は,悪性腫瘍など(以下,原疾患)の治療により,医学的にみて卵巣機能が低下すると予想される場合に,未受精卵子の採取・凍結・保存(以下,本法)を実施する必要性を認め,その際に本会会員が順守すべき事項を見解として示してきました。結婚している女性が本法を希望する場合は,これまでも本会が示す「体外受精・胚移植に関する見解」,「顕微授精に関する見解」,および「ヒト胚および卵子の凍結保存と移植に関する見解」に準拠し,胚(受精卵,以下胚という)の状態での凍結保存が行われてきたと考えられます。しかしながら,医学的適応に基づいて胚の凍結・保存を開始する場合は,通常の生殖医療として行われる胚凍結とは異なる留意点があるため,今回,本会会員が順守すべき事項を下記のように見解として公表いたします。
本法が医学的,倫理的,社会的に定着することを期待するとともに,本会会員においては本見解の目的を正しく理解し,かつ,一般社会や他の医療従事者に対して正しく目的と医療の内容を啓発していただきますようお願いいたします。
なお,既に,医学的適応による未受精卵子および卵巣組織の採取・凍結・保存に関する登録が受理されている施設については,本見解施行細則に基づいて再登録をお願いします。
平成28 年6 月
公益社団法人 日本産科婦人科学会
理事長 藤井 知行
倫理委員会委員長 苛原 稔
———————————–
医学的適応による未受精卵子,胚(受精卵)および卵巣組織の凍結・保存に関する見解
悪性腫瘍など(以下,原疾患)に罹患した女性に対し,その原疾患治療を目的として外科的療法,化学療法,放射線療法などを行うことにより,その女性が妊娠・出産を経験する前に卵巣機能が低下し,その結果,妊孕性が失われると予測される場合,妊孕性を温存する方法として,女性本人の意思に基づき,未受精卵子または胚・受精卵(以下胚という)を凍結・保存すること(以下,本法)が考えられる。本法は,原疾患治療で発生する副作用対策の一環としての医療行為と考えられるので,治療を受ける時期に挙児希望がない場合でも,本人が希望する場合には医療行為として認める必要がある。
しかし,本法の実施が原疾患の予後に及ぼす影響,保存された卵子,胚により将来において被実施者が妊娠する可能性と妊娠した場合の安全性など,未だ明らかでないことも多いため,被実施者に十分な情報提供を行い,被実施者自身が自己決定することが重要である。
本法は体外受精・胚移植,顕微授精や卵子または胚の凍結保存を実施することを前提としており,日本産科婦人科学会(以下,本会)の「体外受精・胚移植に関する見解」,「顕微授精に関する見解」および「ヒト胚および卵子の凍結保存と移植に関する見解」に準拠して実施されなければならない。さらに本法は通常の生殖補助医療(ART)とは異なる医学的,倫理的,社会的な問題を包含しているため,以下の点に留意して行われることを要す。
(対象)
- 本法は,原疾患の治療により卵巣機能の低下が予想され,本法を施行することが被実施者の妊孕性温存と原疾患の治療の実施に著しい不利益とならないと判断されるものを対象とする。
- 本法の実施にあたっては,原疾患の状態,予後など,本法を行うことが原疾患治療に及ぼす影響を把握するため,原疾患主治医から文書による適切な情報提供がなされていることを要す。
- 本法の実施にあたっては,原疾患主治医と生殖医療担当医が,情報を共有しながら,以下の必要事項について文書を用いて被実施者(被実施者の意思確認が困難な場合は代諾者)に説明することを要す。
(1)原疾患の治療と卵巣機能の低下の関連性
(2)原疾患の状態,予後
(3)本法の実施が原疾患の予後に影響を及ぼす可能性
(4)本法の詳細
(5)凍結保存された未受精卵子または胚を用いたART の詳細
(6)凍結保存された未受精卵子または胚により将来,被実施者が妊娠する可能性と妊娠した場合の安全性
(7)凍結された未受精卵子または胚の保存期間と許容された保存期間を過ぎた場合の取り扱い
(8)費用,その他 - 本法を希望する者が成人の場合には,本人から文書による同意を取得し実施する。胚の凍結を希望する場合には,被実施者夫婦から文書による同意を取得し実施する。本法を希望する者が未成年者の場合には,本人および代諾者の文書による同意を得て実施するが,被実施者が成人に達した時点で,本人の凍結保存継続の意思を確認し,改めて本人から文書による同意を取得する。
- 本法を実施するART 施設は,本会に登録されたART 実施登録施設(以下,ART 登録施設)であり,かつ,本法の実施について倫理委員会において審査を受けていることを要す。
- 本法は,原疾患治療施設内にあるART 登録施設で行われるのが望ましいが,原疾患治療施設内にART 登録施設がない場合には,原疾患治療施設と連携できる他のART 登録施設が行ってもよい。
- 本法を実施するART 登録施設には日本生殖医学会が認める生殖医療専門医が常勤していることが望ましい。
- 凍結されている未受精卵子はその卵子の由来する被実施者に帰属するものであり,その被実施者は当該ART 登録施設に対し,凍結未受精卵子の保管を委託する。また,凍結されている胚はそれを構成する両配偶子の由来する被実施者夫婦に帰属するものであり,被実施者夫婦は当該ART 登録施設に対し,胚の保管を委託する。
- 未受精卵子の保存期間中,当該ART 登録施設は,定期的に,被実施者(被実施者が未成年の場合は被実施者と代諾者の両者,被実施者の意思確認が困難な場合は代諾者)に対して未受精卵子の保存を継続する意思の有無を確認することを要す。また,胚を凍結保存期間中は,当該ART 登録施設は,定期的に,被実施者夫婦に対して胚の保存を継続する意思の有無を確認することを要す。
- 保存された未受精卵子,胚は,以下のいずれかの場合に廃棄される。(1)被実施者(胚の場合は,被実施者夫婦のいずれか)から廃棄の意思が表明された場合。(2)被実施者が生殖年齢を超えた場合。(3)被実施者(胚の場合は,被実施者夫婦のいずれか)が死亡した場合。
- 凍結された胚の保存期間は,被実施者夫婦が夫婦として継続している期間であって,かつ卵子を採取した女性の生殖年齢を超えないこととする。
- 当該ART 登録施設で卵子または胚の保存を継続できない場合,当該ART 登録施設は被実施者(胚の場合は,被実施者夫婦双方)に通知し,被実施者の同意を得たうえで,改めて原疾患治療施設と連携して,他のART 登録施設での卵子保存の継続を検討する。
- 保存された未受精卵子または胚をART に使用する場合には,改めて原疾患主治医から文書による適切な情報提供を得るとともに,本会会告「体外受精・胚移植に関する見解」,「顕微授精に関する見解」,および「ヒト胚および卵子の凍結保存と移植に関する見解」に準拠して行うことを要す。
- 凍結融解後の卵子から得られた胚,または凍結融解後の胚は,卵子採取を受けた被実施者のみに移植されるものであり,ART登録施設は移植ごとに被実施者夫婦から文書による同意を取得し,同意文書を保管する。
- 未受精卵子あるいは胚の保存施設と,未受精卵子あるいは胚を用いてART を実施する施設は同一であることを原則とする。
なお,ART 実施施設を変更する場合には,改めて原疾患治療施設と連携して,被実施者の同意を得てこれを行う。その際のART 実施施設は,ART 登録施設であることを要す。 - 凍結保存された未受精卵子,胚の売買は認めない。
- 凍結保存された未受精卵子,胚の譲渡は認めない。ただし,18 項に規定された場合を除く。
- 凍結保存後,被実施者(胚の場合は被実施者夫婦双方)から廃棄の意思が表明された凍結卵子または胚を生殖医学の発展に資する研究に利用する場合は,本会会告「ヒト精子・卵子・受精卵を取り扱う研究に関する見解」および関連する法律や国・省庁ガイドラインに沿い,必要な手続きを改めて施行しなければならない。
- 本会会員が本法を行うにあたっては,所定の様式に従って本会に登録,報告しなければならない。本会への申請にあたっては,未受精卵子,胚,卵巣組織のうち,凍結保存の対象とするものを明確に示すことを要す。
(実施施設)
(卵子・胚の保存)
(ART での使用)
(その他)
———————————–
医学的適応による未受精卵子,胚(受精卵)および卵巣組織の凍結・保存に関する見解の細則
- 医学的適応による卵巣組織の凍結・保存は,未受精卵子,胚の場合と同じく,基本的に本法に含まれる医療行為と考えられ,卵巣組織の凍結・保存を実施する生殖補助医療実施機関は,本見解に加えて,卵巣組織の採取などに関わる要件が必要となる。
- 通常の生殖医療を実施している生殖補助医療実施医療機関が,不妊治療としての胚凍結のほかに医学的適応による胚の凍結保存を行う場合は,本法に関する登録申請を行わなければならない。
- 本見解改定後から平成28 年12 月末までを移行期間とし,この期間内に本法の登録を行っていない生殖補助医療実施医療機関において,医学的適応による未受精卵子,胚および卵巣組織の凍結・保存を必要とする症例が発生した場合には,本見解に基づき本法を実施するとともに,実施後速やかに登録申請(施設,症例)を行わなければならない。
- 通常の生殖補助医療治療中の症例に悪性疾患が見つかり,悪性疾患の治療前後に凍結融解胚移植を行う場合は,本見解の対象となる生殖補助医療とは見なされないが,通常の生殖医療を実施している生殖補助医療実施医療機関においても,本見解に準拠した必要事項などを文書により説明することが望ましい。
- 既に「医学的適応による未受精卵子および卵巣組織の採取・凍結・保存に関する登録」を行っている施設は,胚についても医学的適応の下に凍結・保存を行う旨,本会へ申告することを要する。
- 施設の登録状況は平成29 年1 月以降,順次本会ホームページ上に公開する。
(平成26 年4 月 施行,理事長 小西 郁生,倫理委員長 苛原 稔)
(平成28 年6 月 改定,理事長 藤井 知行,倫理委員長 苛原 稔)
- CQ1
- 挙児希望を有するがん患者に対して,どのような妊孕性に関連する情報を提供すべきか?
- 推奨グレードなし
-
- 1.がん治療医は,何よりもがん治療を最優先とする。
- 推奨グレードなし
-
- 2.がん治療医は,がん治療によって生殖可能年齢内に不妊となる可能性およびそれに関する情報を患者に伝える。
- 推奨グレードなし
-
- 3.挙児希望がある場合,がん治療医は,可能な限り早期に生殖医療を専門とする医師を紹介する。
- 推奨グレードなし
-
- 4.がん治療医は,生殖医療を専門とする医師との密な医療連携のもと,妊孕性温存療法の有無やその時期を考慮する。
背景・目的
近年,がん治療の進歩に伴って一部のがん患者はがんを克服することが可能となってきた。一方,がん治療の種類によってはがん治療後に性腺機能不全による妊孕性喪失が惹起されることから,予後良好でかつ挙児希望を有する小児,思春期・若年(以下,若年)がん患者に対するがん治療開始前の妊孕性温存療法は,がん治療医の考慮すべき事項となってきた。しかしながら,原疾患の進行の程度や患者の全身状態によっては,妊孕性温存療法は,原疾患の治療に多大な悪影響を及ぼす,あるいは,患者に重篤な危険をもたらすと考えられるため,その施行を断念せざるを得ない場合も存在する。そこで,本CQ では若年がん患者に対する妊孕性温存に関するがん治療医の考え方を検討する。妥当性のある臨床試験を実施することは倫理的にも困難であるため,科学的根拠となるレベルの高いエビデンスは存在しないが,重要事項としてコンセンサスが得られているので,推奨グレードは敢えて「なし」とした。
解説
がん治療は,若年がん患者の生殖内分泌機能に何らかの悪影響を与える可能性がある。近年がん治療の進歩に伴って,長期生存するがんサバイバーが増加していることから,若年がん患者にとって治療後の性腺機能の維持や妊孕性温存は重要な関心事項の一つになっている1-5)。2006 年に刊行された若年がん患者に対する妊孕性温存に関するASCO のガイドラインには,「がん治療医は,患者が生殖可能年齢内に不妊となる可能性に関する情報をがん治療開始前に提供し,がん治療医が適切であると判断した挙児希望を有する患者に対して考慮される妊孕性温存療法の施行を検討し,生殖医療を専門とする医師へ紹介するべきである」と記されている1)。しかしながら,がん治療医の多くは,治療開始前にがん治療による妊孕性低下に関する情報をがん患者に伝えていない現状がある1)。がん治療医は,がん治療による不妊に関する情報よりも,患者の命に関わる合併症に関する情報提供を優先することが一般的である。何よりも,妊孕性温存に関する情報を患者に提供する際のがん治療医としての判断が重要であるが,予定しているがん治療が患者の性腺機能喪失や妊孕性喪失につながると予想される場合,治療開始前に可能な限り早期に患者との将来の妊孕性温存に関する話し合いの場が設けられるべきである1, 3, 5-7)。また若年がん患者は,がん治療医の同意のもと,生殖医療を専門とする医師から妊孕性温存療法に関する具体的かつ正確な情報を受けるべきである1, 3, 6, 7)。現在,がん治療開始前の妊孕性温存に関する若年がん患者に対する情報提供は,一連のがん治療の中で一般的に考慮されるべき重要事項の一つとなると考えられている4)。一方,妊孕性温存療法は,性腺への影響が予想されるがん治療を開始するまでに終わらせる必要性がある7)。再発リスクや死亡率が高い疾患に罹患したがん患者に対する妊孕性喪失に関する情報提供に関しては,倫理的側面から議論の余地がある8)。
National Comprehensive Cancer Network(NCCN)のガイドラインは,「妊孕性温存はadolescent and young adult(AYA)世代(15〜39 歳)がん患者のがん治療を構成する重要な診療の一部である」と強調している9)。さらに本ガイドラインは,「全てのがん患者に対してがん治療開始前に妊孕性温存療法の情報が提供されるべきであり,ヘルスケアプロバイダーは適応のある,また希望を有するAYA 世代がん患者に対して,24 時間以内に生殖医療を専門とする医療機関を紹介すべきである」としている9)。
近年,若年がん患者に対する妊孕性温存に関する指針が示されているが,治療開始前に妊孕性温存に関する情報が伝えられていない若年がん患者が多く存在している4, 10)。その理由として,①がん治療医の妊孕性温存に関する情報を伝える時間不足,②がん治療医の妊孕性温存療法に関する知識不足,③がん治療医が若年がん患者に対して妊孕性やセクシュアリティに関する情報の提供を好まないこと,④患者の年齢やパートナーの有無,⑤がん治療医による妊孕性温存に関する情報の獲得方法が困難であり,がん治療医ががん治療開始の遅延や患者に不安を与える会話を好まないこと,⑥患者の予後が不良であること,などが挙げられる4, 10, 11)。アイルランドの94 名のがん治療医(臨床腫瘍医28 名,血液腫瘍医32 名,乳腺治療医34 名)を対象にした若年がん患者に対する妊孕性温存療法に関する意識調査によると,がん治療医の生殖補助医療の成功率など生殖医療に関する知識不足が明らかになった12)。62%のがん治療医が若年がん患者に対する妊孕性温存に関するガイドラインや指針の存在を知っており,日常的に82%のがん治療医が男性がん患者に対して精子凍結を勧めていた。一方女性がん患者に対しては,がん治療医の84%が治療開始前に妊孕性温存に関して患者と話し合っていたが,20%のがん治療医はがん治療開始前の妊孕性温存療法によるがん治療開始の遅れを懸念していた。本意識調査の結果,がん治療医による患者に対する妊孕性温存に関する情報不足の理由は,①がん治療の遅れの懸念,②予後不良であるため,③疾患の現状から(例:ホルモン受容体陽性乳がん患者に対して)であった12)。また本邦からの報告によると,日本の乳がん専門医843 名に対する若年乳がん患者の妊孕性温存に関する意識調査の結果,①再発のリスク,②生殖医療を専門とする医師との医療連携不足,③がん治療開始までの時間不足が,若年乳がん患者に対する妊孕性温存に関する情報提供不足の大きな要因となっていた13)。
がん治療医を含むヘルスケアプロバイダーは,がん治療による妊孕性喪失のリスクに関する情報,患者の予後,がん治療開始の遅れによるリスク,将来の妊娠が及ぼすがん再発への影響,ホルモン操作によるがんそのものに与える影響などの情報を十分に検討した上で,治療法を選択すべきである3, 7)。しかしながら,まずはがん治療を優先とすべきであり,妊孕性温存に関する情報提供はがん治療の次に位置するものである4)。例えば,化学療法を延期してまで妊孕性温存療法を施行するなど,がん治療の効果に影響を与えるような妊孕性温存療法は回避すべきである6)。がん治療開始までの限られた時間の中で,若年がん患者が自己決定するために妊孕性温存に関する情報を得る最大限の機会を患者は得るべきであるが,がん治療のアウトカムに何ら悪影響を与えるべきではなく,同様にがん治療開始の遅延は避けるべきである14)。患者の自己決定の過程において,がん治療が何よりも最優先されるべきである15)。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- FertiPROTEKT network の指針
Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35 - ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility preservation in young women with breast cancer. J Assist Reprod Genet. 2012; 29: 469-72
- NCCN ガイドライン
Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines. J Natl Compr Canc Netw. 2014; 12: 21-32
引用文献
- 1)
- American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol. 2006; 24: 2917-31 (ガイドライン)
- 2)
- Trost LW, Brannigan RE. Oncofertility and the male cancer patient. Curr Treat Options Oncol. 2012; 13: 146-60 (レビュー)
- 3)
- Ethics Committee of American Society for Reproductive Medicine. Fertility preservation and reproduction in patients facing gonadotoxic therapies: a committee opinion. Fertil Steril. 2013; 100: 1224-31 (ガイドライン)
- 4)
- Linkeviciute A, Boniolo G, Chiavari L, et al. Fertility preservation in cancer patients: the global framework. Cancer Treat Rev. 2014; 40: 1019-27 (レビュー)
- 5)
- Anderson RA, Mitchell RT, Kelsey TW, et al. Cancer treatment and gonadal function: experimental and established strategies for fertility preservation in children and young adults. Lancet Diabetes Endocrinol. 2015; 3: 556-67 (レビュー)
- 6)
- von Wolff M, Montag M, Dittrich R, et al. Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35 (ガイドライン)
- 7)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 8)
- Coleman SL, Grothey A. Should oncologists routinely discuss fertility preservation with cancer patients of childbearing age? Mayo Clin Proc. 2011; 86: 6-7 (Ⅰ)
- 9)
- Adolescent and Young Adult Oncology, ver. 2 2014. Featured Updates to the NCCN Guidelines. J Natl Compr Canc Netw. 2014; 12: 21-32 (ガイドライン)
- 10)
- Johnson RH, Kroon L. Optimizing fertility preservation practices for adolescent and young adult cancer patients. J Natl Compr Canc Netw. 2013; 11: 71-7 (レビュー)
- 11)
- Salih SM, Elsarrag SZ, Prange E, et al. Evidence to incorporate inclusive reproductive health measures in guidelines for childhood and adolescent cancer survivors. J Pediatr Adolesc Gynecol. 2015; 28: 95-101 (Ⅳa)
- 12)
- Collins IM, Fay L, Kennedy MJ. Strategies for fertility preservation after chemotherapy: awareness among Irish cancer specialists. Ir Med J. 2011; 104: 6-9 (Ⅳa)
- 13)
- Shimizu C, Bando H, Kato T, et al. Physicians’ knowledge, attitude, and behavior regarding fertility issues for young breast cancer patients: a national survey for breast care specialists. Breast cancer. 2013; 20: 230-40 (Ⅳa)
- 14)
- Dursun P, Dogˇan NU, Ayhan A, et al. Oncofertility for gynecologic and non-gynecologic cancers: fertility sparing in young women of reproductive age. Crit Rev Oncol Hematol. 2014; 92: 258-67 (レビュー)
- 15)
- Furui T, Takenaka M, Makino H, et al. An evaluation of the Gifu Model in a trial for a new regional oncofertility network in Japan, focusing on its necessity and effects. Reprod Med Biol. 2016; 15: 107-13 (Ⅳa)
- CQ2
-
挙児希望を有する女性がん患者に対して,どのような生殖補助医療が勧められるか?
適応を慎重に判断し,安全性に配慮した手法で行われれば,以下が勧められる(ただし,健康保険の適用とはならない)。
- 推奨グレードB
-
- 1.パートナーがいる場合,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.パートナーがいない場合,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 2.パートナーの有無にかかわらず,卵巣組織凍結保存は研究段階であるものの,胚(受精卵)または未受精卵子凍結保存までの時間的猶予がない場合や思春期前など排卵誘発が困難な場合,施行可能な施設において考慮される。
背景・目的
不妊症患者に対する生殖補助医療(assisted reproductive technology:ART)は,今日では安全性・有効性がほぼ確立した技術であり,がん患者に対する妊孕性温存(がん・生殖医療)においても重要な技術の一つである。しかしながら,がん・生殖医療としてのART を施行する場合,至適な排卵誘発法や母児に及ぼす影響に関してはエビデンスが乏しく,倫理的・社会的問題に関する議論,症例の追跡・解析とともに,ガイドラインの策定が重要である。このため,今日用いられ得る各種のART に関して,卵巣組織の凍結を含めて推奨グレードを策定した。
解説
1.胚(受精卵)凍結
胚(受精卵)凍結はART において有効性・安全性がほぼ確立した技術であり,がん・生殖医療においても有効な手段の一つとして, 米国生殖医学会(American Society for Reproductive Medicine:ASRM)1),ASCO2),国際妊孕能温存学会(International Society for Fertility Preservation:ISFP)3)から推奨されている。既婚女性ばかりでなく,海外では未婚女性に対するドナー精子を用いた胚(受精卵)凍結も施行されている。理論上は凍結保存開始時の発育能を維持したまま半永久的に保存することが可能であるが,本邦では日本産科婦人科学会の見解4)に従い,被実施者夫婦の婚姻の継続期間であってかつ卵子を採取した女性の生殖年齢を超えないことが求められている。
近年の日本産科婦人科学会の統計5)によると,凍結胚1 個あたりの妊娠率は30〜35%である。また,最近のメタアナリシスでは,凍結していない胚(新鮮胚)よりも凍結胚の方が妊娠率が高いとされている6)。これは,新鮮胚は排卵誘発周期の子宮に移植することとなり,子宮内膜の着床能が低下するためと考えられている。単胎妊娠であっても,ART では自然妊娠より低出生体重児の出生率が高いが7, 8),凍結胚移植による妊娠では新鮮胚移植による妊娠よりも出生児体重が大きいことが報告されている7, 9)。現時点で明らかな有害性は報告されていないが,胚(受精卵)凍結が出生児に及ぼす影響について継続的な検証が不可欠である。
Oktay らは131 例の乳がん患者から採卵して胚(受精卵)凍結を施行し,そのうちの33 例に対して40 周期・81 個の融解胚移植を施行したところ,18 周期(移植あたり45.0%)で25 人の生児(受精卵あたり31.3%)が得られた。この胚移植あたりの生産率は,採卵時の年齢が同程度(35〜37 歳)の米国一般不妊症例の成績(38.2%)と同程度だった10)。同一施設からの報告では,基準を満たした337 例の乳がん患者において,妊孕性温存〔胚(受精卵)凍結または未受精卵子凍結〕を施行した120 例と妊孕性温存を施行しなかった217 例を比較したところ,再発率や生存率に有意差を認めなかった11)。
以上のように,がん・生殖医療としての胚(受精卵)凍結の有効性・安全性に関するエビデンスは非常に限られているため,現時点では一般不妊症例に対する成績を参照せざるを得ない。しかし,胚(受精卵)凍結の手法そのものの有効性・安全性は確立しているため,推奨グレードは「B」とした。
2.未受精卵子凍結
ASRM は未受精卵子凍結に関する論文を検討した結果,ガラス化凍結法により凍結融解した卵子の受精率・妊娠率が新鮮卵子と同等であること(後述),凍結融解卵子を用いたART で生まれた児に染色体異常・先天異常・発育障害が増大することはないため,もはや未受精卵子凍結保存は臨床研究ではなく,有効かつ安全な臨床技術であるとするガイドラインを発表した12)。またその中には,未受精卵子凍結保存ががん・生殖医療の有効な手段であり,適切なカウンセリングのもとに進められるべきであるとも記載された。ドイツ等3 カ国にある101 の施設からなるFertiPROTEKT というがん・生殖医療ネットワークでも,既に未受精卵子凍結の適応についてのガイドラインを策定しており13),英国国立医療技術評価機構(National Institute for Health and Clinical Excellence:NICE)も未受精卵子凍結を有用な生殖医療技術であるとする新しいガイドラインを公開している14)。本邦でも日本生殖医学会15)および日本産科婦人科学会16)から医学的適応による未受精卵子凍結・卵巣組織凍結のガイドラインが発表されている。
ガラス化凍結卵子と緩慢凍結卵子では,前者が有意に良好な成績である17)。ガラス化凍結卵子と新鮮卵子のART 成績を比較するランダム化比較試験(randomized controlled trial:RCT)では,最近のメタアナリシス18)と併せて,受精率・妊娠率はガラス化凍結卵子と新鮮卵子で同等であることが示唆され,融解卵子1 個あたりの妊娠率は4.5〜12%だった12)。新生児の検討でも,ガラス化凍結卵子と新鮮卵子で出生児体重や先天異常に差異を認めなかった19)。しかしながら,上記の報告で対象とされた卵子の大部分は,若年の卵子ドナーや卵巣予備能が良好な不妊症患者に由来するものであるため,全ての年齢層や不妊治療施設,さらにはがん・生殖医療にまで一般化できるか否かは,さらなる検討が必要である。
以上のように,未受精卵子凍結の手法そのものの有効性・安全性はほぼ確立しているが,がん・生殖医療としての未受精卵子凍結の有効性・安全性に関するエビデンスはほとんどないため,現時点では一般不妊症例に対する成績を参照せざるを得ない。このため,推奨グレードは「C1」とした。
パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。
3.卵巣組織凍結
胚(受精卵)や未受精卵子の凍結保存には排卵誘発剤による卵巣刺激がほぼ必須であり,これにより悪性腫瘍の治療が遅れることが懸念されること,多くても数個〜20 個程度の受精卵や卵子しか得られないことが問題である。一方,卵巣組織の凍結保存は,低侵襲な腹腔鏡下手術を用いて比較的早期に組織が採取できるとともに,思春期前の女児においても施行可能である。卵巣皮質に何千という卵母細胞を含むが,凍結・融解・移植などによる損失を未だ十分に克服できていない。
緩慢凍結法では,プログラムフリーザーを用いて緩徐に組織を凍結する。これまでに少なくとも60 例の妊娠・分娩例が報告されているが,ほとんどが緩慢凍結法による20)。一方,ガラス化凍結法はプログラムフリーザーを用いずに短時間で施行できるため,臨床応用とその普及には有用であり,受精卵および卵子の凍結保存では一般的な手法として確立されているが,ヒト卵巣組織への応用は遅れていた。最近,本邦でガラス化凍結法が発表され,組織採取から1 時間以内に手術室のベッドサイドでも凍結保存が可能なため,本邦を中心に普及しつつあり,早発卵巣機能不全患者から採取した卵巣の凍結・移植によって生児が得られている21)。
摘出した卵巣の利用方法として現時点で臨床応用されているのは自己移植のみであり,移植後の卵巣で卵胞発育が再開し,卵巣機能が回復するには通常4〜5 カ月を要する。同所性移植では残存卵巣断面あるいは卵巣が存在した近傍の後腹膜に組織片を移植し,異所性移植では腹直筋や前腕などに移植する。異所性移植は,移植手術や移植組織における悪性腫瘍再発時の摘出がより簡便であること,放射線照射等により同所性移植が困難な症例にも適用できることが利点である。これまで生児が得られているのは同所性移植によるものだけであったが,近年,異所性移植した卵巣組織に対するART によって生児が得られている22)。最近のレビューでは121 例の移植で35 人の生児が得られている(28.9%)23)。
卵巣組織の患者への自己移植では,移植する組織に腫瘍細胞が含まれている(minimal residual disease:MRD)可能性も指摘されている。エビデンスは未だ十分とは言えないが,これまでに腫瘍細胞の再移入による再発を認めた症例は報告されておらず,悪性腫瘍の種類や進行期を考慮すれば安全に施行できる可能性が高い。最近のレビュー24)では,ホジキンリンパ腫,非ホジキンリンパ腫,乳がんなどがヒト卵巣組織凍結保存の適応疾患になるとされている。凍結卵巣組織の融解・移植にあたっては,患者への十分な情報提供とともに,あらかじめ移植組織の一部を対象として,病理組織検査,免疫染色,(可能ならば)polymerase chain reaction(PCR)法で腫瘍細胞の有無を評価すべきであるが,現時点で最も有効な方法は異種移植による20 週間以上の観察と考えられている24)。
以上のように,がん・生殖医療としての卵巣組織凍結の有効性・安全性に関するエビデンスは非常に限られているため,推奨グレードは「C1」とした。
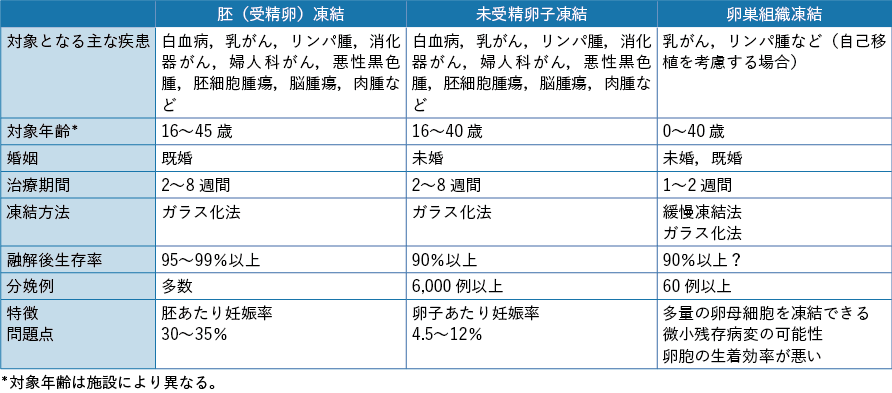
若年の女性がん患者の妊孕性温存には種々の方法があるが,現状ではそれぞれに一長一短がある(表2-3)。男性に対する精子凍結に比べれば身体の負担も大きく,妊孕性温存には限界があることも十分に説明し,個々の症例ごとに対応することが望ましいと考えられている。
4.化学療法終了後の妊娠可能時期および卵子・卵巣の採取可能時期
薬剤の胎児に対する催奇形性が問題となるのは,受精後2〜8 週(妊娠4〜10 週)の器官形成期であり,特に受精後3〜5 週(同5〜7 週)の感受性が高いとされる25)。化学療法終了後の妊娠可能時期に関するエビデンスは乏しいが,薬剤の代謝・排出を考慮した胎児への影響と終了直後の再発の可能性を勘案して,一般に4〜6 カ月間の避妊期間を設けることが推奨されている26)。
一方,シクロホスファミド投与後6 週のマウスを用いた体外受精では,受精率・胚発育率が有意に低下し,染色体異常胚の割合が有意に増加したと報告されている27)。一般にがんサバイバーの妊娠において児の先天異常が増えることはないとされているが,流早産や低出生体重児が増加するとの報告も散見される28)。化学療法終了直後に卵子や卵巣を採取することが児の予後に影響を及ぼすという根拠は乏しいが,実施にあたっては十分な説明と慎重な追跡・管理が必要である。
参考にした二次資料
- 1)
- Practice Committee of American Society for Reproductive Medicine. Ovarian tissue cryopreservation: a committee opinion. Fertil Steril. 2014; 101: 1237-43
- 2)
- Wallace WH, Kelsey TW, Anderson RA. Fertility preservation in pre-pubertal girls with cancer: the role of ovarian tissue cryopreservation. Fertil Steril. 2016; 105: 6-12
- 3)
- De Vos M, Smitz J, Woodruff TK. Fertility preservation in women with cancer. Lancet. 2014; 384: 1302-10
- 4)
- Tournaye H, Dohle GR, Barratt CL. Fertility preservation in men with cancer. Lancet. 2014; 384: 1295-301
- 5)
- Lambertini M, Del Mastro L, Pescio MC, et al. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Med. 2016; 14: 1
引用文献
- 1)
- Ethics Committee of American Society for Reproductive Medicine. Fertility preservation and reproduction in patients facing gonadotoxic therapies: a committee opinion. Fertil Steril. 2013; 100: 1224-31 (ガイドライン)
- 2)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 3)
- ISFP Practice Committee, Kim SS, Donnez J, et al. Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8 (ガイドライン)
- 4)
- 日本産科婦人科学会.ヒト胚および卵子の凍結保存と移植に関する見解.日産婦誌.2014; 66: 20 (ガイドライン)
- 5)
- 日本産科婦人科学会. 日本産科婦人科学会平成26 年度倫理委員会・登録・調査小委員会報告(2013 年分の体外受精・胚移植等の臨床実施成績および2015 年7 月における登録施設名).日産婦誌.2015; 67: 2077-121 (その他)
- 6)
- Roque M, Lattes K, Serra S, et al. Fresh embryo transfer versus frozen embryo transfer in in vitro fertilization cycles: a systematic review and meta-analysis. Fertil Steril. 2013; 99: 156-62 (Ⅰ)
- 7)
- Pinborg A, Wennerholm UB, Romundstad LB, et al. Why do singletons conceived after assisted reproduction technology have adverse perinatal outcome? Systematic review and meta-analysis. Hum Reprod Update. 2013; 19: 87-104 (Ⅰ)
- 8)
- Pandey S, Shetty A, Hamilton M, et al. Obstetric and perinatal outcomes in singleton pregnancies resulting from IVF/ICSI: a systematic review and meta-analysis. Hum Reprod Update. 2012; 18: 485-503 (Ⅰ)
- 9)
- Maheshwari A, Pandey S, Shetty A, et al. Obstetric and perinatal outcomes in singleton pregnancies resulting from the transfer of frozen thawed versus fresh embryos generated through in vitro fertilization treatment: a systematic review and meta-analysis. Fertil Steril. 2012; 98: 368-77. e1-9 (Ⅰ)
- 10)
- Oktay K, Turan V, Bedoschi G, et al. Fertility Preservation Success Subsequent to Concurrent Aromatase Inhibitor Treatment and Ovarian Stimulation in Women With Breast Cancer. J Clin Oncol. 2015; 33: 2424-9 (Ⅴ)
- 11)
- Kim J, Turan V, Oktay K. Long-Term Safety of Letrozone and Gonadotropin Stimulation for Fertility Preservation in Women with Breast Cancer. J Clin Endocrinol Metab. 2016; 101: 1364-71 (Ⅲ)
- 12)
- Practice Committees of American Society for Reproductive Medicine; Society for Assisted Reproductive Technology. Mature oocyte cryopreservation: a guideline. Fertil Steril. 2013; 99: 37-43 (ガイドライン)
- 13)
- von Wolff M, Montag M, Dittrich R, et al. Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35 (ガイドライン)
- 14)
- National Institute for Health and Clinical Excellence: Fertility-Assessment and treatment for people with fertility problems. 2013. http://www.nice.org.uk/guidance/cg156 (ガイドライン)
- 15)
- 日本生殖医学会. 医学的適応による未受精卵子あるいは卵巣組織の凍結・保存のガイドライン. 2013. http://www.jsrm.or. jp/guideline-statem/guideline_2013_01.pdf (ガイドライン)
- 16)
- 日本産科婦人科学会. 医学的適応による未受精卵子および卵巣組織の採取・凍結・保存に関する見解. 2014.
http://www.jsog.or.jp/ethic/mijyuseiranshi_20140417.html (ガイドライン) - 17)
- Glujovsky D, Riestra B, Sueldo C, et al. Vitrification versus slow freezing for women undergoing oocyte cryopreservation. Cochrane Database Syst Rev. 2014; 9: CD010047 (Ⅰ)
- 18)
- Cobo A, Diaz C. Clinical application of oocyte vitrification: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2011; 96: 277-85 (Ⅰ)
- 19)
- Cobo A, Serra V, Garrido N, et al. Obstetric and perinatal outcome of babies born from vitrified oocytes. Fertil Steril. 2014; 102: 1006-15. e4 (Ⅲ)
- 20)
- Donnez J, Dolmans MM. Ovarian cortex transplantation: 60 reported live births brings the success and worldwide expansion of the technique towards routine clinical practice. J Assist Reprod Genet. 2015; 32: 1167-70 (Ⅴ)
- 21)
- Suzuki N, Yoshioka N, Takae S, et al. Successful fertility preservation following ovarian tissue vitrification in patients with primary ovarian insufficiency. Hum Reprod. 2015; 30: 608-15 (Ⅴ)
- 22)
- Stern CJ, Gook D, Hale LG, et al. Delivery of twins following heterotopic grafting of frozen-thawed ovarian tissue. Hum Reprod. 2014; 29: 1828 (Ⅴ)
- 23)
- Stoop D, Cobo A, Silber S. Fertility preservation for age-related fertility decline. Lancet. 2014; 384: 1311-9 (Ⅴ)
- 24)
- Rosendahl M, Greve T, Andersen CY. The safety of transplanting cryopreserved ovarian tissue in cancer patients: a review of the literature. J Assist Reprod Genet. 2013; 30: 11-24 (Ⅴ)
- 25)
- Koren G, Carey N, Gagnon R, et al. Cancer chemotherapy and pregnancy. J Obstet Gynaecol Can. 2013; 35: 263-80 (ガイドライン)
- 26)
- Cardoso F, Loibl S, Pagani O, et al. The European Society of Breast Cancer Specialists recommendations for the management of young women with breast cancer. Eur J Cancer. 2012; 48: 3355-77 (ガイドライン)
- 27)
- Barekati Z, Gourabi H, Valojerdi MR, et al. Previous maternal chemotherapy by cyclophosphamide(Cp)causes numerical chromosome abnormalities in preimplantation mouse embryos. Reprod Toxicol. 2008; 26: 278-81 (Ⅴ)
- 28)
- Landa A, Kuller J, Rhee E. Perinatal Considerations in Women With Previous Diagnosis of Cancer. Obstet Gynecol Surv. 2015; 70: 765-72 (Ⅵ)
- CQ3
-
挙児希望を有する男性がん患者に対して,どのような生殖補助医療が勧められるか?
適応を慎重に判断し,安全性に配慮した手法で行われれば,以下が勧められる(ただし,健康保険の適用とはならない)。
がん治療前に説明を要する妊孕性温存療法
- 推奨グレードB
-
- 1.化学療法前には精子凍結保存が推奨される。
- 推奨グレードB
-
- 2.勃起射精障害が起こる可能性が高い手術の場合には,神経温存手術が推奨される。
がん治療後に説明を要する妊孕性温存療法
- 推奨グレードC1
-
- 1.化学療法後に無精子症となった場合には,精巣内精子採取術が考慮される。
- 推奨グレードB
-
- 2.下垂体性低ゴナドトロピン性性腺機能低下症となった場合には,ホルモン補充療法が推奨される。
背景・目的
不妊症患者に対する生殖補助医療(ART)は,今日では安全性・有効性がほぼ確立した技術であり,がん患者に対する妊孕性温存やがん治療後の挙児希望者への対応においても重要な技術の一つである。男性がん患者に対するがん治療が妊孕性障害を来す原因としては,化学療法による造精機能障害の他,視床下部-下垂体-性腺系内分泌障害に伴う造精機能障害・勃起射精障害,下腹神経叢を操作するような外科手術に伴う神経障害による勃起射精障害,精巣や前立腺を含む男性生殖器の摘出等が挙げられる。また,がん治療によって一時的に無精子症となった場合でも,将来的に自然に造精機能が回復し挙児に至る症例や精巣内精子採取術・体外受精によって挙児に至る症例も報告されている。今日用いられ得る各種の妊孕性温存療法に関して推奨グレードを策定した。
解説
本ガイドラインは小児,思春期・若年がん患者を対象としているが,男性の場合はパートナーである女性の年齢によっては40 歳以上でも妊孕性温存療法の説明を要する点に留意が必要である。以下,男性がん患者に対してがん治療開始前および終了後に説明する各種妊孕性温存療法について各々概説する(図2-3,図2-4 参照)。
がん治療開始前に説明を要する妊孕性温存療法
1.化学療法前精子凍結保存
不妊治療として精子凍結保存技術が開発され既に数十年経過しており,その有効性,安全性は確立されている。この技術は男性がん患者の妊孕性温存にも応用されてきた。化学療法や両側精巣摘除のようながん治療により無精子症となるリスクの高い男性がん患者が挙児希望を有する場合には,治療前精子凍結保存が推奨されている1, 2)。本邦では平成15 年に日本不妊学会(当時)が「医学的介入による造精機能低下の可能性のある男性の精子の凍結保存」と題した見解を発表しており,「悪性腫瘍の治療などによって造精機能の低下を来す可能性のある場合には,精子を凍結保存することができる」とした。平成18 年には日本生殖医学会が「精子の凍結保存について」と題し,同意書,凍結保存の期間,保存責任,費用負担に関して提言している。また,日本癌治療学会も日本産科婦人科学会および日本泌尿器科学会の了解のもと,平成16 年に悪性腫瘍治療前患者の配偶子凍結保存に関する倫理委員会の見解を発表している(日本癌治療学会ホームページ:http://www.jsco.or.jp/jpn/index/page/id/1356)。この中で,配偶子凍結保存にあたっては,腫瘍専門医は,生殖医療専門医に対して必要かつ十分な情報を提供すべきとしており,対象としては「凍結保存以外の医療行為によっては治療後の患者またはその配偶者に妊娠成立の見込みがないと判断されるもの」と定義している。
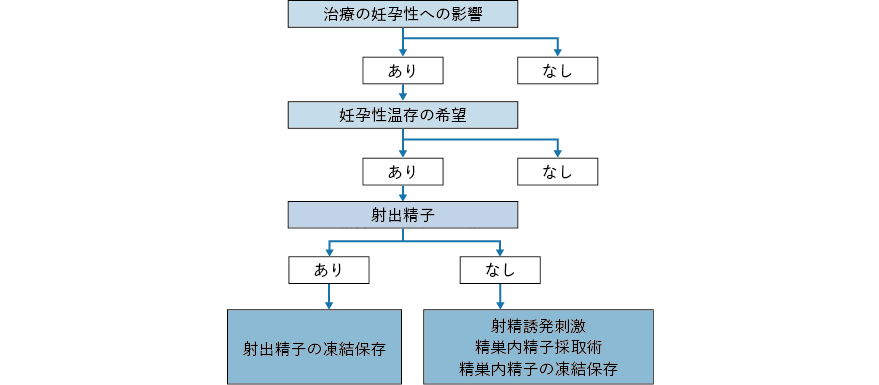
精子採取の方法は,マスターベーションによる精液採取が一般的であるが,がんに罹患しているだけで造精機能が低下していることが少なくない。マスターベーションによる精液採取ができない患者に対しては,逆行性射精の場合には膀胱内の精子を採取したり,振動刺激・電気刺激等による射精により精子を採取したりする方法もある。射出精液中に精子を認めない患者(無精子症)に対しては,精巣内精子採取術(oncological testicular sperm extraction:onco-TESE)によって精子を得られる場合があることが知られている(図2-3)。しかし,男性がん患者に対する精子凍結保存のための精子採取方法としては,本邦ではマスターベーションによる精液採取以外の方法は普及しておらず,各地域でどのような方法が可能かを把握しておくことが望まれる3)。
男性がん患者から採取された凍結精子の成績に関しては,30 報・11,798 症例のシステマティック・レビュー4)が報告されている。この報告では,精子利用率は8%(95% CI:8-9%)と低く,利用された精子による生児獲得率は49%(95% CI:44-53%)だった。精子凍結を施行した患者の中で生児を獲得した者は非常に少なかったが,破棄率が16%(95% CI:15-17%)と低く,観察期間と利用率に有意な正の相関があることから,利用率は今後高くなっていく可能性も指摘されている。凍結精子を用いた治療法としては,子宮内に精液を注入する人工授精(intrauterine insemination:IUI)や培養液中で卵子と精子を混合する体外受精(in vitro fertilization:IVF)よりも,卵子に精子を注入する顕微授精(intracytoplasmic sperm injection:ICSI)の方で生児獲得率が良好であるため5, 6),近年ではICSI を優先して施行する施設が多い。先述したシステマティック・レビューでは,先天異常発生率は4%(95% CI:1-11%)であり,一般集団と同等だった。以上のように,がん・生殖医療としての精子凍結の有効性・安全性に関するエビデンスはほぼ確立されている。一方で,化学療法開始後に採取された精子の安全性はまだ確立されておらず,化学療法開始後の男性に対して精子凍結保存を実施することの是非に関するコンセンサスは得られていない。
2.思春期前男児に対する治療前精巣凍結保存
思春期以降の男性では前述のように射出精子の凍結保存が既に確立されている。思春期前の男児においては精巣凍結が試みられているが,精巣組織内に精子(spermatozoa)や精子細胞(spermatid)が得られる一部の症例で生児が得られているに過ぎない。精子や精子細胞が得られない未熟精巣に対して精子を分化・誘導することを目的として様々な手法が試みられているが,これまでにヒトで有効な方法は確立されていない7, 8)。
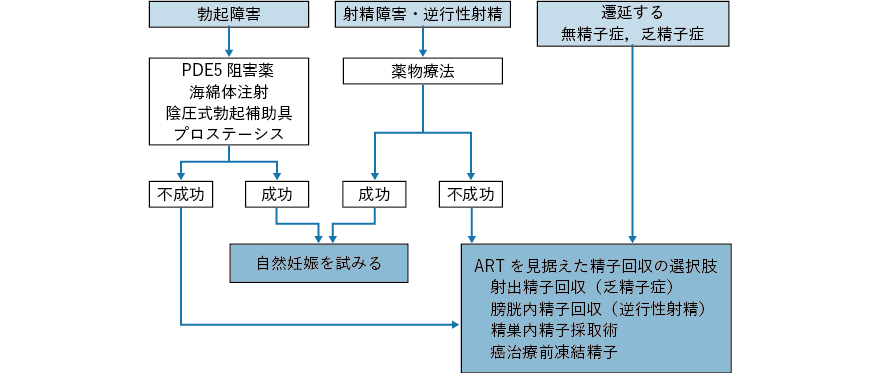
3.勃起射精障害に対する妊孕性温存療法
精巣がんでは後腹膜リンパ節郭清術後の逆行性射精,消化器がんでは大腸がん根治術での下腹神経叢障害による勃起射精障害が妊孕性の観点から重要である。これらの神経障害を回避するために,可能な場合は神経温存手術が施行される。一方で,手術の根治性の観点から,神経温存手術が適応できない場合もある。結果的に手術後に勃起射精障害となった場合には,精巣内精子採取術による精子の回収が可能な場合がある。また逆行性射精の場合は膀胱内から採取された精子を用いることが可能な場合がある9)。
がん治療終了後に説明を要する妊孕性温存療法
1.化学療法後無精子症に対する顕微鏡下精巣内精子採取術
化学療法後の造精機能障害のリスクは用いられた抗がん薬の種類や投与量によって異なる。また,造精機能障害を来しても時間経過により回復する場合も多い。したがって,男性がん患者が治療後に挙児希望を訴えた場合,まず精液検査を行うことが推奨される。小児がんのコホート研究では化学療法などで治療された患者が父親となった場合の児における先天異常のリスクの上昇は観察されていない10)。このため精液検査の所見に応じて,一般の不妊治療に準じた治療が経験的になされる。一方,無精子症が継続していた場合でも,顕微鏡下精巣内精子採取術にて精子採取が可能な場合が報告されている11)。精子採取の成功率は原疾患や治療内容により異なる。採取された精子は,挙児のためICSI に利用される。
2.低ゴナドトロピン性性腺機能低下症に対するホルモン補充療法
頭部への放射線照射による下垂体の機能障害では,性腺系内分泌障害に伴う造精機能障害が晩期合併症として起こり得る。思春期前の男性患者に対しては二次性徴を促すためホルモン補充療法としてテストステロンやhCG(human chorionic gonadotropin)が投与されるが,これらの方法では造精機能の獲得は困難である。将来的に挙児を希望する場合にはhCG/rFSH(recombinant follicle stimulating hormone)療法が推奨される12)。
3.勃起・射精障害に対する治療
勃起障害に対しては,PDE5 阻害薬を中心とする薬物療法の他に海綿体注射,陰圧式勃起補助具,プロステーシスなどの治療法がある(図2-4)13)。射精障害に対しては欧米のガイドラインでは交感神経賦活剤が記載されているが,有効性は限定的であり,本邦ではあまり普及していない。一方,逆行性射精に対しては本邦を中心にamoxapine(本邦未承認)などの三環系抗うつ薬の有効性を示唆する報告が散見される14)。ただし,交感神経賦活剤および三環系抗うつ薬ともに保険適用はない点に留意が必要である。
(Magelssen H, et al. Nat Clin Pract Urol. 2006; 3: 312-22 改変)
化学療法終了後の妊娠可能時期および凍結保存用の精子の採取可能時期
上述のように,男性の第一選択は精子凍結保存であり,妊孕性温存を希望する場合,病状が許せばできるだけ治療開始前に精子凍結保存を行うことが望ましい。しかし,病態によっては,治療開始前に精子凍結保存が実施できない場合がある。この場合には,できるだけ治療回数の少ない時期または高リスク治療開始前に再度精子凍結保存の適応を検討することが望ましい。ただし,化学療法開始後に採取された精子の安全性はまだ確立されておらず,化学療法開始後の男性に対して精子凍結保存を実施することの是非に関するコンセンサスは得られていないため,実施にあたっては十分な説明と慎重な追跡・管理が必要である。
胎児に対する催奇形性を有する薬剤を使用する場合,精液中に遺残した薬剤が性交渉によって妊娠初期女性の体内に遺残し,催奇形性をもたらす危険性がある。このため,催奇形性が証明されている薬剤を用いた臨床試験では,男性患者の場合,化学療法最終投与後から薬剤の半減期の5 倍の期間に3 カ月を上乗せした期間避妊することが推奨されている15, 16)。日常臨床の場では化学療法終了後の妊娠可能時期に関しては,男性患者の場合,一定期間の避妊を勧めることが望ましいが,期間に関しては明確な根拠となるエビデンスが乏しいのが現状である。
参考にした二次資料
- 1)
- Practice Committee of American Society for Reproductive Medicine. Ovarian tissue cryopreservation: a committee opinion. Fertil Steril. 2014; 101: 1237-43
- 2)
- Tournaye H, Dohle GR, Barratt CL. Fertility preservation in men with cancer. Lancet. 2014; 384: 1295-1301
- 3)
- Lambertini M, Del Mastro L, Pescio MC, et al. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Med. 2016; 14: 1
引用文献
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31 (ガイドライン)
- 2)
- Levine J, Canada A, Stern CJ. Fertility preservation in adolescents and young adults with cancer. J Clin Oncol. 2010; 28: 4831-41 (レビュー)
- 3)
- 西山博之,宗田武,市岡健太郎,他.長期精子凍結保存の実施状況に関する全国アンケート調査.泌尿器科紀要.2008; 54: 593-8 (Ⅳb)
- 4)
- Ferrari S, Paffoni A, Filippi F, et al. Sperm cryopreservation and reproductive outcome in male cancer patients: a systematic review. Reprod Biomed Online. 2016; 33: 29-38 (レビュー)
- 5)
- van Casteren NJ, van Santbrink EJ, van Inzen W, et al. Use rate and assisted reproduction technologies outcome of cryopreserved semen from 629 cancer patients. Fertil Steril. 2008; 90: 2245-50 (Ⅳa)
- 6)
- Agarwal A, Ranganathan P, Kattal N, et al. Fertility after cancer: a prospective review of assisted reproductive outcome with banked semen specimens. Fertil Steril. 2004; 81: 342-8 (Ⅳa)
- 7)
- 横西哲広,小川毅彦.精巣組織の凍結保存 小児がん患者の妊孕能保存の試み.日本小児泌尿器科学会雑誌.2015; 24: 4-8(レビュー)
- 8)
- Picton HM, Wyns C, Anderson RA, et al. A European perspective on testicular tissue cryopreservation for fertility preservation in prepubertal and adolescent boys. Hum Reprod. 2015; 30: 2463-75 (レビュー)
- 9)
- Saito K, Kinoshita Y, Yumura Y, et al. Successful pregnancy with sperm retrieved from the bladder after the introduction of a low-electrolyte solution for retrograde ejaculation. Fertil Steril. 1998; 69: 1149-51 (Ⅳb)
- 10)
- Chow EJ, Kamineni A, Daling JR, et al. Reproductive outcomes in male childhood cancer survivors: a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med. 2009; 163: 887-94 (Ⅳa)
- 11)
- Shin T, Kobayashi T, Shimomura Y, et al. Microdissection testicular sperm extraction in Japanese patients with persistent azoospermia after chemotherapy. Int J Clin Oncol. 2016; 21: 1167-71 (Ⅳa)
- 12)
- Rohayem J, Hauffa BP, Zacharin M, et al. Testicular growth and spermatogenesis: new goals for pubertal hormone replacement in boys with hypogonadotropic hypogonadism? -a multicentre prospective study of hCG/rFSH treatment outcomes during adolescence. Clin Endocrinol(Oxf). 2017; 86: 75-87 (Ⅳa)
- 13)
- 日本性機能学会 編.ED 診療ガイドライン2012 年版.リッチヒルメデイカル,東京,2012 (ガイドライン)
- 14)
- 天野俊康.射精障害と男性不妊症-特に腟内射精障害について-.泌尿器外科.2013; 26: 1357-62 (Ⅳb)
- 15)
- Stewart J, Breslin WJ, Beyer BK, et al. Birth Control in Clinical Trials: Industry Survey of Current Use Practices, Governance, and Monitoring. Ther Innov Regul Sci. 2016; 50: 155-68 (ガイドライン)
- 16)
- Assessment of Male-Mediated Developmental Risk for Pharmaceuticals Guidance for Industry. U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER).
http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/default.htm (Ⅴ)
- CQ4
- 遺伝性腫瘍患者に対して,どのような妊孕性に関連する情報を提供すべきか?
- 推奨グレードB
-
- 1.必要に応じて,遺伝カウンセリングや意思決定のための支援を受けられるように配慮する。
- 推奨グレードB
-
- 2.日本産科婦人科学会の見解では,遺伝性腫瘍は出生前診断や着床前診断の対象とならないことを伝える。
- 推奨グレードC1
-
- 3.特徴的な妊孕性低下のエビデンスは少ないことを伝える。
背景・目的
がん患者が妊孕性温存を希望した場合,特に若年発症やがん家族歴が濃厚な患者の場合には遺伝性腫瘍の可能性が高くなることから,遺伝性腫瘍の可能性の有無を確認しておく必要がある。そこで,遺伝性腫瘍に関連した妊孕性温存に関する情報について検索を行った。
解説
若年がん患者が妊孕性温存を希望した場合には,特に若年発症やがん家族歴が濃厚な患者の場合には遺伝性腫瘍の可能性が高く1),並行して遺伝性腫瘍かどうかの検索が必要である。例えば,比較的頻度の高い遺伝性乳癌卵巣癌(hereditary breast ovarian cancer:HBOC)症候群や遺伝性大腸がんの一つであるリンチ症候群の可能性がある場合など,遺伝カウンセリングや遺伝学的検査の対象であることを説明する必要がある。その際には,家族あるいは家系員への配慮が欠かせない。また,HBOC 症候群は乳がん卵巣がん以外にも膵臓がん,男性乳がん,前立腺がんも関連し,リンチ症候群関連がん*1 やリ・フラウメニ症候群関連がん*2 は,がんの原発部位が多岐にわたるため,拾い上げには注意が必要である(消化器CQ2 参照)。もし遺伝学的検査の結果によりこれらの疾患であることが判明した場合,常染色体優性遺伝の場合には子へ病的バリアントが受け継がれる確率は50%であることなど,病的バリアントが受け継がれた場合の児の将来のがんの易罹患性(それぞれの疾患でのがんの浸透率)などについて説明する必要がある。その際には遺伝カウンセリング実施可能部門や施設との連携が望ましい。日本医学会『医療における遺伝学的検査・診断に関するガイドライン』に準じて「必要に応じて専門家による遺伝カウンセリングや意思決定のための支援を受けられるように配慮する」ことが望ましい2)。
なお,妊孕性温存療法として生殖補助医療(ART)による胚(受精卵)凍結・未受精卵子凍結などが行われる場合がある。海外においては着床前診断の対象となっている地域(英国,米国の一部の州)があるが,現在の本邦においては,日本産科婦人科学会の見解として,このような遺伝性腫瘍では,着床前診断,出生前診断の対象とはなっていないことを説明する必要がある。
また,女性のHBOC 症候群患者においては,卵巣がんのリスクに対するリスク低減卵管卵巣摘出術(risk reducing salpingo-oophorectomy:RRSO)を実施可能な施設が増えてきているが,本邦では保険適用外である。生殖可能年齢の女性においては妊孕性温存のためRRSO を希望しない場合も多いと思われるが,卵巣がんリスクも保持することになることを説明することが必要である。またHBOC 症候群患者においては卵巣予備能(卵巣中の卵子数)が低いためにART の成績が不良となるという報告もあり3),見解も一定していない。
- *1:
- リンチ症候群関連がん:大腸がん,子宮内膜がん,胃がん,卵巣がん,膵がん,胆道がん,小腸がん,腎盂・尿管がん,脳腫瘍(通常はターコット症候群にみられるglioblastoma),ムア・トレ症候群の皮脂腺腫や角化棘細胞腫)
- *2:
- リ・フラウメニ(Li-Fraumeni)症候群関連がん:軟部組織肉腫,骨肉腫,閉経前乳がん,脳腫瘍,副腎皮質がん
参考にした二次資料
- 1)
- 日本医学会.医療における遺伝学的検査・診断に関するガイドライン2011 年2 月.日本医学会,東京,2011
- 2)
- 大腸癌研究会 編.遺伝性大腸癌診療ガイドライン2012 年版.金原出版,東京,2012
- 3)
- Gene reviews Japan. http://grj.umin.jp/
- 4)
- 日本産科婦人科学会.出生前に行われる遺伝学的検査および診断に関する見解.
http://www.jsog.or.jp/ethic/H25_6_shusseimae-idengakutekikensa.html - 5)
- 日本産科婦人科学会.着床前診断に関する見解.
http://www.jsog.or.jp/ethic/chakushouzen_20110226.html - 6)
- NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines?)“Genetic/Familial High-Risk Assessment: Breast and Ovarian”Version 1.2017, September 19, 2016. https://www.nccn.org/
日本語版2015 年 第2 版(乳がんおよび卵巣がんにおける遺伝学的/家族性リスク評価).
https://www2.tri-kobe.org/nccn/guideline/breast/index.html
引用文献
- 1)
- Mork ME, You YN, Ying J, et al. High Prevalence of Hereditary Cancer Syndromes in Adolescents and Young Adults With Colorectal Cancer. J Clin Oncol. 2015; 33: 3544-9 (Ⅳa)
- 2)
- 日本医学会.医療における遺伝学的検査・診断に関するガイドライン2011 年2 月.日本医学会,東京,2011(ガイドライン)
- 3)
- Shapira M, Raanani H, Meirow D. IVF for fertility preservation in breast cancer patients–efficacy and safety issues. J Assist Reprod Genet. 2015; 32: 1171-8 (レビュー)
女性生殖器
- 総説
婦人科悪性腫瘍は子宮頸がん,子宮体がん,卵巣腫瘍が代表的疾患である。なかでも40 歳以下でその頻度が高いのは子宮頸がんである。また子宮体がん,卵巣腫瘍は近年増加傾向にある。婦人科悪性腫瘍の治療の場合,その対象としている臓器が妊孕性そのものに影響を与えるため,治療が直接妊孕性喪失につながる可能性が高くなる。そのため,挙児希望がある場合には,より妊孕性に関する配慮が求められる。各がんにおける疫学,病態,治療法について概説する。
1.子宮頸がん
1-1.疫学
年齢調整罹患率は1980 年の15.3 人(人口10 万人あたり)をピークに減少し1999 年の7.0 を最下点としてその後は上昇傾向にある。2012 年には11.6 となっている1)。年齢別にみた子宮頸がん罹患率は,20 代後半から40 歳前後まで増加した後,横ばいになる。上皮内癌を含まない子宮頸がんの年齢階層別罹患率は,30 代は30 年間で2 倍以上に増加,20 代も微増している。近年,40 歳未満では,子宮頸がんは乳がんの次に罹患率が高い。

1-2.病態2)
子宮頸がんは,発生にヒトパピローマウイルス感染が重要な役割を担っている。近年の疫学的調査によると,扁平上皮癌80%,腺癌20%の割合となっていて,腺癌の比率が上昇している。定期的な子宮頸がん検診により異形成の段階で発見・治療することにより,がんの発症を未然に防ぐことができる。
1-3.治療3)
子宮頸部上皮内腫瘍(cervical intraepithelial neoplasia:CIN)3 または上皮内腺癌は,がんが粘膜層にとどまっている段階であり,子宮頸部円錐切除術で完治可能である(CQ2)。しかし,挙児希望がなければ子宮全摘出術を行うこともある。
ⅠA 期は程度が軽い場合は子宮頸部円錐切除術で子宮を残すことが可能であるが,子宮頸部円錐切除術で病変を取りきれない場合は単純子宮全摘出術を行う。また間質浸潤が深く,脈管侵襲があれば,子宮傍結合織とともに子宮を摘出する骨盤リンパ節郭清を含む広汎子宮全摘出術を行う。ⅠB 期以上の進行がんの場合は広汎子宮全摘出術の他,卵巣や卵管,骨盤リンパ節なども摘出する。Ⅲ期やⅣ期では同時化学放射線療法(concurrent chemoradiotherapy:CCRT)が行われている。
米国の子宮頸がんガイドラインでは,ⅠA2 期以上では(準広汎〜広汎)子宮摘出術または放射線単独療法,ⅠB2 期以上ではCCRT が推奨されている4)。またⅠB 期以下の浸潤がんの場合,妊孕性温存手術として子宮頸部摘出術が多くの施設で行われ,その有効性と安全性が確立しつつある(CQ1)。
2.子宮体がん
2-1.疫学1, 2)
欧米先進国では子宮がんのうち子宮体がん(内膜がん)の比率が高い。日本でも従来は子宮がんといえば子宮頸がんが大多数を占めていたが,食生活の高脂質・高蛋白化や少子化・初産年齢の上昇といった要因から,子宮体がん(内膜がん)の発生率が増加している。子宮体がんの年齢調整罹患率は1975 年に1.8 人(人口10 万人あたり)であったものが2012 年には12.1 人へ増加しており,子宮頸がんの罹患率に並んでいる。また注目すべきは,30 代前半でも近年罹患率が急激に増加していることである。

2-2.病態2)
子宮体部内膜に発生する子宮内膜がんと子宮体部肉腫がある。子宮内膜がんは,unopposed estrogen が原因のⅠ型と,エストロゲン曝露に無関係のⅡ型がある。Ⅰ型の比率が高く,中高年(50〜60 代で好発),初経が早い,閉経が遅い,出産歴がない,肥満そして糖尿病など,エストロゲンの影響が強い女性はよりリスクが高くなる。従来,子宮内膜異型増殖症は日産婦1995 分類により0 期として登録されてきたがFIGO2008 分類に従って0 期のカテゴリーは削除され,別に登録されることになった。子宮内膜異型増殖症からがんへの進展率は20%前後とするものが多い。
2-3.治療5)
病期や挙児希望の有無により異なるが,手術療法が基本となる。
病巣が子宮体部に限局しており挙児希望がない場合,子宮全体を摘出する〔単純(準広汎)子宮全摘出術〕。通常,卵管・卵巣も併せて摘出する(両側付属器摘出術)。骨盤内および腹部大動脈リンパ節郭清を行うこともある。術前にⅡ期と考えられる場合,子宮,卵巣,卵管のほか,周囲の組織も広い範囲で切除する(広汎子宮全摘出術)。Ⅰ・Ⅱ期でも再発リスクが高い場合,術後に化学療法または放射線治療を追加する。また術前にⅢ期以上と考えられる場合,手術可能な場合は単純子宮全摘出術+両側付属器摘出術+後腹膜リンパ節郭清を行い術後に化学療法や放射線治療を追加する。ⅣB 期で,遠隔転移がある場合は姑息的に手術する場合もあるが,緩和的な化学療法や放射線治療などが主体となる。
ごく早期(がんが子宮内膜にとどまる)かつ高分化型で挙児希望がある若年女性の場合,がん細胞の増殖や転移を抑える作用のある黄体ホルモン製剤を高用量で使用する(CQ3)。
3.卵巣腫瘍
3-1.疫学1, 2)
全国がん罹患モニタリング集計によれば,2012 年時点での年齢調整罹患率は8.3 人(人口10 万人あたり)と近年上昇傾向にある。しかし罹患率の上昇につながる確立したリスク因子は見出されていない。上皮性腫瘍は卵巣腫瘍の70〜80%を占めており,そのうちの悪性腫瘍(卵巣がん,組織型としては漿液性癌,明細胞癌,類内膜癌,粘液性癌など)は罹患率,死亡率とも上昇傾向にある。罹患率増加の最大の要因は排卵回数の増加にあると推定される。排卵時の卵巣表層上皮の破綻,炎症,修復は卵巣・卵管での発がんリスクを高める可能性があり,排卵回数が多い未婚者や妊娠・分娩回数の少ないもので罹患率が高く,経口避妊薬の内服は罹患率を下げるという報告もある。また類内膜癌や明細胞癌は子宮内膜症との関連性が指摘されており,子宮内膜症の増加がこれらの卵巣がんの増加を引き起こしている可能性がある。
*CQ 番号をクリックすると解説画面へ移動します。

3-2.病態2)
卵巣腫瘍は,卵巣に発生する腫瘍である。卵巣を構成する様々な細胞が存在するため,それぞれの構成成分を母地とする多種類の腫瘍が存在する。
卵巣腫瘍はその起源によって分類されることが多い。①卵巣を覆う表層上皮や卵巣間質が腫瘍化した場合は上皮性腫瘍,②卵胞または黄体に由来する場合は性索間質性腫瘍,③卵子に由来する場合は胚細胞腫瘍という。由来細胞を決定した後,良性腫瘍,境界悪性腫瘍,悪性腫瘍と悪性度を分類する。なお,境界悪性腫瘍は前がん状態ではなく低悪性度のがんである。胚細胞腫瘍も良性,境界悪性,悪性に区別され,悪性にはディスジャーミノーマ,卵黄囊腫瘍,未熟奇形腫などがある。全悪性卵巣腫瘍の5%にも満たない稀な腫瘍群であるが10〜20 代の若年層に好発することが特徴で,妊孕性温存が問題になってくる重要な疾患である。
3-3.治療6)
初回治療は外科的腫瘍切除で,卵巣がんの基本的な術式は以下のとおりである;両側付属器摘出術,子宮摘出術,大網切除術,骨盤・傍大動脈リンパ節郭清(または生検),腹腔細胞診。
悪性卵巣腫瘍の多くは診断時にⅢ期以上なので,腫瘍が残存する場合もある。残存腫瘍径が1cm 未満まで減量できると有意に予後が改善できるので,これをoptimal surgery と位置付け,可能な限り腫瘍を摘出する。術後化学療法を用いた集学的治療を行うのが標準である。
初回手術がoptimal surgery に達しなかった場合では,化学療法継続中に再度腫瘍減量術を行うこともある。卵巣上皮性悪性腫瘍の場合,妊孕性温存手術が可能なのは基本的に片側卵巣のみに限局するⅠ期のみである(CQ4)。境界悪性腫瘍,悪性胚細胞腫瘍,性索間質性腫瘍は卵巣がんに準じて手術を行う。ただしリンパ節郭清は省略可能である。
(WEBサイト上では2014年1月に一部修正あり)

引用文献
- 1)
- 国立がん研究センターがん対策情報センター.がん情報サービス.がん登録・統計.http://ganjoho.jp/reg_stat/index.html
- 2)
- DiSaia PJ, Creasman WT, Mannel RS, et al. Clinical Gynecologic Oncology. 8th ed. Elsevier, Amsterdam, 2012
- 3)
- 日本婦人科腫瘍学会 編.子宮頸癌治療ガイドライン2011 年版.金原出版,東京,2011
- 4)
- NCCN Clinical Practice Guidelines in Oncology, Version 1, 2016
- 5)
- 日本婦人科腫瘍学会 編.子宮体がん治療ガイドライン2013 年版.金原出版,東京,2013
- 6)
- 日本婦人科腫瘍学会 編.卵巣がん治療ガイドライン2015 年版.金原出版,東京,2015
- CQ1
- どのような子宮頸がん患者が妊孕性温存療法の適応となるか?
- 推奨グレードC1
-
- 1.扁平上皮癌と腺癌の患者が主な対象として考慮される。
- 推奨グレードC1
-
- 2.原則として子宮頸部にとどまる径2cm 以下の腫瘍の患者で考慮される。
背景・目的
近年の子宮頸がん罹患の若年化と晩婚・晩産化を背景に,妊孕性温存に配慮すべき若年子宮頸がん患者が増加してきている。日本産科婦人科学会婦人科腫瘍委員会報告(2014 年度患者年報)によると,ⅠA1〜ⅠB1 期の子宮頸がんで39 歳以下の患者数は1,105 人であり,同進行期全患者の33%を占めている1)。ここでは正確な病理診断と進行期診断がなされたことを前提に,子宮頸がん患者に対する妊孕性温存療法の適応を検討した。
なお,臨床進行期は『子宮頸癌取扱い規約 第3 版』2)に示された分類(日産婦2011,FIGO 2008)を用いている。
解説
基本的に妊孕性温存療法の主体は子宮頸部円錐切除術か子宮頸部摘出術の手術療法となる。円錐切除術のみで経過観察できる妊孕性温存の条件は次のCQ で詳述するため,ここでは広汎性子宮頸部摘出術(radical trachelectomy:RT)で妊孕性温存可能な適応に関して論じた。
1.組織型に関して
National Cancer Institute(NCI)ガイドライン3)がRT の対象として扁平上皮癌,腺癌(腺扁平上皮癌を含む)を挙げているように,腺癌もRT の適応としている報告は多い。ただし,腺癌ではRT 時の頸部切断面が陰性であっても,内頸側に病巣が存在するリスク(skip lesion の可能性)があることから慎重に適用すべきである。その他の組織型のRT に対する適格性に関して,National Comprehensive Cancer Network(NCCN)ガイドライン4)は「ⅠB1 期に対する妊孕性温存手術については,腫瘍径が2cm 以下の病変について最もよく妥当性が検証されている。小細胞神経内分泌腫瘍および最小偏倚腺癌は,この種の手術に適した腫瘍とはみなされない」と記載している。明細胞癌5),すりガラス細胞癌6-8),ブドウ状肉腫9)をRT の適応として含めた報告も散見されるが,現時点では,以上に述べたような高悪性度の特殊型は適応外とすべきであろう。
2.腫瘍径に関して
1986 年に腟式広汎性子宮頸部摘出術(vaginal RT:VRT)に腹腔鏡下骨盤リンパ節郭清術を組み合わせた術式が行われた。この報告10)がRT の適応基準のもととなったため,これまで1,000 例を超えるRT が報告されているが,その約8 割が主に腫瘍長径2cm 以下のⅠB 期症例を対象とするVRT である。VRT の基靭帯切除はPiver classⅡ相当のものが多いのに対し,1997 年に報告11)された腹式広汎性子宮頸部摘出術(abdominal RT:ART)はclassⅢ相当で切除するため,より大きな腫瘍を対象にすることが可能であると考えられてきた12)。実際,Bentivegna らの多数例のレビュー13)では2cm を超えるⅠB1 期症例に対するVRT の再発率が17%(14/84 例)であるのに対し,ART では7%(15/209 例)と低かった。Wethington らも,文献のレビューから2cm を超える147 例の報告をまとめ,VRT の再発率は16%(12/77)であるのに対しART の再発率は9%(6/69)と低いと報告した14)。Cao らのVRT 71 例とART 55 例を直接比較した多施設共同研究15)では,再発した7 例の全てがVRT 症例であり,再発率は腫瘍径2cm 以下の場合が4.2%であるのに対し,2cm 以上では21.7%と2cm 前後で差がみられた。
以上に述べたように,ART ではVRT より大きな腫瘍径の病巣を適応とできる可能性があるが,2cm を超える腫瘍に関しては個々の症例で慎重に適応を検討する必要があろう。
3.子宮外進展に関して
ⅡA1 期扁平上皮癌のうち,わずかな腟壁浸潤を要する症例にART が試みられる報告は多いが,リンパ節転移や子宮傍結合織浸潤を疑う症例はRT の適応とはなっていない。
術前のリンパ節転移診断はmagnetic resonance imaging(MRI)やcomputed tomography(CT)で行う施設が多いが,最近ではpositron emission tomography(PET)を用いた報告もみられる15, 16)。多くの施設は通常のリンパ節郭清を行い,術中迅速病理診断でリンパ節転移陽性の場合はRT の適応外として広汎子宮全摘出術に変更(コンバージョン)する方針だが,この判断にセンチネルリンパ節の術中生検を取り入れる施設もある15, 17)。
卵巣転移に関してはⅠB1 期までの扁平上皮癌でのリスクは低いが,腺癌症例で卵巣を温存することに関しては注意が必要であろう。26 文献の検討では,ⅠA 期腺癌155 例中,卵巣に転移を認めたものはなかった18)。3,741 例のⅠB・ⅡB 期手術症例の後方視的検討19)のうちⅠB 期症例の卵巣転移率は,扁平上皮癌の0.2%に対し腺癌は4%と高い傾向を示した。ただ,この中にはRT の適応外となるようなbulky な腺癌症例が含まれるため,RT 対象となる腺癌症例の卵巣転移率はもっと低いものと推察される。いずれにしろ,卵巣転移があればRT をコンバージョンするので,術前の画像検査や術中の観察で卵巣に腫瘍が認められる場合は,術中に迅速病理診断を行う必要がある。
4.年齢に関して
年齢に関しては上限を設けていない施設もあるが,40 歳14, 20)や45 歳9)以下に限定している報告が多く,NCI ガイドライン3)でも40 歳以下が適格基準とされている。生殖医療の進歩とともに変化しうる基準であるが,RT 後に妊娠が成立した場合,40 代では児染色体異常,妊娠高血圧症候群,妊娠糖尿病などの合併症が増すと考えられるため,患者説明時にはRT 後の妊娠管理の困難性に加えて,年齢に起因する妊娠・分娩のリスクを術前に十分説明する必要があろう。
参考にした二次資料
- NCCN Clinical Practice Guidelines in Oncology, Cervical Cancer, Version 1, 2016
- 日本婦人科腫瘍学会 編.子宮頸癌治療ガイドライン2011 年版.金原出版,東京,2011
引用文献
- 1)
- 日本産科婦人科学会婦人科腫瘍委員会報告.2010 年度患者年報.日産婦誌.2012; 64: 1029-141 (その他)
- 2)
- 日本産科婦人科学会,日本病理学会,日本医学放射線学会,日本放射線腫瘍学会 編.子宮頸癌取扱い規約.第3 版.金原出版,東京,2012 (その他)
- 3)
- Cervical Cancer Treatment(PDQⓇ)-Health Professional Version 2016 (ガイドライン)
- 4)
- NCCN Clinical Practice Guidelines in Oncology, Cervical Cancer, Version 1, 2016 (ガイドライン)
- 5)
- Wethington SL, Cibula D, Duska LR, et al. An international series on abdominal radical trachelectomy: 101 patients and 28 pregnancies. Int J Gynecol Cancer. 2012; 22: 1251-7 (Ⅴ)
- 6)
- Lintner B, Saso S, Tarnai L, et al. Use of abdominal radical trachelectomy to treat cervical cancer greater than 2 cm in diameter. Int J Gynecol Cancer. 2013; 23: 1065-70 (Ⅴ)
- 7)
- Saso S, Ghaem-Maghami S, Chatterjee J, et al. Abdominal radical trachelectomy in West London. BJOG. 2012; 119: 187-93 (Ⅴ)
- 8)
- Ungar L, Palfalvi L, Hogg R, et al. Abdominal radical trachelectomy: a fertility-preserving option for women with early cervical cancer. BJOG. 2005; 112: 366-9 (Ⅴ)
- 9)
- Li J, Li Z, Wang H, et al. Radical abdominal trachelectomy for cervical malignancies: surgical, oncological and fertility outcomes in 62 patients. Gynecol Oncol. 2011; 121: 565-70 (Ⅴ)
- 10)
- Dargent D, Martin X, Sacchetoni A, et al. Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. Cancer. 2000; 88: 1877-82 (Ⅴ)
- 11)
- Smith JR, Boyle DC, Corless DJ, et al. Abdominal radical trachelectomy: a new surgical technique for the conservative management of cervical carcinoma. Br J Obstet Gynaecol. 1997; 104: 1196-200 (Ⅴ)
- 12)
- Li J, Wu X, Li X, et al. Abdominal radical trachelectomy: Is it safe for IB1 cervical cancer with tumors>/=2 cm? Gynecol Oncol. 2013; 131: 87-92 (Ⅴ)
- 13)
- Bentivegna E, Gouy S, Maulard A, et al. Oncological outcomes after fertility-sparing surgery for cervical cancer: a systematic review. Lancet Oncol. 2016; 17: e240-53 (Ⅳb)
- 14)
- Wethington SL, Sonoda Y, Park KJ, et al. Expanding the indications for radical trachelectomy: a report on 29 patients with stage IB1 tumors measuring 2 to 4 centimeters. Int J Gynecol Cancer. 2013; 23: 1092-8 (Ⅴ)
- 15)
- Cao DY, Yang JX, Wu XH, et al. Comparisons of vaginal and abdominal radical trachelectomy for early-stage cervical cancer: preliminary results of a multi-center research in China. Br J Cancer. 2013; 109: 2778-82 (Ⅳb)
- 16)
- Maneo A, Chiari S, Bonazzi C, et al. Neoadjuvant chemotherapy and conservative surgery for stage IB1 cervical cancer. Gynecol Oncol. 2008; 111: 438-43 (Ⅴ)
- 17)
- Du XL, Sheng XG, Jiang T, et al. Sentinel lymph node biopsy as guidance for radical trachelectomy in young patients with early stage cervical cancer. BMC Cancer. 2011; 11: 157-63 (Ⅴ)
- 18)
- Ostor AG. Early invasive adenocarcinoma of the uterine cervix. lnt J Gynecol Pathol. 2000; 19: 29-38 (レビュー)
- 19)
- Shimada M, Kigawa J, Nishimura R, et al. Ovarian metastasis in carcinoma of the uterine cervix. Gynecol Oncol. 2006; 101: 234-7 (Ⅳb)
- 20)
- Tokunaga H, Watanabe Y, Niikura H, et al. Outcomes of abdominal radical trachelectomy: results of a multicenter prospective cohort study in a Tohoku Gynecologic Cancer Unit. Int J Clin Oncol. 2015; 20: 776-80 (Ⅳb)
- CQ2
- 子宮頸がんに対する妊孕性温存術式は?
- 推奨グレードC1
-
- 1.子宮頸部円錐切除術で脈管侵襲,両側切除断端,頸管内掻爬組織診の全てが陰性のⅠA1 期以下と確認されれば追加治療は不要である。
- 推奨グレードC1
-
- 2.間質浸潤の程度,脈管侵襲の有無,腫瘍径に応じて,準広汎子宮頸部摘出術+骨盤リンパ節郭清あるいは広汎性子宮頸部摘出術が考慮される。
背景・目的
子宮頸がん患者への妊孕性温存術式を進行期および組織型別に検討した。
解説
1.CIN 3
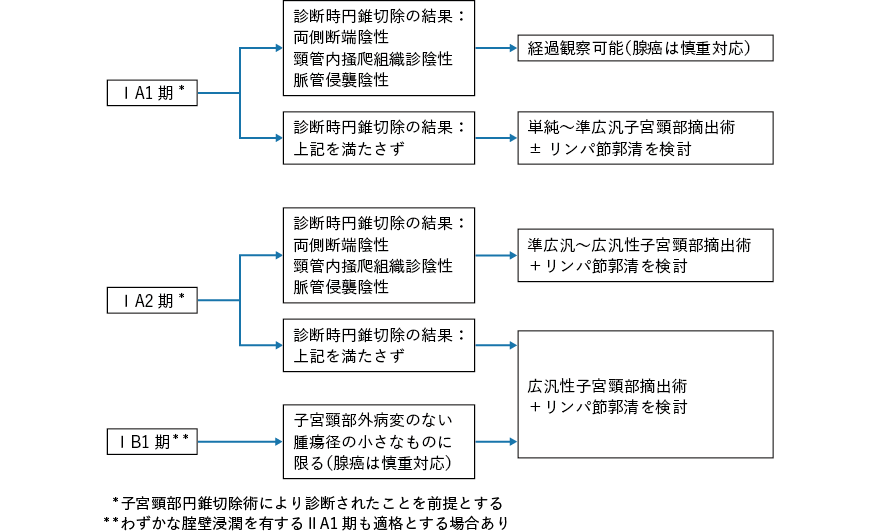
子宮頸部円錐切除術を行い,扁平上皮系のCIN 3 で両側断端が陰性と確認されれば,そのまま経過観察可能なので妊孕性は維持される。ただし,妊娠時の早産リスクは高まる1, 2)ので,円錐切除術を行う場合には,これらのリスクについて術前にインフォームドコンセントを得る必要がある。断端が陽性であれば再度の円錐切除術などの追加治療を検討する。コルポスコピーでCIN 3 相当の病変で,扁平上皮円柱上皮境界(squamo-columnar junction:SCJ)が全周性に視認される場合は,レーザー蒸散術や冷凍凝固療法も治療の選択肢に挙がる。しかし,微小浸潤がん以上の病変が隠れていることもあるので,術後の組織診が不可能なこれら温存療法の適用には注意を要する3, 4)。
上皮内腺癌(adenocarcinoma in situ:AIS)の場合にはskip lesion が存在し得るので,1,278 症例のメタアナリシスでは円錐切除術で両側断端が陰性でも約2 割の症例に病巣が残存し,3%の症例に再発を認めている5)。よって切除断端陰性でも単純子宮全摘出術が標準治療として推奨されるが,妊孕性温存の希望がある場合,円錐切除術時の頸管内掻爬組織診が陰性であれば6),再発のリスクを十分に説明の上,追加治療なく慎重に経過観察することも選択できる7)。
2.ⅠA1 期
扁平上皮系ⅠA1 期の場合,日本婦人科腫瘍学会『子宮頸癌治療ガイドライン2011 年版』8)では「妊孕性温存希望症例においては,脈管侵襲がなく切除断端陰性で,頸管内掻爬組織診陰性であれば円錐切除術のみで子宮温存が可能(推奨グレードB)」とされており,この条件を満たせば円錐切除のみで経過観察が可能である。脈管侵襲を認める症例に対しては「準広汎子宮全摘出術と骨盤リンパ節郭清を行う場合もある(推奨グレードC1)」とされているため,妊孕性温存を目的に子宮頸部摘出術を行う場合には準広汎以上の術式が考慮される。
ⅠA1 期腺癌(腺扁平上皮癌も含む)の場合,骨盤リンパ節への転移は極めて稀であり,標準治療をリンパ節郭清なしの単純子宮全摘出術あるいは円錐切除術とする意見9, 10)も少なくない。よって,妊孕性温存希望症例に対して『子宮頸癌治療ガイドライン2011 年版』8)では「症例を選択すれば円錐切除術で子宮温存も可能(推奨グレードC1)」としているが,腺癌病変はskip lesion を有し得るので慎重に適用すべきである。円錐切除術のみでは不十分と考えれば子宮頸部摘出術を提案することになるが,単純ないしは準広汎の術式(骨盤リンパ節郭清やセンチネルリンパ節生検などを併用)が試みられている。ちなみに,NCCN のガイドライン11)では,妊孕性温存術式に関して,扁平上皮癌と腺癌で区別をしていない。
3.ⅠA2 期
円錐切除術で微小浸潤扁平上皮癌ⅠA2 期と判明しても,両側断端,脈管侵襲,頸管内掻爬組織診の全てが陰性の場合,追加治療なく経過観察することを許容する報告もある12)が,その適用は極めて慎重でなければならない。『子宮頸癌治療ガイドライン2011 年版』8)では「骨盤リンパ節郭清を含む準広汎子宮全摘出術以上の手術が推奨(グレードC1)」されているが,子宮傍結合織への浸潤は非常に稀で,骨盤リンパ節転移も1 割以下である13)。よって,妊孕性温存を希望する患者に対しては,準広汎または広汎性子宮頸部摘出術を適用できる。NCCN のガイドライン11)でもⅠA2 期(腺癌との区別なし)の妊孕性温存療法としては,十分な断端陰性マージンをもった円錐切除術+リンパ節郭清の方針に加えて,円錐切除術を広汎性子宮頸部摘出術に置き換えたり,リンパ節郭清をセンチネルリンパ節の術中生検に置き換えるオプションが推奨されている。
ⅠA2 期腺癌に関しては,『子宮頸癌治療ガイドライン2011 年版』8)では標準治療を「骨盤リンパ節郭清を含めた準広汎子宮全摘出術以上の手術が望ましい(グレードC1)」とした上で,妊孕性温存の場合は広汎性子宮頸部摘出術の適用を考慮すると記載されている。文献レビューで,ⅠA2 期腺癌506 例の骨盤リンパ節転移率は1%と高くなく14),NCCN のガイドライン11)では扁平上皮癌と区別することなしに,センチネルリンパ節の術中生検もカテゴリー2B(やや低いレベルのエビデンスに基づく推奨で,NCCN 内のコンセンサスが統一されていないが,大きな意見の不一致はない)として推奨されている。
4.ⅠB1 期
比較的初期のⅠB1 期に対する妊孕性温存療法としては広汎性子宮頸部摘出術が主となるが,本邦の場合,腟式よりも腹式術式が全体の約3/4 と多く行われている15)。『子宮頸癌治療ガイドライン2011 年版』8)では「癌に対する根治性,術後管理,妊娠した場合の周産期管理などコンセンサスが得られていない面も多く,手術の適応については慎重な判断が必要である」と記載されており,現状では婦人科腫瘍専門医のみでなく生殖医療を専門とする医師,周産期専門医との緊密な連携が可能な病院で,また各医療圏別に少数の施設に集約化して行うべき治療法であると考えられる16)。
5.ⅡA1 期
わずかな腟壁浸潤のみで頸部病巣も比較的小さく浅い扁平上皮癌症例の場合に広汎性子宮頸部摘出術を試みた報告はあるが,それ以上の腟壁浸潤例や腺癌例に試みられた報告は稀である。
これまで述べてきたように,円錐切除術のみで経過観察ができない場合は子宮頸部摘出術による妊孕性温存を試みることになるが,術後の不妊傾向や妊娠中の流早産など,まだまだ解決すべき問題が山積している。正確な病理組織診断と進行期診断,患者と家族に対する十分なインフォームドコンセント,術後長期にわたる厳重な経過観察および妊娠・分娩に対する集学的医療などを要する,まだ発展段階の術式と考えられる。
参考にした二次資料
- NCCN Clinical Practice Guidelines in Oncology, Cervical Cancer, Version 1, 2016
- 日本婦人科腫瘍学会 編. 子宮頸癌治療ガイドライン2011 年版.金原出版,東京,2011
引用文献
- 1)
- Kyrgiou M, Kohpoulos G, Martin-Hirsch P, et al. Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions: systematic review and meta-analysis. Lancet. 2006; 367: 489-98 (Ⅳb)
- 2)
- Arbyn M, Kyrgiou M, Simoens C, et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia; meta-analysis. BMJ. 2008; 337: 1284 (Ⅳb)
- 3)
- Ueda M, Ueki K, Kanemura M, et al. Diagnostic and therapeutic laser conization for cervical intraepithelial neoplasia. Gynecol Oncol. 2006; 101: 143-6 (Ⅴ)
- 4)
- Yamaguchi H, Ueda M, Kanemura M, et al. Clinical efficacy of conservative laser therapy for early-stage cervical cancer. Int J Gynecol Cancer. 2007; 17: 455-9 (Ⅴ)
- 5)
- Salani R, Puri I, Bristow RE. Adenocarcinoma in situ of the uterine cervix: a metaanalysis of 1278 patients evaluating the predictive value of conization margin status. Am J Obstet Gynecol. 2009; 200: 182. e1-5 (Ⅳb)
- 6)
- Lea JS, Shin CH, Sheets EE, et al. Endocervical curettage at conization to predict residual cervical adenocarcinoma in situ. Gynecol Oncol. 2002; 87: 129-32 (Ⅴ)
- 7)
- Akiba Y, Kubushiro K, Fukuchi T, et al. Is laser conization adequate for therapeutic excision of adenocarcinoma in situ of the uterine cervix? J Obstet Gynecol Res. 2005; 31: 252-6 (Ⅴ)
- 8)
- 日本婦人科腫瘍学会 編.子宮頸癌治療ガイドライン2011 年版.金原出版,東京,2011 (ガイドライン)
- 9)
- Ceballos KM, Shaw D, Daya D. Microinvasive cervical adenocarcinoma(FIGO Stage 1A Tumors). Results of surgical staging and outcome analysis. Am J Surg Pathol. 2006; 30: 370-4 (Ⅴ)
- 10)
- Hirai Y, Takeshima N, Tate S, et al. Early invasive cervical adenocarcinoma: its potential for nodal metastasis or recurrence. Br J Obstet Gynecol. 2003; 110: 241-6 (Ⅴ)
- 11)
- NCCN Clinical Practice Guidelines in Oncology, Cervical Cancer, Version 1, 2016 (ガイドライン)
- 12)
- Milliken DA, Shepherd JH. Fertility preserving surgery for carcinoma of the cervix. Curr Opin Oncol. 2008; 20: 575-80 (レビュー)
- 13)
- van Meurs H, Visser O, Buist MR, et al. Frequency of pelvic lymph node metastases and parametrial involvement in stage IA2 cervical cancer: a population-based study and literature review. Int J Gynecol Cancer. 2009; 19: 21-6 (Ⅳb)
- 14)
- Bisseling KC, Bekkers RL, Rome RM, et al. Treatment of microinvasive adenocarcinoma of the uterine cervix: a retrospective study and review of the literature. Gynecol Oncol. 2007; 107: 424-30 (Ⅴ)
- 15)
- Sato S, Aoki D, Kobayashi H, et al. Questionnaire survey of the current status of radical trachelectomy in Japan. Int J Clin Oncol. 2011; 16: 141-4 (Ⅴ)
- 16)
- Kasuga Y, Nishio H, Miyakoshi K, et al. Pregnancy outcomes after abdominal radical trachelectomy for early-stage cervical cancer: A 13-year experience in a single tertiary-care center. Int J Gynecol Cancer. 2016; 26: 163-8 (Ⅴ)
- CQ3
- どのような子宮体がん患者が妊孕性温存療法(高用量黄体ホルモン療法)の適応となるか?
- 推奨グレードC1
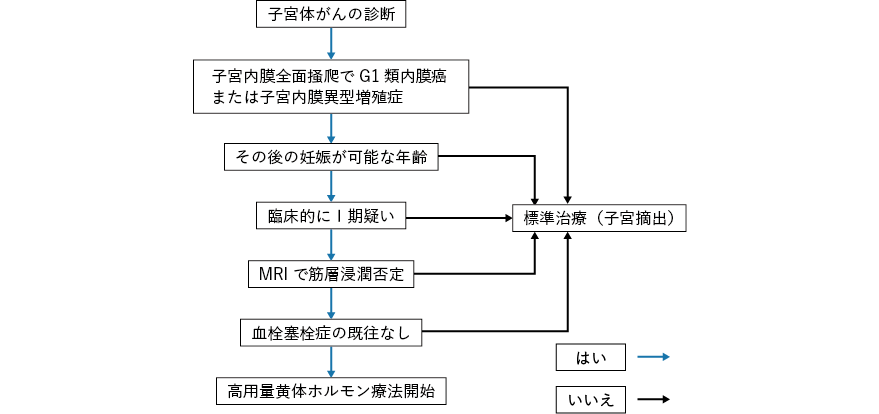
- 子宮内膜に限局していると判断される高分化型(G1)類内膜癌または子宮内膜異型増殖症の患者で考慮される。
背景・目的
本邦において,40 歳未満の若年子宮体がん患者は全体の5.1%であるが,本邦における子宮体がん症例の顕著な増加に伴い,若年子宮体がん患者数は確実に増加している。子宮体がんの標準治療は子宮摘出であるが,妊孕性温存療法が行われた症例も増加しており,その適応について現在のコンセンサスを調査する。
解説
高用量黄体ホルモンを用いた妊孕性温存療法について多くのcase series が報告されているが,その適応については多くの報告が推奨文の内容と一致している1-6)。1990〜2011 年の54 論文,34 研究からの559 症例のメタアナリシスでは,上記適応における妊孕性温存療法の病巣消失率は76.2%,再発率は40.6%とされている7)。2004〜2011 年の45 論文391 例のメタアナリシスでも77.7%の消失率でG1 腺癌での再発率は35.4%とされた3)。
投与薬剤の種類や用量に関してはメドロキシプロゲステロン酢酸エステル(medroxyprogesterone acetate:MPA)100〜800mg/日と報告によりばらつきがあるが,600mg/日の報告が大半を占めている1-7)。
腫瘍分化度(グレード)はホルモン療法の奏効率と深く関係しており,G1 症例は明らかにG3 症例よりもプロゲステロンに対する奏効率が高い8)。そのためグレードの判定は極めて重要な要素であるが,内膜生検による病理組織診断は必ずしも正確でなく,G2-G3 腺癌の混在や子宮内膜異型増殖症と腺癌の混在も認められる6, 9)。生検ではより高分化型に誤認されやすく10),内膜吸引組織診と全面掻爬では不一致率が20%に達する。よって温存療法症例の選択には,できるだけ材料が豊富な組織採取が得られる麻酔下の子宮内膜全面掻爬が必須であり,熟練した病理医により診断されるべきである11)。
体部筋層浸潤の否定にはdynamic study を併用したMRI が用いられる。しかしながら,MRI によっても診断の陰性的中率は60〜90%であり,完全に筋層浸潤が否定できるわけではない12, 13)。実際にMRI で筋層浸潤が否定されていた症例のうち子宮摘出された19 例中7 例に子宮摘出後にわずかな筋層浸潤が認められている6)。しかしながら,現時点では経腟超音波断層法やCT よりもはるかに有用である。
筋層浸潤のないG2, G3 症例に対する温存療法について,一時的な病巣消失率はG1 症例とほぼ同等と報告されているが,その報告例数は複数の論文を合わせても28 例に過ぎず,安全性は担保されていない9, 14-18)。一方,G1 で筋層1/2 以内の浅い浸潤を認める症例については,こちらも病巣消失率は筋層浸潤のない症例と同等であるが,やや再発率が高い。さらにG2, G3 例で1/2 以内の筋層浸潤を認める例では,わずか7 例の検討であり,一次消失率は同等でもさらに再発率が高い(71.4%)と報告されており,現状では勧められない18)。
年齢について上限を明確に定めた報告はわずかであるが,45 歳までを対象とした報告もわずかに認められる。より高齢の場合,その後の妊娠率は低く,成立までを勘案すると40 歳未満が望ましい19, 20)。本邦で子宮体がんに用いられるMPA の有害事象としての血栓塞栓症の発症が知られており,血栓塞栓症の既往例に対しての使用は禁忌である。より高齢者の進行再発例に対しての投与では5%に発症しているが8),妊孕性温存治療中の発症の報告は認められない。血栓塞栓症のリスク因子として,適格基準にbody mass index(BMI)の上限(BMI<25)を設けている報告があるが,明らかなエビデンスはなく,海外では特に制限はされていない6)。肥満は体がん発生のリスクと相関しているが,肥満患者と奏効率の相関については報告により結果が異なる。ただし,いずれも肥満症例に再発率が高く,より妊娠に至る可能性が低いとされている21, 22)。
高用量黄体ホルモンによる子宮体がんの妊孕性温存療法は,体がんに対する標準治療ではなく,温存治療完了後もその後の妊娠を約束するものではない。よって上記の適応に該当していても,患者の年齢や合併症などを総合的に判断して適応を決める必要がある。
参考にした二次資料
- NCCN. Endeometrial carcinoma, Ver.2 2016
- 日本婦人科腫瘍学会 編.子宮体がん治療ガイドライン2013 年版.金原出版,東京,2013
- 日本産科婦人科学会婦人科腫瘍委員会報告.2014 年患者年報
引用文献
- 1)
- Ramirez PT, Frumovitz M, Bodurka DC, et al. Hormone therapy for the management of grade 1 endometrial adenocarcinoma: a literature review. Gynecol Oncol. 2004; 95: 133-8 (レビュー)
- 2)
- Erkanli S, Ayhan A. Fertility-sparing therapy in young women with EC: 2010 update. Int J Gynecol Cancer. 2010; 20: 1170-87 (レビュー)
- 3)
- Gundelson CC, Fader AN, Carson KA, et al. Oncologic and reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 adencarcinoma: A systematic review. Gynecol Oncol. 2012; 125: 477-82 (Ⅳb)
- 4)
- Bovicelli A, D’Andrilli G, Giordano A, et al. Conservative treatment of early EC. J Cell Physiol. 2013; 228: 1154-8(レビュー)
- 5)
- Rodolakis A, Biliatis I, Moris P, et al. European Society of Gynecological Onclolgy task force for fertility preservation clinical recommendation for fertility-sparing management in young endometrial cancer patients. Int J Gynecol cancer. 2015; 25: 1258-65 (レビュー)
- 6)
- Ushijima K, Yahata H, Yoshikawa H, et al. Multicenter phase II study of fertility-sparing treatment with medrxypogesterone acetate for endometrial carcinoma and atypical hyperplasia in young women. J Clin Oncol. 2007; 25: 2798-803 (Ⅳa)
- 7)
- Gallos ID, Yap J, Rajkhowa M, et al. Regression, relapse, and live birth rates with fertility-sparing therapy for endometrial cancer and atypical complex endometrial hyperplasia : a systematic review and meta analysis. Am J Obstet Gynecol. 2012; 207: 266. e1-12 (Ⅳa)
- 8)
- Thigpen JT, Brady MF, Alvarez RE, et al. Oral medroxyptrogesterone acetate in the treatment of advanced or recurrent endometrial carcinoma: a dose-response study by the Gynecologic Oncology Group. J. Clin Oncol. 1999; 17: 1736-44 (Ⅱ)
- 9)
- Kaku T, Yoshikawa H, Tsuda H, et al. Conservative therapy for adenocarcinoma and atypical endometrial hyperplasia of the endometrium in young women: central pathologic review and treatment outcome. Cancer Lett. 2001; 167: 39-48 (Ⅳb)
- 10)
- Daniel AG, Peters WA 3rd. Accuracy of office and operating room curettage in the grading of endometrial carcinoma. Obstet Gynecol. 1988; 71: 612-4 (Ⅳb)
- 11)
- Leitao M, Kehoe S, Barakat R, et al. Comparison of D&C and office endometrial biopsy accuracy in patients with FIGO grade 1 endometirial adenocarcinoma. Gynecol Oncol. 2009; 113: 105-8 (Ⅳb)
- 12)
- Kinkel K, Kaji Y, Yu K, et al. Radiologic Staging in patients with endometrial cancer; A meta-analysis. Radiology. 1999; 212: 711-8 (Ⅲ)
- 13)
- Nakao Y, Yokoyama M, Iwasaka T, et al. MR imaging in endometrial carcinoma as a diagnostic tool for the absence of myometrial invasion. Gynecol Oncol. 2006; 102: 343-7 (Ⅳb)
- 14)
- Koskas M, Yazbeck C, Walker F, et al. Fertility-sparing management of grade2 and 3 endometrial adenocarcinomas. Anticancer Res. 2011; 31: 3047-9 (Ⅴ)
- 15)
- Gotlieb WH, Beiner ME, Shalmon B, et al. Outcome of fertility-sparing treatment with progestins in young patients with endometrial cancer. Obstet Gynecol. 2003; 102: 718-25 (Ⅴ)
- 16)
- Brown AJ, Westin SN, Broaddus RR, et al. Progestin intrauterine device in an adolescent with grade 2 endometrial cancer. Obstet Gynecol. 2012; 119: 423-6 (Ⅴ)
- 17)
- Imai M, Jobo T, Sato R, et al. Medroxyprogesterone acetae therapy for patients with adenocarcinoma of endometrium who wish to preserve the uterus-usefulness and limitations. Eur J Gynaecol Oncol. 2001; 22: 217-20(Ⅴ)
- 18)
- Park JY, Kim DY, Kim TJ, et al. Holmonal therapy for women with stage 1A endometrial cancer of all grades. Obstet Gynecol. 2013; 122: 7-14 (Ⅳb)
- 19)
- Koskas M, Uzan J, Luton D, et al. Prognostic factors of oncologic and reproductive outcomes in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma: systematic review and metaanalysis. Feritle Sterile. 2014; 101: 785-94 (Ⅳb)
- 20)
- Simpson AN, Feigenberg T, Clarke BA, et al. Fertility sparing treatment of complex atypical hyperplasia and low grade endometrial cancer using oral progestin. Gynecol Oncol. 2014; 133: 229-33 (Ⅳb)
- 21)
- Gonthier C, Walker F, Luton D, et al. Impact of obesity on the results of fertility-sparing management for atypical hyperplasia and grade1 endometrial cancer. Gynecol Oncol. 2014; 133: 33-9 (Ⅳa)
- 22)
- Park JY, Kim DY, Kim JH, et al. Long-term oncologic outcomes after fertility-sparing management using oral progestin for young women with endometrial cancer(KGOG 2002). Eur J Cancer. 2013; 49: 868-74 (Ⅳb)
- CQ4
- どのような卵巣悪性腫瘍患者が妊孕性温存療法の適応となるか?
- 推奨グレードC1
-
- 1.上皮性悪性腫瘍のⅠA 期およびⅠC 期(片側性)の非明細胞癌G1/2 とⅠA 期明細胞癌では考慮される。
- 推奨グレードC1
-
- 2.上皮性境界悪性腫瘍のⅠ〜Ⅲ期では考慮される。
- 推奨グレードB
-
- 3.胚細胞腫瘍ではⅠ〜Ⅳ期が推奨される。
- 推奨グレードC1
-
- 4.性索間質性腫瘍のⅠA 期では考慮される。
背景・目的
本邦における新規卵巣悪性腫瘍罹患者数は増加の一途をたどり,近い未来に10,000 人を突破する勢いである。一方,女性の晩婚化が進み,高齢出産が増えている。したがって,妊孕性温存を望む卵巣悪性腫瘍患者の増加が予測される。卵巣悪性腫瘍患者への妊孕性温存療法の適応を検討する。
解説
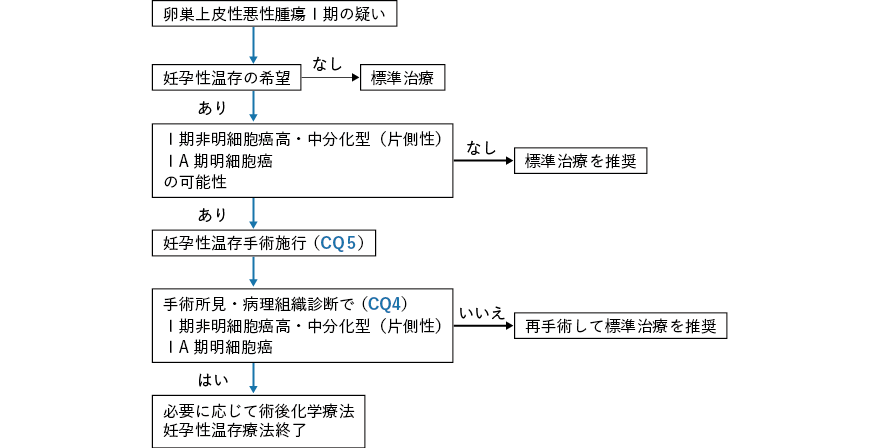
上皮性悪性腫瘍は卵巣悪性腫瘍の約90%を占め,一般にいうところの「卵巣がん」に相当する。Ⅰ期であればサブステージや組織学的分類(組織学的異型度を含む)を問わず妊孕性温存手術が推奨できるとする見解1, 2)と,Ⅰ期の中でもサブステージや組織学的分類を考慮すべきとの見解3-5)に大別される。前者は妊孕性温存手術の成績が標準手術を行った場合と同等であれば推奨する立場であり,後者は絶対的予後がある程度以上良好であるグループを推奨する立場である。非明細胞癌G3 の妊孕性温存手術の予後は標準手術が行われた患者に劣る可能性が指摘5, 6)されており,前者の立場でも現時点では推奨できない。明細胞癌ⅠC1 期に関しては,明細胞癌を含めたⅠA/ⅠB/ⅠC1 期に妊孕性温存手術を行った予後は標準手術を行った患者と同等とする報告5)もあり,妊孕性温存手術推奨の可否についての意見は分かれている。
上皮性境界悪性腫瘍では,Ⅰ〜Ⅲ期への妊孕性温存手術は標準手術に比し再発率は高いものの,再発に対する治療により生命予後は良好なため,妊孕性温存手術は許容されるとする報告7-9)がある。Ⅳ期はエビデンスとなる報告がない。
胚細胞腫瘍では,進行期や組織学的分類を問わず妊孕性温存手術が推奨できる報告が,主に後方視的ながら多数存在する10-12)。前方視的試験などの高いエビデンスはないが,各国・組織のガイドラインで記載が共通13-15)しており,推奨グレードをB とした。
性索間質性腫瘍では,妊孕性温存手術に関する報告は少ないが,Ⅰ期では妊孕性温存手術を行った5 年疾患特異的生存率が98%と子宮を摘出した場合の97%と同様に良好である16)ことから,Ⅰ期では推奨できる。ただし,セルトリ・ライディッヒ細胞腫では21 名(ⅠA 期G1:5 名,ⅠA 期G2:8 名,ⅠA 期G3:4 名,ⅠC 期G2:1 名,ⅡB 期G2:1 名,ⅢC 期G3:2 名)の対象のうち11 名が妊孕性温存手術を受け,4 名(ⅠA 期G1:1 名,ⅠA 期G2:3 名)が再発,2 名が腫瘍死している。一方で,ⅠA 期で非妊孕性温存手術を受けた患者には再発者はいない。セルトリ・ライディッヒ細胞腫の患者への妊孕性温存手術はより慎重に行う必要があるかもしれない17)。顆粒膜細胞腫はⅠ期が多く,妊孕性温存手術に関する解析対象もほぼ9 割がⅠ期18, 19)であるため,妊孕性温存手術がⅡ期以上にも推奨できるかは不明である。
なお,手術後の白金製剤を含む化学療法で5%の続発性無月経が生じたとする報告3)もあるが,いずれの患者に対しても,予後の悪化を防ぐため,根治術を行った場合と同様の基準で判断し,必要であれば標準化学療法を行うべきである。
参考にした二次資料
- NCCN. Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer, Ver.1 2016
- 日本婦人科腫瘍学会 編.卵巣がん治療ガイドライン2015 年版.金原出版,東京,2015
引用文献
- 1)
- Fruscio R, Corso S, Ceppi L, et al. Conservative management of early-stage epithelial ovarian cancer: results of a large retrospective series. Ann Oncol. 2013; 24: 138-44 (Ⅳb)
- 2)
- Zapardiel I, Diestro MD, Aletti G. Conservative treatment of early stage ovarian cancer: oncological and fertility outcomes. Eur J Surg Oncol. 2014; 40: 387-93 (レビュー)
- 3)
- Satoh T, Hatae M, Watanabe Y, et al. Outcomes of fertility-sparing surgery for stage I epithelial ovarian cancer: a proposal for patient selection. J Clin Oncol. 2010; 28: 1727-32 (Ⅳb)
- 4)
- Nam JH, Park JY. Fertility-sparing surgery for young women with early-stage epithelial ovarian cancer. Gynecol Obstet Invest. 2013; 76: 14-24 (レビュー)
- 5)
- Kajiyama H, Shibata K, Mizuno M, et al. Long-term survival of young women receiving fertility-sparing surgery for ovarian cancer in comparison with those undergoing radical surgery. Br J Cancer. 2011; 105: 1288-94 (Ⅳb)
- 6)
- Satoh T, Yoshikawa H. Fertility-sparing surgery for early stage epithelial ovarian cancer. Jpn J Clin Oncol. 2016; 46: 703-10 (レビュー)
- 7)
- Vasconcelos I, de Sousa Mendes M. Conservative surgery in ovarian borderline tumours: a meta-analysis with emphasis on recurrence risk. Eur J Cancer. 2015; 51: 620-31 (レビュー)
- 8)
- Viganò R, Petrone M, Pella F, et al. Surgery in advanced borderline tumors. Fertil Steril. 2010; 94: 1163-5 (Ⅳb)
- 9)
- Uzan C, Kane A, Rey A, et al. Outcomes after conservative treatment of advanced-stage serous borderline tumors of the ovary. Ann Oncol. 2010; 21: 55-60 (Ⅴ)
- 10)
- Ertas IE, Taskin S, Goklu R, et al. Long-term oncological and reproductive outcomes of fertility-sparing cytoreductive surgery in females aged 25 years and younger with malignant ovarian germ cell tumors. J Obstet Gynaecol Res. 2014; 40: 797-805 (Ⅳb)
- 11)
- Chan JK, Tewari KS, Waller S, et al. The influence of conservative surgical practices for malignant ovarian germ cell tumors. J Surg Oncol. 2008; 98: 111-6 (Ⅳb)
- 12)
- Gershenson DM, Miller AM, Champion VL, et al. Reproductive and sexual function after platinum-based chemotherapy in long-term ovarian germ cell tumor survivors: a Gynecologic Oncology Group Study. J Clin Oncol. 2007; 25: 2792-7 (Ⅳb)
- 13)
- NCCN. Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer, Ver. 1 2016(ガイドライン)
- 14)
- Ovarian Germ Cell Tumors Treatment (PDQⓇ): Health Professional Version. 2016 (ガイドライン)
- 15)
- 日本婦人科腫瘍学会 編.卵巣がん治療ガイドライン2015 年版.金原出版,東京,2015 (ガイドライン)
- 16)
- Zhang M, Cheung MK, Shin JY, et al. Prognostic factors responsible for survival in sex cord stromal tumors of the ovary–an analysis of 376 women. Gynecol Oncol. 2007; 104: 396-400 (Ⅳb)
- 17)
- Sigismondi C, Gadducci A, Lorusso D, et al. Ovarian Sertoli-Leydig cell tumors. A retrospective MITO study. Gynecol Oncol. 2012; 125: 673-6 (Ⅴ)
- 18)
- Bryk S, Färkkilä A, Bützow R, et al. Clinical Characteristics and Survival of Patients With an Adult-Type Ovarian Granulosa Cell Tumor. A 56-Year Single-Center Experience. Int J Gynecol Cancer. 2015; 25: 33-41 (Ⅳb)
- 19)
- Chan JK, Zhang M, Kaleb V, et al. Prognostic factors responsible for survival in sex cord stromal tumors of the ovary-A multivariate analysis. Gynecol Oncol. 2005; 96: 204-9 (Ⅳb)
- CQ5
- 卵巣悪性腫瘍患者に対する妊孕性温存療法の術式は?
- 推奨グレードC1
-
- 1.上皮性悪性腫瘍では患側付属器摘出術+大網切除術+腹腔内細胞診+骨盤・傍大動脈リンパ節郭清(生検)±対側卵巣生検±腹腔内各所の生検が考慮される。
- 推奨グレードC1
-
- 2.上皮性境界悪性腫瘍では患側付属器摘出術+大網切除術+腹腔内細胞診+腹腔内精査が考慮される。
- 推奨グレードB
-
- 3.胚細胞腫瘍では患側付属器摘出術+大網切除術+腹腔内細胞診+腹腔内精査が推奨される。
- 推奨グレードC1
-
- 4.性索間質性腫瘍では患側付属器摘出術+大網切除術+腹腔内細胞診+腹腔内精査が考慮される。
背景・目的
卵巣悪性腫瘍患者への妊孕性温存療法の術式を検討する。
解説
全ての組織学的分類において妊孕性温存術式が標準術式と異なる点は,子宮と少なくとも片側の付属器(卵巣+卵管)を残すことである。
上皮性悪性腫瘍は卵巣悪性腫瘍の約90%を占め,一般にいうところの「卵巣がん」に相当する。Ⅰ期が対象であるため,大網切除術としては横行結腸下で切除する大網部分切除術が選択され,腹腔内各所の生検は疑わしい病変がある場合のみに行われる。pT1 での所属リンパ節転移割合は組織学的分類により異なる。粘液性癌で0〜4.2%1-5),漿液性癌で30%前後2-4)と報告されている。また,明細胞癌では数%から30%近くと報告によってばらつきが大きい2-5)。類内膜癌では0〜2.8%とされているものの報告数が少なく,信頼性の高いリンパ節転移割合の報告はない2-5)。このため,リンパ節転移の頻度が低いⅠ期の粘液性癌高分化型では術中の十分な触診ないしリンパ節生検にとどめることが許容される。その他の組織学的分類では一期的にリンパ節郭清や生検を実施するのが原則であるが,確信がもてない場合にはリンパ節郭清や生検は行わずに最終病理組織診断を待ち,卵巣がんであることを確認した後に二期的にリンパ節郭清や生検を行うことが考慮される。
上皮性境界悪性腫瘍では,Arbeitsgemeinschaft Gynäkologische Onkologie(AGO)による境界悪性腫瘍患者950 名を集めた大規模な後方視的調査研究6)では,40 歳未満の症例に対し骨盤リンパ節と傍大動脈リンパ節が検索された割合は17.5%と10.4%であった。このような術式で良好な生命予後を得ていることから,リンパ節については術前の画像診断や術中の触診で腫大リンパ節がある場合にのみ生検を行うことを推奨する。
胚細胞腫瘍では,後腹膜リンパ節郭清は予後に影響しない報告があり省略可能である7)。前方視的試験などの高いエビデンスはないが,各国・組織のガイドラインで記載が共通8-10)しており,推奨グレードをB とした。胚細胞腫瘍の予後因子に手術時の残存腫瘍の有無が報告されている11, 12)。また,BEP 療法(ブレオマイシン,エトポシド,シスプラチン)が著効するため,大量の残存腫瘍を残した場合,腫瘍崩壊症候群を発症する恐れがある13)。このため進行患者では,可及的速やかに化学療法を開始するため臓器損傷や合併切除は避けつつも,可能な範囲の腫瘍縮小を目指す。
性索間質性腫瘍では,顆粒膜細胞腫は後腹膜リンパ節転移率が0〜5.1%14-16)と低いことが知られており,後腹膜リンパ節郭清は省略可能である。セルトリ・ライディッヒ細胞腫では後腹膜リンパ節郭清について検討できる十分な報告はない。
参考にした二次資料
- NCCN. Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer, Ver.1 2016
- 日本婦人科腫瘍学会 編.卵巣がん治療ガイドライン2015 年版.金原出版,東京,2015
引用文献
- 1)
- Cho YH, Kim DY, Kim JH, et al. Is complete surgical staging necessary in patients with stage I mucinous epithelial ovarian cancer. Gynecol Oncol. 2006; 103: 878-82 (Ⅳb)
- 2)
- Baiocchi G, Raspagliesi F, Grosso G, et al. Early ovarian cancer: Is there a role for systematic pelvic and para-aoric lymphadenectomy? Int J Gynecol Cancer. 1998; 8: 103-8 (Ⅳb)
- 3)
- Morice P, Joulie F, Camatte S, et al. Lymph node involvement in epithelial ovarian cancer: Analysis of 276 pelvic and paraaortic lymphadenectomies and surgical implications. J Am Coll Surg. 2003; 197: 198-205 (Ⅳb)
- 4)
- Suzuki M, Ohwada M, Yamada T, et al. Lymph node metastasis in stage I epithelial ovarian cancer. Gynecol Oncol. 2000; 79: 305-8 (Ⅳb)
- 5)
- Negishi H. Takeda M, Fujimoto T, et al. Lymphatic mapping and sentinel node identification as related to the primary sites of lymph node metastasis in early stage ovarian cancer. Gynecol Oncol. 2004; 94: 161-6 (Ⅳb)
- 6)
- Trillsch F, Mahner S, Woelber L, et al. Age-dependent differences in borderline ovarian tumours(BOT)regarding clinical characteristics and outcome: Results from a subanalysis of the Arbeitsgemeinschaft Gynaekologische Onkologie(AGO)ROBOT Study. Ann Oncol. 2014; 25: 1320-7 (Ⅳb)
- 7)
- Mahdi H, Swensen RE, Hanna R, et al. Prognostic impact of lymphadenectomy in clinically early stage malignant germ cell tumour of the ovary. Br J Cancer. 2011; 105: 493-7 (Ⅳb)
- 8)
- NCCN. Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer, Ver. 1 2016(ガイドライン)
- 9)
- Ovarian Germ Cell Tumors Treatment (PDQⓇ): Health Professional Version. 2016 (ガイドライン)
- 10)
- 日本婦人科腫瘍学会 編.卵巣がん治療ガイドライン2015 年版.金原出版,東京,2015 (ガイドライン)
- 11)
- Gershenson DM. Management of ovarian germ cell tumors. J Clin Oncol. 2007; 25: 2938-43 (レビュー)
- 12)
- Satoh T, Aoki Y, Kasamatsu T, et al. Administration of standard-dose BEP regimen(bleomycin+etoposide+cisplatin)is essential for treatment of ovarian yolk sac tumour. Eur J Cancer. 2015; 51: 340-51 (Ⅳb)
- 13)
- Doi M, Okamoto Y, Yamauchi M, et al. Bleomycin-induced pulmonary fibrosis after tumor lysis syndrome in a case of advanced yolk sac tumor treated with bleomycin, etoposide and cisplatin(BEP)chemotherapy. Int J Clin Oncol. 2012; 17: 528-31 (Ⅴ)
- 14)
- Karalok A, Turan T, Ureyen I, et al. Prognostic Factors in Adult Granulosa Cell Tumor: A Long Follow-Up at a Single Center. Int J Gynecol Cancer. 2016; 26: 619-25 (Ⅳb)
- 15)
- Ertas IE, Gungorduk K, Taskin S, et al. Prognostic predictors and spread patterns in adult ovarian granulosa cell tumors: a multicenter long-term follow-up study of 108 patients. Int J Clin Oncol. 2014; 19: 912-20 (Ⅳb)
- 16)
- Park JY, Jin KL, Kim DY, et al. Surgical staging and adjuvant chemotherapy in the management of patients with adult granulosa cell tumors of the ovary. Gynecol Oncol. 2012; 125: 80-6 (Ⅳb)
- CQ6
- 妊孕性温存療法後の妊娠サポートはどうすべきか?
- 推奨グレードC1
-
- 1.子宮頸がんに対して妊孕性温存手術として広汎性子宮頸部摘出術を施行した患者に対する妊娠サポートは,人工授精あるいは体外受精が考慮される。
- 推奨グレードC1
-
- 2.子宮体がんの場合には,早期の妊娠成立を目指すため,人工授精あるいは体外受精が考慮される。
- 推奨グレードC1
-
- 3.卵巣がんの場合には,採卵によるがん組織の播種や転移のリスクなどについて十分な情報提供を行った上で体外受精が考慮される。
背景・目的
婦人科がんに対する妊孕性温存療法には手術療法および薬物療法があるが,対象としている臓器が妊孕性そのものに影響を与えるために多くの問題点を孕むことになる。具体的に言えば,「子宮頸がんに対する手術は子宮の構造自体を変えてしまうために生殖補助医療の介入が必要になるのではないか?」,あるいは「子宮体がんに対する薬物療法後には早期の妊娠を目指すために生殖補助医療の介入が必要になるのではないか?」といった疑問が生じる。これらの疑問に対する回答が不明瞭なままでは,妊孕性温存療法の意義自体が問われることになりかねない。本CQ では,これらの疑問に対して現在得られている知見に基づいて考察する。なお,本CQ でいう「妊娠サポート」とは,「セルフタイミングのように不妊治療前の段階から一般不妊治療,ART などの不妊治療を含む幅広い概念」と定義する。
解説
1. 円錐切除術後の患者への妊孕性温存後の妊娠サポートとして体外受精を積極的に施行することは適切であるか?
CIN に対して子宮頸部円錐切除術などの妊孕性温存療法が施行された症例に,体外受精を積極的に導入すべきであるかについては明確な見解はない。いくつかの報告例があるが1, 2),体外受精の有用性を強く支持するものではなく,基本的には年齢,卵管因子の有無,男性因子の有無,不妊期間などを考慮して診療方針を検討すべきである。
2.広汎性子宮頸部摘出術後の患者には体外受精の導入が勧められるか?
子宮頸がんに対して妊孕性温存療法として広汎性子宮頸部摘出術を施行した症例に,体外受精を積極的に行うべきかを明確にした報告はないが,人工授精あるいは体外受精での妊娠例の報告が多く,自然妊娠例の報告は少ない3, 4)。基本的には年齢,卵管因子の有無,男性因子の有無,不妊期間などを考慮し,十分なインフォームドコンセントのもとに人工授精あるいは体外受精を施行することが適切である。また,妊娠を許可できる時期としては術後3 カ月が妥当である3)。妊娠成立後は,ハイリスク妊娠であることを十分に認識して,感染予防のためPH など腟内環境をチェックしたり,仕事や性生活を含む生活環境を厳重に管理して周産期センターでの分娩を行うべきである3)。
3. 子宮体がん患者への妊孕性温存後の妊娠サポートとして体外受精を積極的に施行することは適切であるか?
子宮体がんに対するMPA 療法は高い寛解率が期待できるが,一方で寛解後も再発の危険性が高く,より迅速な妊娠成立が望まれる。そのためには,より高い妊娠率が期待される体外受精を導入することが生児獲得の可能性を高めると考えることもできるが,体外受精は年齢によっては成功率が決して高くないことも知られている。生殖医療に関する丁寧な情報提供のもとに方針を決定していく必要がある。子宮体がん患者に対する生殖補助医療(assisted reproductive technology:ART)施行状況について言及した報告はいくつかあり,Gallos らはメタ回帰分析でART 施行群の方がART 未施行群より有意に妊娠率が高いことを報告している5)。排卵誘発と子宮体がんの関連に言及する報告があるものの,排卵誘発そのものより不妊症であることがリスクを高めているのだろうと結論付けられている6)。また,排卵誘発と子宮体がん再発のリスクに関する報告はほとんどみられず,排卵誘発を行うことがリスクになる根拠はないと考えられる5-8)。以上のような観点より,早期の妊娠成立を目指す目的で患者への十分な情報提供のもとに体外受精を行うことを検討すべきである。
4.卵巣がん患者への妊孕性温存後の妊娠サポートとして体外受精を施行することは適切であるか?
卵巣がんに対して標準的治療に基づいた妊孕性温存療法を行った症例に,体外受精の施行を検討する際に,片側卵巣にがん病変があった場合,対側の卵巣で採卵を施行することはがん組織を穿破あるいは腟壁などに播種させる危険性がある点が懸念される。組織型によって温存卵巣でのがんの再発率には差を認めるものの,いずれにしても0%とはならない。温存した対側卵巣に対して採卵を施行したものもあるが,その予後については十分な検討はなされていなく,安全性を担保するに至っているとは言えない9-12)。したがって,温存した片側卵巣に対する採卵を推奨する明確なエビデンスがないことや,その潜在的リスクを患者に伝えた上で,慎重に診療方針を検討すべきであると考えられる。抗がん薬を使用した症例の治療開始時期に関しては明確な基準はないが,原始卵胞から排卵までの卵胞形成期間を考慮すれば,3 カ月ないし6 カ月の避妊後には妊娠を許可してよいと考えられる。
参考にした二次資料
日本婦人科腫瘍学会 編.子宮体がん治療ガイドライン2013 年版.金原出版,東京,2013
引用文献
- 1)
- Plante M, Roy M. Fertility-preserving options for cervical cancer. Oncology(Williston Park). 2006; 20: 479-88; discussion 491-3 (レビュー)
- 2)
- Fagotti A, Gagliardi ML, Moruzzi C, et al. Excisional cone as fertility-sparing treatment in early-stage cervical cancer. Fertil Steril. 2011; 95: 1109-12 (Ⅴ)
- 3)
- Speiser D, Kohler C, Schneider A, et al. Radical vaginal trachelectomy: a fertility-preserving procedure in early cervical cancer in young women. Dtsch Arztebl Int. 2013; 110: 289-95 (レビュー)
- 4)
- Tokunaga H, Watanabe Y, Niikura H, et al. Outcomes of abdominal radical trachelectomy: results of a multicenter prospective cohort study in a Tohoku Gynecologic Cancer Unit. Int J Clin Oncol. 2015; 20: 776-80 (Ⅳb)
- 5)
- Gallos ID, Yap J, Rajkhowa M, et al. Regression, relapse, and live birth rates with fertility-sparing therapy for endometrial cancer and atypical complex endometrial hyperplasia: a systematic review and metaanalysis. Obstet Gynecol. 2012; 207: 266. e1-12 (Ⅳa)
- 6)
- Sallam HN, Abdel-Bak, Sallam HN. Does ovulation induction increase the risk of gynecological cancer? FVV IN Obgyn. 2013; 5: 265-73 (レビュー)
- 7)
- Burke WM, Orr J, Leitao M, et al. Endometrial cancer: a review and current management strategies: part II. Gynecol Oncol. 2014; 134: 393-402 (レビュー)
- 8)
- Koskas M, Uzan J, Luton D, et al. Prognostic factors of oncologic and reproductive outcomes in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma: systematic review and metaanalysis. Feritle Sterile. 2014; 101: 785-94 (Ⅳb)
- 9)
- Morice P, Camatte S, El Hassan J, et al. Clinical outcomes and fertility after conservative treatment of ovarian borderline tumors. Fertil Steril. 2001; 75: 92-6 (Ⅳb)
- 10)
- Palomba S, Falbo A, Del Negro S, et al. Ultra-conservative fertility-sparing strategy for bilateral borderline ovarian tumours: an 11-year follow-up. Hum Reprod. 2010; 25: 1966-72 (Ⅱ)
- 11)
- Zhu HL, Wang Y, Li XP, et al. Gonadotropin-releasing hormone agonists cotreatment during chemotherapy in borderline ovarian tumor and ovarian cancer patients. Chin Med J(Engl). 2013; 126: 688-91 (Ⅱ)
- 12)
- du Bois A, Heitz F, Harter. Fertility-sparing surgery in ovarian cancer: a systematic review. Onkologie. 2013; 36: 436-43 (Ⅳb)
乳腺
- 総説
晩産化の影響もあり,乳がん診断時に挙児希望を有する若年患者は少なくない。早期発見の増加,薬物療法の治療成績の改善により,治療後の長期間の生存が期待できるようになってきたが,腫瘍のホルモン依存性,化学療法による卵巣機能低下,長期にわたるホルモン療法中の加齢が,乳がん患者の妊娠・分娩の障害となる。本項では,乳がん患者の妊娠や妊孕性温存を検討する際に,がん治療医および生殖医療を専門とする医師が留意すべきことを検討した(CQ1〜CQ5)。
1.疫学
本邦では,成人女性のがん罹患第1 位が乳がんであり,その罹患者数は年々増加し,2016 年には約9 万人の新規乳がん発症者があったと推測されている1)。日本乳癌学会の2014 年次登録データによれば,35 歳未満の若年者乳がんは全体の2.0%に過ぎないが,45 歳未満では全体の14.7%にのぼり2),年間1 万人を超える生殖可能年齢の乳がん患者が発症している。
2.病態
非浸潤性乳管がん(ductal carcinoma in situ:DCIS)などの非浸潤がん(Stage 0)は,原則的に局所治療のみで治癒可能である。乳房およびその領域リンパ節転移にとどまり,かつ根治手術が可能なStage Ⅰ〜ⅢA の乳がんでは,手術に加え,必要に応じて集学的治療を行うことにより根治を期待できる。病変が胸壁や皮膚に浸潤したStage ⅢB,同側の鎖骨上や胸骨傍のリンパ節領域への転移を認めるStage ⅢC の乳がんでは,初期薬物治療中の増悪や遠隔転移を認めない限りは集学的治療による根治を目指す。診断時に遠隔臓器転移を認めるStage Ⅳ乳がんや,遠隔転移再発を来した乳がんは,薬物療法の進歩により治療成績は改善しているものの,一般に根治を目指すのが困難である。比較的転移頻度の高い臓器としては,皮膚・軟部組織,骨,肺・胸膜,肝臓などが挙げられる。
3.治療・予後
乳がん治療のうち妊孕性に影響を及ぼすのは薬物療法である。乳がんの薬物療法は,病期,ホルモン受容体やHER2 などのバイオマーカーの発現,月経状況を考慮し推奨される。「標準治療」とは比較試験により無再発や生存における優越性を検証された治療であるが,乳がん治療においては薬物療法の効果は相対的なものとして捉えられている。薬物療法の治療方針決定においては,再発リスク,薬物療法の治療効果,薬物療法による有害事象等のデメリットを勘案し,患者への十分な情報提供を行った上で,患者と協働して治療方針を決定することが推奨されている(shared decision making)。
Stage Ⅰ,Stage Ⅱの場合,5 年生存率は90%を超え,多くの患者で過剰治療となっている可能性が懸念されている。Oncotype DX 3)などの多遺伝子アッセイが,再発予測や,化学療法の効果予測に有用であるというエビデンスが蓄積してきており,今後は薬物療法の個別化がさらに進むものと思われる。
*CQ 番号をクリックすると解説画面へ移動します。
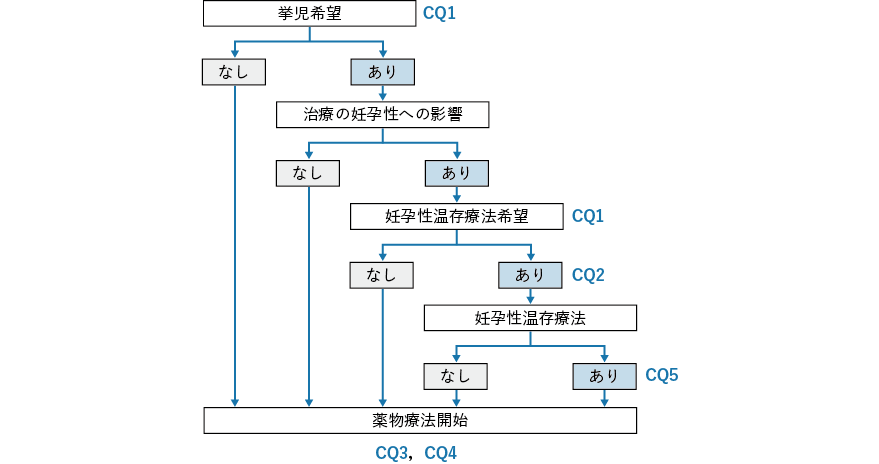
(WEB サイト上では2014 年1 月に一部修正あり)
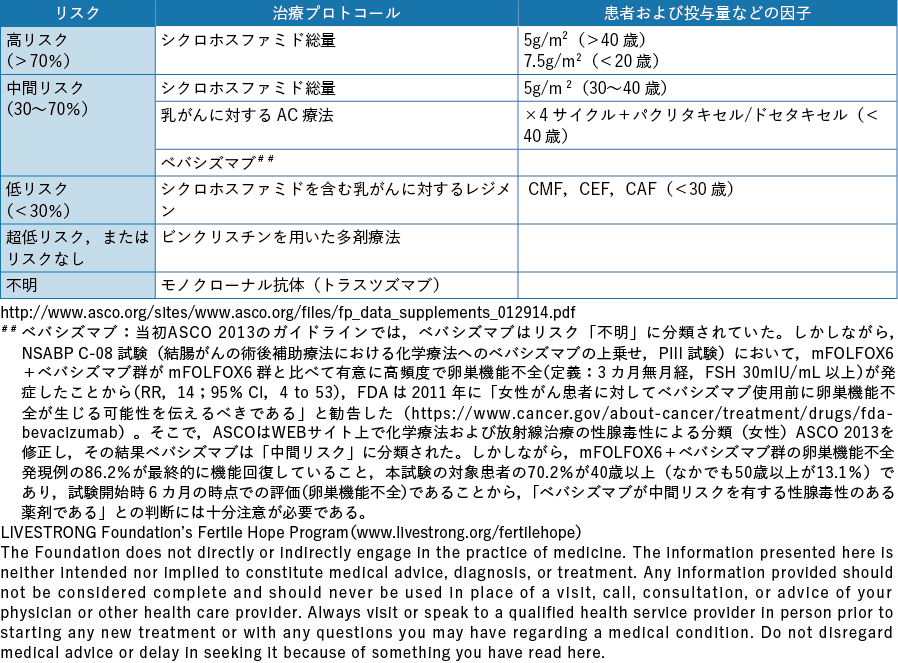
4.乳がん患者の妊孕性に関する問題点
生殖可能年齢の乳がん患者においては,手術の前後に施行される化学療法やホルモン療法により妊孕性の低下や喪失が危惧される。化学療法では,薬剤の種類により卵巣毒性が懸念される4)。ホルモン受容体陽性の乳がん患者の標準的な術後ホルモン療法の期間は5〜10 年間とされ,催奇形性などの理由からホルモン療法中の妊娠は禁忌である。そのため,タモキシフェンに代表されるホルモン治療薬では卵巣への直接的な毒性は少ないものの,年齢によってはホルモン治療を終える頃には自然妊娠が困難となる。さらに,ホルモン受容体陽性乳がんでは,妊娠や排卵誘発によるホルモン環境の変化が乳がんの予後に影響を与えることが懸念される。
そこで本項では,がん治療医と生殖医療を専門とする医師が,患者と妊娠または妊孕性温存について相談する際に,特に重要と考えられる5 つのCQ について検討した。まず,CQ1 では「どのような乳がん患者が妊孕性温存療法の適応となるか?」,乳がん術後の妊娠の安全性も含めて検討した。また妊孕性温存を行う場合には,採卵のための薬物治療開始の遅れが懸念される。CQ2 では「乳がん患者が妊孕性温存を希望した場合,化学療法開始遅延は容認されるか?」を検討した。CQ3「乳がん患者が妊娠を希望した場合,予後の観点からは,治療終了後いつから妊娠可能となるのか?」およびCQ4「乳がん患者が妊娠を希望した場合,催奇形性など薬物治療や放射線治療による安全性の観点からは,治療終了後いつから妊娠可能となるか?」では,妊娠・分娩が可能な時期についての検討を行った。最後にCQ5「挙児希望を有する乳がん患者に勧められる妊孕性温存療法にはどのようなものがあるか?」では,妊孕性温存療法の治療成績や実行可能性をもとに,乳がん患者に勧められる妊孕性温存療法を検討した。なお,乳がん患者の妊孕性温存,妊娠・分娩に関するより細かなCQ に関しては,日本がん・生殖医療学会 編『乳がん患者の妊娠・出産と生殖医療に関する診療の手引き2017 年版』に詳しい解説があるため,そちらを参照していただきたい5)。
乳がん患者の妊孕性温存療法に際しては,乳がんの診断から薬物療法開始までの限られた期間内に,インフォームドコンセント,妊孕性温存療法を行うか否かの決定と治療開始までを済ませる必要があり,診療科間の知識の共有,患者の個別の状況に関する情報共有,さらには多職種の密な連携が重要である。
引用文献
- 1)
- 国立がん研究センターがん対策情報センター.がん統計予測2016 年
- 2)
- 日本乳癌学会.全国乳癌患者登録調査報告2014
- 3)
- Paik S, Tang G, Shak S, et al. Gene expression and benefit of chemotherapy in women with node-negative, estrogen receptor-positive breast cancer. J Clin Oncol. 2006; 24: 3726-34
- 4)
- 化学療法および放射線療法の性腺毒性によるリスク分類(女性)ASCO 2013(日本がん・生殖医療学会WEB サイト参照)
- 5)
- 日本がん・生殖医療学会 編.乳がん患者の妊娠・出産と生殖医療に関する診療の手引き2017 年版.金原出版,東京,2017
- CQ1
- どのような乳がん患者が妊孕性温存療法の適応となるか?
- 推奨グレードC1
-
- 1.標準治療を行い長期予後が期待できるStage 0〜Ⅲの乳がん患者で考慮される。
- 推奨グレードD
-
- 2.遠隔転移を伴うStage Ⅳもしくは再発乳がん患者は適応とならない。
背景・目的
乳がんの治療は画一的ではなく,臨床病期(Stage),サブタイプ(Subtype)から再発リスク,治療効果(薬剤感受性),治療による有害事象を勘案して計画・実施されるが,原発性乳がんの約7 割はエストロゲン受容体陽性のホルモン感受性腫瘍であり,乳がん術後の妊娠や妊孕性温存によるホルモン環境の変化が乳がんの予後に与える影響が懸念される。そこで本CQ では,将来妊娠を希望する乳がん患者が,不十分な説明・情報提供により将来の妊娠を不必要にあきらめたり,逆に過度に期待したりすることがないよう,治療後の妊娠とそれを目指した妊孕性温存療法の適応について,それらが乳がんの予後に与える影響という観点から検討した。
解説
現在,乳がんの治療方針は大まかにStage とサブタイプによって決定される1)。乳がんは,非浸潤がんから浸潤がん,転移がんと進行し,そのStage に応じて局所治療(手術,放射線治療),全身薬物療法(化学療法,ホルモン療法,分子標的治療)が選択される。Stage は,国際規約であるTNM 分類を用いて表記する2)。
非浸潤がん(Stage 0)では,術後の薬物療法による全生存割合の改善効果はないため,術後ホルモン療法は必須ではなく3),術後ホルモン療法を行わない場合は,局所治療終了後の速やかな妊娠・分娩が可能である。一方,Stage Ⅳ乳がんもしくは遠隔転移を伴う再発乳がん患者においては,一般的には長期の予後は望めない。Stage Ⅳもしくは再発乳がん患者は継続的な薬物治療が必要となる場合が多く,妊娠企図から分娩までの十分な時間を確保することが困難なだけでなく,妊娠・分娩における母体の安全を保証できるものではないため,これらの患者では妊娠を勧められない。
Stage Ⅰ〜Ⅲの浸潤がんの場合には再発リスクに応じて術後または術前に全身薬物療法を併用する。現在,臨床的には,従来から薬剤感受性マーカーとして用いられてきたエストロゲンレセプター(estrogen receptor:ER),プロゲステロンレセプター(progesterone receptor:PgR),HER2,さらに増殖活性のマーカーであるKi-67 に対する免疫組織染色の結果をもとに,‘Luminal A-like’,‘Luminal B-like(HER2 negative)’,‘Luminal B-like(HER2 positive)’,‘HER2 positive(non-luminal)’,‘Triple negative(ductal)’ に分類される1)。
患者数の割合としては,ER(+)/HER2(-)のいわゆる‘Luminal type’が約7 割と多数を占めている。これらに対する術後補助薬物療法としては,ホルモン療法による再発抑制効果が証明されているが,化学療法の追加により予後改善効果を示す患者群もあり,どの症例に化学療法を実施するべきかは個別の検討を要する。HER2 陽性乳がんおよびTriple negative 乳がんでは化学療法や抗HER2 治療の実施が推奨される。標準的な術後補助薬物療法の実施は,必ずしも長期予後を保証するものではないが,患者が希望する場合,再発リスクに関する十分な情報提供のもと妊娠を勧めてもよいと考えられる。
乳がん治療後の妊娠が患者の予後にどのような影響を与えるかに関しては,複数の後方視的ケースコントロール研究,集団ベース研究の報告がある。Azim らは,それらのうち,質的に評価可能な14 の研究を抽出し,メタアナリシスを行った4)。乳がん治療後に妊娠した1,244 例と,妊娠をしなかった18,145 例を比較したところ,妊娠群で予後が改善していた [Pooled RR=0.59(90% CI:0.50-0.70)]。いわゆる,“healthy mother effect(再発がない,健康であると自覚している女性が妊娠・分娩し,疾患の影響を受けている女性は妊娠しない)”とよばれるセレクションバイアスが存在することを考慮し,ケースコントロール研究のサブグループで検討した結果では,妊娠群と非妊娠群との間で全生存期間に有意差を認めなかった [PRR=0.85(95% CI:0.53-1.35)]。さらに分娩に至らなかった妊娠(中絶を含む)と分娩症例の比較では,予後に差はなかった。また,乳がん術後の妊娠の予後への影響をホルモン受容体発現別に検討した多施設共同マッチドケースコントロール研究(n=1,207 うちホルモン受容体陽性患者は686 例)では,ホルモン受容体の陽陰性にかかわらず妊娠群と非妊娠群の生存期間には有意差を認めなかった5)。
以上より,現状で得られているエビデンスからは,乳がん治療後に妊娠した症例に対し,乳がん予後の悪化を理由に妊娠を避けるように勧めたり,中絶を勧めたりする積極的な根拠はない。しかし,これらの検討では転移乳がん患者は対象症例には含まれておらず, また自然妊娠か生殖補助医療(assisted reproductive technology:ART)を実施したものか,にも言及されていない点は留意すべきである。
次に,治療前の妊孕性温存療法に関する懸念は,妊孕性温存による化学療法などの治療開始の遅れ(CQ2 参照),長期のホルモン療法や加齢による妊娠・分娩の時期への影響(CQ4 参照),およびLuminal type の患者における排卵誘発等に伴うエストロゲン一過性上昇の影響である。
ホルモン受容体陽性乳がん患者への排卵誘発による乳がん予後に対する影響は明らかになっていない。Goldrat ら6)は,自然妊娠群(173 例)とART 実施群(25 例)を比較し,平均観察期間63 カ月と50 カ月で乳がんとしての予後に差がないことを報告しているが,本検討は少数例での後方視的な検討であること,ART 実施例の中には提供卵子によるART 実施例が含まれていること,手術からの観察期間が比較的短いことがあり,ART の実施が安全と結論することは困難である。
ART を受けた患者における乳がん発症リスクの上昇は否定的とする報告がある一方で,体外受精(in vitro fertilization:IVF)治療後1 年以内では乳がんリスクが一時的に上昇するとの報告がみられるなど一定ではない。エストロゲンの一過性上昇を緩和し,有効な排卵誘発を行うために,ゴナドトロピン製剤投与の際にアロマターゼ阻害薬を併用する試みもされている(CQ5 参照)。このように,ホルモン受容体陽性乳がん患者における卵巣刺激に関しては安全性に関する十分なエビデンスがないことに注意が必要であり,ホルモン受容体陽性例に対する妊孕性温存の実施には慎重であるべきである。特に,術前化学療法を予定している患者は,担がん状態での卵巣刺激の安全性のデータがなく,治療開始の遅れにもつながるため,妊孕性温存は勧められず,妊孕性温存を希望する場合には手術先行での治療戦略を検討すべきである。
以上,長期予後が期待できるStage 0〜Ⅲの術後乳がん患者については,術後の妊娠や,治療前の妊孕性温存療法を勧めてもよいと考える。しかし,妊孕性温存の安全性に関するエビデンスが得られていない患者群や治療があることに注意し,慎重に適応を検討する必要がある。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility preservation in young women with breast cancer. J Assist Reprod Genet. 2012; 29: 469-72
- 4)
- Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines
引用文献
- 1)
- Coates AS, Winer EP, Goldhirsch A, et al; Panel members. Tailoring therapies–improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol. 2015; 26: 1533-46 (レビュー)
- 2)
- 日本乳癌学会 編.臨床・病理 乳癌取扱い規約 第17 版.金原出版,東京,2012 (その他)
- 3)
- Wapnir IL, Dignam JJ, Fisher B, et al. Long-term outcomes of invasive ipsilateral breast tumor recurrences after lumpectomy in NSABP B-17 and B-24 randomized clinical trials for DCIS. J Natl Cancer Inst. 2011; 103: 478-88(Ⅱ)
- 4)
- Azim HA Jr, Santoro L, Pavlidis N, et al. Safety of pregnancy following breast cancer diagnosis: a meta-analysis of 14 studies. Eur J Cancer. 2011; 47: 74-83 (Ⅳb)
- 5)
- Azim HA, Kroman N, Paesmans M, et al. Prognostic Impact of Pregnancy After Breast Cancer According to Estrogen Receptor Status: A Multicenter Retrospective Study. J Clin Oncol 2013; 31: 73-79 (Ⅳb)
- 6)
- Goldrat O, Kroman N, Peccatori FA, et al. Pregnancy following breast cancer using assisted reproduction and its effect on long-term outcome. Eur J Cancer. 2015; 51: 1490-6 (Ⅳb)
- CQ2
- 乳がん患者が妊孕性温存を希望した場合,化学療法開始遅延は容認されるか?
- 推奨グレードC1
-
- 1.術後化学療法の場合,妊孕性温存に伴う治療開始遅延は術後12 週までは容認される。ただし,術後5 週を超える化学療法の遅延は予後に影響するという報告もあり,妊孕性温存を実施する場合には可及的速やかに実施すべきである。
- 推奨グレードC2
-
- 2.術前化学療法の場合,妊孕性温存に伴う治療開始遅延の安全性は検証されておらず,容認されない。予定された化学療法の開始が遅延せぬよう,妊孕性温存を実施する場合には可及的速やかに行う必要がある。
背景・目的
乳がん患者が妊孕性温存のために生殖補助医療(ART)を行う場合,排卵誘発や採卵のために化学療法開始の時期を遅らせる必要が生じることがある。そこで,治療開始の遅延がどこまで許容されるかに関して検討した。
解説
術後化学療法の主な目的は,微小転移を根絶し,予後を改善することにある。そのため理論上は,術後可及的早期に化学療法を開始すべきである。予後改善を目指した治療効果を損なうことなく,術後化学療法の開始をどの程度遅らせることが可能かに関しては明らかにされていない。その最大の理由は,術後化学療法の開始時期をランダム化比較した前方視的臨床試験が行われていないことにある。
これまでに,術後化学療法の開始時期と予後との関係は,後方視的研究1-11),あるいは前方視的コホート研究12)で探索されてきた。これらの研究では,化学療法開始時期が前もってランダム化されていないため,「化学療法が遅れて開始された」という事実の裏に,多くの交絡因子が存在することに留意すべきである。多くの研究で,既知の予後因子による補正が行われているが,交絡の影響を完全に排除できるわけではない。また,これらの研究は,若年者に限った検討ではないこと,タキサンを含む現在の標準的補助化学療法が行われる以前の研究がほとんどであることにも留意を要する。
過去の研究では,術後早期に補助化学療法が開始された群を対照群として,それを超過した群の無病生存,全生存に関するhazard ratio(HR)をもって,化学療法開始時期の予後への影響が検討されている1-4, 6, 7, 12)。これらのうち,1 つの前方視的コホート研究(n=229)では,対照群(35 日未満で化学療法開始)に比べて,遅延治療群(化学療法開始まで35 日以上)で全生存期間が有意に劣ることが示された12)。しかし,この研究結果はむしろ例外的で,その他の報告においては,術後12 週以内に化学療法を開始すれば,対照群に比べて予後が劣らなかった1-4, 6, 7)。一方,3 つの後方視的研究では,12 週を超えて化学療法を開始した群は,4 週以内に開始した群と比べて有意に全生存期間が劣っていたと報告されている3-5)。
システマティック・レビューにおいて,引用文献1〜6 と12 の研究が検討されている13)。この解析は,手術から化学療法までの期間と,全生存や無病生存におけるHR とは,後者を対数化するとリニアな関係にあるという推定に基づいて行われた。その結果,4 週間の術後化学療法の遅延により,全生存イベント,無病生存イベントのリスクがそれぞれ,1.15(95% CI:1.03-1.28)倍,1.16(95% CI:1.01-1.33)倍増加すると算出された。さらに,この研究の結果を用いると,8 週間の化学療法遅延により全生存イベント,すなわち死亡のリスクが32.25%(1.15×1.15=1.3225 倍)増加する計算になる。Yu らは,Early Breast Cancer Trialists’Collaborative Group(EBCTCG)レポートにおいて,術後補助化学療法による10 年間の乳がん死亡率の減少が36%であることに触れ14),化学療法は8 週以内の遅延に抑えることが妥当と主張している13)。
以上より,術後化学療法の遅延期間はでき得る限り短くすべきであり,可能であれば術後4 週以内,遅くとも8〜12 週以内の開始が妥当と考えられる。術後内分泌療法の開始遅延が予後に及ぼす影響については,質の高い研究はほとんど行われていないが,術後化学療法と同様,でき得る限り遅延期間を短くすべきと考えられる。
なお,術前化学療法を行う場合,その開始遅延に関する予後の検討は行われていないため,現時点でのエビデンスはない。しかし,術前化学療法を要する症例では,手術先行の症例すなわち術後化学療法を行う症例よりも再発リスクが高いことが多く,治療は術後化学療法症例よりさらに速やかに開始されるべきと考える。また,担がん状態(特にホルモン受容体陽性乳がんの場合)におけるART の安全性は検証されていない。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility preservation in young women with breast cancer. J Assist Reprod Genet. 2012; 29: 469-72
- 4)
- Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines
引用文献
- 1)
- Colleoni M, Bonetti M, Coates AS, et al. Early start of adjuvant chemotherapy may improve treatment outcome for premenopausal breast cancer patients with tumors not expressing estrogen receptors. The International Breast Cancer Study Group. J Clin Oncol. 2000; 18: 584-90 (Ⅳb)
- 2)
- Cold S, Düring M, Ewertz M, et al. Does timing of adjuvant chemotherapy influence the prognosis after early breast cancer? Results of the Danish Breast Cancer Cooperative Group(DBCG). Br J Cancer. 2005; 93: 627-32(Ⅳb)
- 3)
- Hershman DL, Wang X, McBride R, et al. Delay of adjuvant chemotherapy initiation following breast cancer surgery among elderly women. Breast Cancer Res Treat. 2006; 99: 313-21 (Ⅳb)
- 4)
- Lohrisch C, Paltiel C, Gelmon K, et al. Impact on survival of time from definitive surgery to initiation of adjuvant chemotherapy for early-stage breast cancer. J Clin Oncol. 2006; 24: 4888-94 (Ⅳb)
- 5)
- Nurgalieva ZZ, Franzini L, Morgan RO, et al. Impact of timing of adjuvant chemotherapy initiation and completion after surgery on racial disparities in survival among women with breast cancer. Med Oncol. 2013; 30: 419(Ⅳb)
- 6)
- Kerbrat P, Roche H, Fumoleau P, et al. Does time interval between surgery and adjuvant chemotherapy initiation modify treatment efficacy in operable, breast cancer patients? French Adjuvant Study Group (FASG)Results. J Clin Oncol. 2005; 23: 660 (Ⅳb)
- 7)
- Samur M, Bozcuk HS, Dalmez G, et al. Treatment delay in breast cancer; does it really have an impact on prognosis? Turk J Canc. 2002; 32: 138-47 (Ⅳb)
- 8)
- Shannon C, Ashley S, Smith IE. Does timing of adjuvant chemotherapy for early breast cancer influence survival? J Clin Oncol. 2003; 21: 3792-7 (Ⅳb)
- 9)
- Jara Sánchez C, Ruiz A, Martín M, et al. Influence of timing of initiation of adjuvant chemotherapy over survival in breast cancer: a negative outcome study by the Spanish Breast Cancer Research Group(GEICAM). Breast Cancer Res Treat. 2007; 101: 215-23 (Ⅳb)
- 10)
- Alkis N, Durnali AG, Arslan UY, et al. Optimal timing of adjuvant treatment in patients with early breast cancer. Med Oncol. 2011; 28: 1255-9 (Ⅳb)
- 11)
- Buzdar AU, Smith TL, Powell KC, et al. Effect of timing of initiation of adjuvant chemotherapy on disease-free survival in breast cancer. Breast Cancer Res Treat. 1982; 2: 163-9 (Ⅳb)
- 12)
- Pronzato P, Campora E, Amoroso D, et al. Impact of administration-related factors on outcome of adjuvant chemotherapy for primary breast cancer. Am J Clin Oncol. 1989; 12: 481-5 (Ⅳb)
- 13)
- Yu KD, Huang S, Zhang JX, et al. Association between delayed initiation of adjuvant CMF or anthracycline-based chemotherapy and survival in breast cancer: a systematic review and meta-analysis. BMC Cancer. 2013; 13: 240 (Ⅲ)
- 14)
- Early Breast Cancer Trialists’ Collaborative Group(EBCTCG), Peto R, Davies C, Godwin J, et al. Comparisons between different polychemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100,000 women in 123 randomised trials. Lancet. 2012; 379: 432-44 (Ⅰ)
- CQ3
- 乳がん患者が妊娠を希望した場合,予後の観点からは,治療終了後いつから妊娠可能となるのか?
- 推奨グレードC1
- 手術,放射線治療,化学療法やホルモン治療などの標準治療を完遂した患者では,妊娠が乳がんの予後に悪影響を与える可能性は少ないと考えられるため,妊娠を考慮してもよい。開始時期はサブタイプや再発リスクに基づき個別に判断される。
背景・目的
挙児希望を有するStage Ⅰ〜Ⅲの乳がん患者が乳がん治療終了後,どの時期から妊娠可能と判断するかは,①妊娠が再発等乳がんの予後に与える影響という観点と,②がん治療による催奇形性などの安全性という観点の2 つの側面から考える必要がある。本CQ では①の妊娠が乳がんに与える影響という観点を対象とする。一方,年齢を考慮すると長期間にわたる内分泌療法を終了してからでは妊娠の可能性が低下することが懸念され,内分泌療法を中断して妊娠を試みることは可能か,という問題点もある。それらの妥当性に関して考察する。
解説
乳がん治療の内容は個々の患者によって異なる。Stage とサブタイプに応じて個々の患者で再発のベースラインリスクを予想し,必要と考えられる治療を実施することでリスクリダクションを図る。したがって,局所治療のみで治療が完了できる非浸潤がんでは治療終了後,早期に妊娠に向け準備することが可能である。一方,浸潤がんでは再発リスクにより治療内容や治療期間が異なるため,個々の症例で判断する必要がある。
乳がんと診断されてから妊娠に至るまでの期間,また妊娠可能とされる時期に関しては,明らかな根拠はない。Valachis ら1)のシステマティック・レビューの研究では,乳がんの診断から妊娠まで,少なくとも10 カ月以上あけることで予後は悪化しないと報告されている。しかし,本検討では術後薬物療法の有無などには言及しておらず,診断から10 カ月以上あければ全ての症例で妊娠は安全である,ということではなく,症例に応じた標準治療の実施が重要である。ホルモン受容体陽性乳がんでは,妊娠によるホルモン環境の変化が予後に影響を及ぼすことが懸念されるところであるが,エストロゲン受容体(ER)の発現状況別に妊娠例とmatch させた非妊娠例を比較検討した報告がある2)。ER 陽性例(686 例),ER 陰性例(521 例)のそれぞれにおいて,妊娠の有無によって予後(全生存割合)の悪化は認められなかった(HR=0.91, 0.75)。このことより,ホルモン受容体陽性乳がんにおいても適切な治療後の妊娠は考慮できると考えられる。
標準治療終了後,どの程度の期間をあければ妊娠可能かという点については,ホルモン受容体発現の有無が一つの指標となりうる。ホルモン受容体陽性乳がんでは診断後5 年,ホルモン受容体陰性乳がんでは診断後2 年くらいまでに再発が多くみられるとされている3, 4)。再発リスクの観点からは,ホルモン受容体陽性乳がんでは5 年間のホルモン治療後,ホルモン受容体陰性乳がんでは術後2 年経過後であれば,後述(CQ4)の薬剤wash out 期間を経た後に妊娠を検討してもよい。
ホルモン治療の期間については,EBCTCG のメタアナリシスでは,術後5 年間のタモキシフェン内服により,タモキシフェンを使用しない場合と比べ,ER 陽性乳がんの再発リスクと死亡リスクが減少することが示されている5, 6)。さらに5 年未満の治療期間と比較したデータもあるが,タモキシフェン内服なしと比較したときの「再発率比」は,タモキシフェン1〜2 年間内服と5 年間内服で,それぞれ0.74 と0.59,「乳がん死亡率比」は,それぞれ0.82 と0.66 となっており,タモキシフェン1〜2 年間内服による効果は,5 年間内服による効果よりも明らかに劣っていた5)。タモキシフェン5 年間内服と10 年間内服を比較する2 つの大規模臨床試験(ATLAS 試験,aTTom 試験)では,10 年間内服によって,再発リスクと乳がん死亡リスクをさらに軽減できることが示された7, 8)。閉経前ホルモン受容体陽性乳がんに対する術後ホルモン療法として,10 年間のタモキシフェン投与も選択肢の一つとなると考えられる。
以上より,再発リスクと乳がん死亡リスクの軽減を第一に考えると,術後ホルモン療法としてのタモキシフェンは5 年間,または,それ以上の期間の内服が推奨される。術後ホルモン治療を中断もしくは早期に終了して妊娠を試みることは再発リスクと乳がん死亡リスクの上昇の可能性があり勧められない。挙児希望のためタモキシフェン内服中断や早期終了を考慮する場合には,当初の再発リスク,標準治療完遂による再発リスク減少効果,内服中止によって予想される再発リスクへの影響,ホルモン治療を中止した場合の妊娠・分娩の可能性を考慮して,慎重に判断する必要がある。内分泌療法を一時中断して妊娠を試みることの乳がんの予後に与える影響に関しては,International Breast Cancer Study Group(IBCSG)を中心に,グローバルな前向き研究が進行中である(POSITIVE 試験)9)。医療者は,患者がリスクとベネフィットを十分理解した上で意思決定を行うことを支援するべきである。
以上のように,乳がん患者において妊娠を希望する場合には,標準治療を完遂後に考慮可能と考えるが,サブタイプや再発リスクに基づき個別に判断される。乳がんに対する治療計画とともに,妊娠・分娩の計画を患者,乳がん治療医,生殖医療を専門とする医師で密に連携をとりながら立案していくことが望ましい。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility preservation in young women with breast cancer. J Assist Reprod Genet. 2012; 29: 469-72
- 4)
- Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines
引用文献
- 1)
- Valachis A, Tsali L, Pesce LL, et al. Safety of pregnancy after primary breast carcinoma in young women: a meta-analysis to overcome bias of healthy mother effect studies. Obstet Gynecol Surv. 2010; 65: 786-93 (Ⅳb)
- 2)
- Azim HA Jr, Kroman N, Paesmans M, et al. Prognostic impact of pregnancy after breast cancer according to estrogen receptor status: a multicenter retrospective study. J Clin Oncol. 2013; 31: 73-9 (Ⅴ)
- 3)
- Ismail Jatoi, William F. Anderson, Jong-Hyeon Jeong and Carol K. Redmond. Breast Cancer Adjuvant Therapy: Time to Consider Its Time-Dependent Effects. J Clin Oncol. 2011; 29: 2301-4 (Ⅴ)
- 4)
- Sorlie T, Tibshirani R, Parker J, et al. Repeated observation of breast tumor subtypes in independent gene expression data sets. Proc Natl Acad Sci U S A. 2003; 100: 8418-23 (その他)
- 5)
- Early Breast Cancer Trialists’ Collaborative Group(EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet. 2005; 365: 1687-717 (Ⅱ)
- 6)
- Early Breast Cancer Trialists’ Collaborative Group(EBCTCG), Davies C, Godwin J, Gray R, et al. Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level2 meta-analysis of randomised trials. Lancet. 2011; 378: 771-84 (Ⅰ)
- 7)
- Davies C, Pan H, Godwin J, et al; Adjuvant Tamoxifen: Longer Against Shorter(ATLAS)Collaborative Group. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet. 2013; 381: 805-16 (Ⅱ)
- 8)
- Gray RG, Rea D, Handley K, et al; aTTom: on behalf of the aTTom Collaborative Group. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6, 953 women with early breast cancer. J Clin Oncol. 2013; 31(suppl abstra 5), ASCO Annual Meeting 2013 (Ⅱ)
- 9)
- Pagani O, Ruggeri M, Manunta S, et al. Pregnancy after breast cancer: Are young patients willing to participate in clinical studies? Breast. 2015; 24: 201-7 (Ⅴ)
- CQ4
- 乳がん患者が妊娠を希望した場合,催奇形性など薬物治療や放射線治療による安全性の観点からは,治療終了後いつから妊娠可能となるか?
- 推奨グレードC1
- 治療薬の催奇形性の観点から,薬剤治療終了後は使用薬剤に応じて適切な期間のwash out 期間や避妊期間をおくべきである。放射線治療後の妊娠の時期については,再発リスクや薬剤治療計画に基づき検討が可能である。
背景・目的
本CQ では挙児希望を有する乳がん患者が,治療終了後いつから妊娠可能と判断するかに関して,がん治療による催奇形性などの安全性の観点から考察する。乳がんの標準治療の中で,催奇形性など胎児や児に影響を及ぼしうるホルモン治療,化学療法,抗HER2 治療,放射線治療に関して項目別に解説する。
解説
1.ホルモン治療
タモキシフェン内服中の妊娠は胎児に対する催奇形性のリスクがあり禁忌である。タモキシフェンの代謝産物が体内から消失するには,内服終了後約2 カ月かかるとされ1),タモキシフェン終了後2 カ月間は避妊期間をおくべきである。
2.化学療法
化学療法(抗がん薬)の場合は,原始卵胞が排卵に至るまでの期間を勘案して終了から4〜6 カ月の期間をあけることが望ましい。げっ歯類を用いた実験では,シクロホスファミド投与後排卵までの期間が9 週以内の場合は先天異常を認める可能性が有意に高く,12 週以降では減少することが示されており,このような影響は薬剤の種類によっても異なる可能性がある2)。また,化学療法あるいは放射線治療後1 年以内の妊娠では,生殖細胞の異常に起因すると考えられる異常は増加を認めなかったが,治療に起因する子宮やホルモン環境の悪化に伴うと考えられる異常(早産,低出生体重児)の増加を認めたという報告3)もある。したがって,化学療法終了直後の妊娠が出生児,および周産期予後に与える影響は明らかではないが,化学療法終了から妊娠まで少なくとも6 カ月程度の期間をあけることが望ましく,妊娠時は慎重な周産期管理が必要である。
3.トラスツズマブ
術後トラスツズマブの有効性を検証したHERA 試験における偶発的妊娠の調査4)では,トラスツズマブ投与中もしくは投与後の妊娠について報告されている。本研究では16 症例がトラスツズマブ投与中もしくは投与終了後3 カ月以内に妊娠が判明している。これらのうち,妊娠継続を希望した症例に対してはトラスツズマブ投与が中止され,5 例が分娩に至った。トラスツズマブ終了3 カ月以降に認められた33 例45 回の妊娠(4 回の妊娠については情報なし)については,妊娠判明時期はトラスツズマブ終了後,平均32 カ月(5〜70 カ月)であった。7 回(16%)が自然流産,4 回(9%)が人工妊娠中絶,30 回(双児3 組)が分娩に至った。トラスツズマブ終了後の妊娠では羊水過少症および無羊水症は認められず,新生児33 例全例に障害は認められなかった。
妊娠期乳癌にトラスツズマブを使用した17 報告(妊婦18 人,新生児19 人)のシステマティック・レビュー5)では,妊娠中期もしくは後期にトラスツズマブを投与された症例の73.3%に羊水過少症が報告されている。一方,妊娠前期のみにトラスツズマブを投与された症例では羊水過少症は報告されていない。全体では52.6%の児は出生時に異常を認めていない。トラスツズマブ曝露の時期別には,妊娠中期もしくは後期にトラスツズマブを投与された症例における新生児の56.2%は出生時に異常を認め,25%は出生後死亡した(観察期間 出生〜5.25 カ月)が,妊娠前期のみにトラスツズマブを投与された症例における新生児では出生時の異常および児の死亡は報告されていない。
トラスツズマブのヒト生体内における半減期は16 日程度であり,投与終了からしばらくは母体内にトラスツズマブが残存していると考えられる。妊娠初期には胎盤を経由して胎児へのトラスツズマブ移行はないと考えられているため,トラスツズマブ終了直後に妊娠しても胎児へ影響する可能性は低いと考えられるが,保証する臨床データは報告がなく,推奨されない。ハーセプチンⓇの添付文書には投与終了後最低7 カ月間の妊娠は禁忌と記されている。トラスツズマブ投与終了後の妊娠の安全性については臨床データの統合解析が始まったばかりであり,添付文書の内容を覆すほどの科学的根拠はないと考えられる。したがって,安全域を勘案し,トラスツズマブ投与終了後7 カ月は妊娠を避けるべきである。
4.放射線治療
放射線による妊娠への影響については,国際放射線防護委員会(International Commission on Radiological Protection:ICRP)より刊行された『ICRP 84 妊娠と医療放射線』に詳しく述べられている6)。一般的に,生殖腺へ照射を受けた場合,その後の妊娠・分娩により生まれた児にがんや先天異常を認める頻度が増加するという報告は今までに示されていない。また,原爆被爆生存者の子や孫を対象にした研究や,放射線治療を受けた小児がん経験者に対する研究においても,子孫に対する遺伝的影響は示されていない。
乳房温存術後照射を受けた患者では,照射側の乳房からの授乳は照射による組織変化により不可能であることが多いが,対側乳房からは安全に授乳が可能であるとの報告がある7)。また,授乳が乳がんの再発リスクを上げるという報告はなく,児に対しても悪影響を及ぼすことはないと報告されている8)。
以上のように,乳がんの術後放射線治療終了後の妊娠により,児への遺伝的影響や,妊娠経過異常が認められたという報告はない。放射線治療後は,乳がんの再発リスクや他の補助療法の必要性を考慮の上,特別なwash out 期間などを設けることなく妊娠を検討できる。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility preservation in young women with breast cancer. J Assist Reprod Genet. 2012; 29: 469-72
- 4)
- Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines
引用文献
- 1)
- Barthelmes L, Gateley CA. Tamoxifen and pregnancy. Breast. 2004; 13: 446-51 (レビュー)
- 2)
- Cardoso F, Loibl S, Pagani O, et al; European Society of Breast Cancer Specialists. The European Society of Breast Cancer Specialists recommendations for the management of young women with breast cancer. Eur J Cancer. 2012; 48: 3355-77 (レビュー)
- 3)
- Mulvihill JJ, McKeen EA, Rosner F, et al. Pregnancy outcome in cancer patients. Experience in a large cooperative group. Cancer. 1987; 60: 1143-50 (Ⅴ)
- 4)
- Azim HA Jr, Metzger-Filho O, de Azambuja E, et al. Pregnancy occurring during or following adjuvant trastuzumab in patients enrolled in the HERA tria(l BIG 01-01). Breast Cancer Res Treat. 2012; 133: 387-91 (Ⅴ)
- 5)
- Zagouri F, Sergentanis TN, Chrysikos D, et al. Trastuzumab administration during pregnancy: a systematic review and meta-analysis. Breast Cancer Res Treat. 2013; 137: 349-57 (Ⅴ)
- 6)
- 日本アイソトープ協会.ICRP publication 84 妊娠と医療放射線.丸善,東京,2002 (その他)
- 7)
- Higgins S, Haffty BG. Pregnancy and lactation after breast-conserving therapy for early stage breast cancer. Cancer. 1994; 73: 2175-80 (Ⅴ)
- 8)
- Azim HA Jr, Bellettini G, Gelber S, et al. Breast-feeding after breast cancer: if you wish, madam. Breast Cancer Res Treat. 2009; 114: 7-12 (Ⅴ)
- CQ5
- 挙児希望を有する乳がん患者に勧められる妊孕性温存療法にはどのようなものがあるか?
- 推奨グレードB
-
- 1.パートナーがいる場合,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.パートナーがいない場合,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 3.パートナーの有無にかかわらず,卵巣組織凍結保存は研究段階であるものの,胚(受精卵)または未受精卵子凍結保存までの時間的猶予がない場合や思春期前など排卵誘発が困難な場合,施行可能な施設において考慮される。
- 推奨グレードC2
-
- 4.Gonadotropin releasing hormone(GnRH)アゴニストは,妊孕性温存目的での使用は推奨されない。
背景・目的
女性がん患者の治療におけるアルキル化薬をはじめとする抗がん薬の投与は,卵巣毒性を伴い,卵巣予備能の低下を引き起こすことが知られている。乳がん治療において,治療後1 年以内に3 カ月以上持続する無月経(無排卵)を発症する頻度は使用薬剤やレジメンにより異なり,20〜100%との報告がある1)。
米国臨床腫瘍学会(American Society of Clinical Oncology:ASCO)のガイドライン2013 では,40 歳未満の乳がん患者に対する4 サイクルのAC 療法(ドキソルビシン,シクロホスファミド)+タキサン系薬剤の投与によりchemotherapy induced amenorrhea(CIA)発症は30〜70%の中間リスクとされている2)。このことは,がん治療直後より早発閉経による難治性不妊の発症を予測するものであり,がん治療後から妊娠許可まで,もしくは社会的に妊娠可能になるまでのタイムラグも加味した加齢による妊孕性低下リスク3, 4)も考慮に入れると,挙児を希望する乳がん患者に対して,妊孕性低下リスクとその対策の選択肢についての情報を提供することは極めて重要と考えられる。
乳がん治療前の妊孕性温存の選択肢としての胚(受精卵),未受精卵子,卵巣組織の凍結保存,およびGnRH アゴニストによる卵巣休眠療法に関して,ヘルスケアプロバイダーが現状に即した患者への情報提供を行えることを目的とした。
解説
胚(受精卵),未受精卵子の凍結保存に関しては,一定数以上の卵子や胚を確保するための調節卵巣刺激(controlled ovarian stimulation:COS)が必要となることが多い。そこで問題となるものとして,COS に伴うがん治療の遅れ,卵巣過剰刺激症候群(ovarian hyperstimulation syndrome:OHSS),採卵に伴う出血や感染などの合併症などが挙げられる。さらにエストロゲン依存性腫瘍の場合には,一過性に上昇するエストロゲンの影響も考慮する必要がある。がん治療の遅れを短縮するため,月経周期にかかわらずCOS を開始するランダムスタート法が提案され5),従来法と比較し刺激期間の微増とゴナドトロピン使用量の増加以外には,採卵数,成熟卵数,受精率に差を認めないことから,がん治療前の患者への有用性が期待されている。一方,COS で主に用いられるクロミフェンやゴナドトロピン製剤などは,投与によって当然のことながら患者の血中エストロゲン濃度の非生理的な上昇を引き起こすため,エストロゲン依存性腫瘍に対して禁忌となっている。そのため,これらの使用に関しては「人を対象とする医学系研究に関する倫理指針」に従い,臨床研究としての手続きを経た実施が必要となる。
実際,ホルモン受容体陽性乳がん患者へのCOS による予後に対する影響は明らかになっていない。生殖補助医療(ART)を受けた患者においては将来の乳がん発症リスクの上昇は否定的とする報告が多い6-14)一方で,IVF 治療後1 年以内では乳がんリスクが一時的に上昇するとの報告もある12)。治療前から潜在的に存在していた乳がんがホルモン環境の変化により発育が進行した可能性が否定はできない。エストロゲンの一過性上昇を緩和し,有効なCOS を行うために,ゴナドトロピン製剤投与の際にアロマターゼ阻害薬を併用することの有用性も報告されている15)。また,胚(受精卵)や未受精卵子の凍結における,排卵誘発の期間の短縮を目的とし,2013 年にランダムスタート法が報告され,月経周期のどの時期から排卵誘発を開始しても,採卵数,成熟卵数,受精率には有意差を認めないことが示された16)。この方法は,がん患者の採卵を行う上で有効性が高いと思われる。
1.胚(受精卵)凍結
ASCO のガイドラインでは当初より標準レベルに位置付けられており,既婚女性の妊孕性温存の第一選択と考えられている。一方,前述のとおり未受精卵子凍結と同様,COS に続く採卵によるがん治療の遅れ,血中エストロゲン濃度の上昇や合併症,患者の卵巣予備能も十分に考慮し,がん治療医と生殖医療を専門とする医師が十分なコミュニケーションを取った上での適応を検討する必要がある。
2.未受精卵子凍結
2012 年,米国生殖医学会(American Society for Reproductive Medicine:ASRM)は4 個のランダム化比較試験(randomized controlled trial:RCT)により,凍結融解卵子を用いた体外受精の受精率,妊娠率が新鮮卵子を用いた場合と同等であることが示されたことを受けて,未受精卵子凍結を実験的方法の位置付けから標準レベルと変更した17-21)。これを受けて,ASCO のガイドラインでも未受精卵子凍結は標準治療であると改定された。しかしながら,融解卵子1 個あたりの継続妊娠率は4.5〜12%にとどまっており22),必ずしも胚(受精卵)凍結と同等とは言えず,がん・生殖医療への応用を考える場合,前述の臨床試験では不妊患者が,第三者や同胞から提供を受けた条件が良好な卵子を用いていることを考慮に入れる必要がある。一方,パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。
3.卵巣組織凍結
ASCO のガイドライン2013 では研究段階となっている。本法は原始卵胞の保存数が多いこと,がん治療の遅れを最小限にとどめることができること,パートナーのいない未婚女性も対象にでき,特に月経周期の確立していない小児にも適応できることなどのメリットがある。一方,凍結保存(後に自家移植)する卵巣組織内のがん細胞の混入リスクを完全に否定することが困難なこと,技術の改良進歩は著しいものの,2015 年までの生児獲得の報告は60 例と未だ少ないこと,採取と自家移植の2 回の腹腔鏡下手術が必要であること23, 24)などの問題もあり,現時点では慎重に適応を選択する必要がある。
4.GnRH アゴニストによる卵巣休眠療法
ASCO ガイドライン2013 では研究段階であるとされ,一方,『科学的根拠に基づく乳癌診療ガイドライン1 治療編2013 年版』では,「化学療法誘発性閉経の割合は減少する可能性があり,検討してもよい(推奨グレードC1)」,「妊孕性維持についてのエビデンスは乏しく,勧められない(推奨グレードC2)」とされている。また,『乳がん患者の妊娠出産と生殖医療に関する診療の手引き2014 年版』では,「無月経になる率が抑制される可能性があるが,妊孕性維持についてのエビデンスはなく推奨されない(推奨グレードC2)」と位置付けられている。
この方法はいくつかのRCT や基礎研究が行われてきたものの25, 26),肯定的結果と否定的結果と相反する報告が拮抗した報告が多くなされてきて27-37),ASCO のガイドラインでも研究段階であるとされている2)。しかしながら,最近のRCT の報告によると,治療後の妊孕性維持を目的とした使用に関しては否定的な結果が示された38)。
引用文献
- 1)
- Bines J, Oleske DM, Cobleigh MA. Ovarian function in premenopausal women treated with adjuvant chemotherapy for breast cancer. J Clin Oncol. 1996; 14: 1718-29 (Ⅳb)
- 2)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 3)
- Gerber B, Dieterich M, Muller H, et al. Controversies in preservation of ovary function and fertility in patients with breast cancer. Breast Cancer Res Treat. 2008; 108: 1-7 (レビュー)
- 4)
- Wallace WH, Kelsey TW. Human ovarian reserve from conception to the menopause. PLoS One. 2010; 5: e8772(Ⅳb)
- 5)
- Cakmak H, Katz A, Cedars MI, et al. Effective method for emergency fertility preservation: random-start controlled ovarian stimulation. Fertil Steril. 2013; 100: 1673-80 (Ⅳa)
- 6)
- Li LL, Zhou J, Qian XJ, et al. Meta-analysis on the possible association between in vitro fertilization and cancer risk. Int J Gynecol Cancer. 2013; 23: 16-24 (Ⅰ)
- 7)
- Salhab M, Al Sarakbi W, Mokbel K. In vitro fertilization and breast cancer risk: a review. Int J Fertil Women’s Med. 2005; 50: 259-66 (レビュー)
- 8)
- Dor J, Lerner-Geva L, Rabinovici J, et al. Cancer incidence in a cohort of infertile women who underwent in vitro fertilization. Fertil Steril. 2002; 77: 324-7 (Ⅳa)
- 9)
- Brinton LA, Trabert B, Shalev V, et al. In vitro fertilization and risk of breast and gynecologic cancers: a retrospective cohort study within the Israeli Maccabi Healthcare Services. Fertil Steril. 2013; 99: 1189-96 (Ⅳa)
- 10)
- Kristiansson P, Bjor O, Wramsby H. Tumour incidence in Swedish women who gave birth following IVF treatment. Hum Reprod. 2007; 22: 421-6 (Ⅳa)
- 11)
- Kallen B, Finnstrom O, Lindam A, et al. Malignancies among women who gave birth after in vitro fertilization. Hum Reprod. 2011; 26: 253-8 (Ⅳa)
- 12)
- Venn A, Watson L, Bruinsma F, et al. Risk of cancer after use of fertility drugs with in-vitro fertilisation. Lancet. 1999; 354: 1586-90 (Ⅳa)
- 13)
- Stewart LM, Holman CD, Hart R, et al. In vitro fertilization and breast cancer: is there cause for concern? Fertil Steril. 2012; 98: 334-40 (Ⅳa)
- 14)
- Katz D, Paltiel O, Peretz T, et al. Beginning IVF treatments after age 30 increases the risk of breast cancer: results of a case-control study. Breast J. 2008; 14: 517-22 (Ⅳb)
- 15)
- Reddy J, Oktay K. Ovarian stimulation and fertility preservation with the use of aromatase inhibitors in women with breast cancer. Fertil Steril. 2012; 98: 1363-9 (レビュー)
- 16)
- Cakmak H, Katz A, Cedars MI, et al. Effective method for emergency fertility preservation: random-start controlled ovarian stimulation. Fertil Steril. 2013; 100: 1673-80 (Ⅳa)
- 17)
- Cobo A, Garrido N, Pellicer A, et al. Six years’ experience in ovum donation using vitrified oocytes: report of cumulative outcomes, impact of storage time, and development of a predictive model for oocyte survival rate. Fertil Steril. 2015; 104: 1426-34. e1-8 (Ⅳa)
- 18)
- Cobo A, Kuwayama M, Perez S, et al. Comparison of concomitant outcome achieved with fresh and cryopreserved donor oocytes vitrified by the Cryotop method. Fertil Steril. 2008; 89: 1657-64 (Ⅳa)
- 19)
- Cobo A, Meseguer M, Remohi J, et al. Use of cryo-banked oocytes in an ovum donation programme: a prospective, randomized, controlled, clinical trial. Hum Reprod. 2010; 25: 2239-46 (Ⅳa)
- 20)
- Parmegiani L, Cognigni GE, Bernardi S, et al. Efficiency of aseptic open vitrification and hermetical cryostorage of human oocytes. Reprod Biomed Online. 2011; 23: 505-12 (Ⅳa)
- 21)
- Rienzi L, Romano S, Albricci L, et al. Embryo development of fresh ‘versus’ vitrified metaphase II oocytes after ICSI: a prospective randomized sibling-oocyte study. Hum Reprod. 2010; 25: 66-73 (Ⅳa)
- 22)
- Practice Committees of American Society for Reproductive M, Society for Assisted Reproductive T. Mature oocyte cryopreservation: a guideline. Fertil Steril. 2013; 99: 37-43 (ガイドライン)
- 23)
- Donnez J, Dolmans MM. Ovarian cortex transplantation: 60 reported live births brings the success and worldwide expansion of the technique towards routine clinical practice. J Assist Reprod Genet. 2015; 32: 1167-70(Ⅳb)
- 24)
- Donnez J, Dolmans MM, Diaz C, et al. Ovarian cortex transplantation: time to move on from experimental studies to open clinical application. Fertil Steril. 2015; 104: 1097-8 (Ⅴ)
- 25)
- Imai A, Furui T. Chemotherapy-induced female infertility and protective action of gonadotropin-releasing hormone analogues. J Obstet Gynaecol. 2007; 27: 20-4 (Ⅴ)
- 26)
- Imai A, Sugiyama M, Furui T, et al. Direct protection by a gonadotropin-releasing hormone analog from doxoru bicin-induced granulosa cell damage. Gynecol Obstet Invest. 2007; 63: 102-6 (Ⅴ)
- 27)
- Badawy A, Elnashar A, El-Ashry M, et al. Gonadotropin-releasing hormone agonists for prevention of chemotherapy-induced ovarian damage: prospective randomized study. Fertil Steril. 2009; 91: 694-7 (Ⅱ)
- 28)
- Beck-Fruchter R, Weiss A, Shalev E. GnRH agonist therapy as ovarian protectants in female patients undergoing chemotherapy: a review of the clinical data. Hum Reprod Update. 2008; 14: 553-61 (レビュー)
- 29)
- Blumenfeld Z, Patel B, Leiba R, et al. Gonadotropin-releasing hormone agonist may minimize premature ovarian failure in young women undergoing autologous stem cell transplantation. Fertil Steril. 2012; 98: 1266-70. e1(Ⅳa)
- 30)
- Del Mastro L, Boni L, Michelotti A, et al. Effect of the gonadotropin-releasing hormone analogue triptorelin on the occurrence of chemotherapy-induced early menopause in premenopausal women with breast cancer: a randomized trial. JAMA. 2011; 306: 269-76 (Ⅱ)
- 31)
- Demeestere I, Brice P, Peccatori FA, et al. Gonadotropin-releasing hormone agonist for the prevention of chemotherapy-induced ovarian failure in patients with lymphoma: 1-year follow-up of a prospective randomized trial. J Clin Oncol. 2013; 31: 903-9 (Ⅱ)
- 32)
- Gerber B, von Minckwitz G, Stehle H, et al. Effect of luteinizing hormone-releasing hormone agonist on ovarian function after modern adjuvant breast cancer chemotherapy: the GBG 37 ZORO study. J Clin Oncol. 2011; 29: 2334-41 (Ⅱ)
- 33)
- Leonard RC, Adamson D, Anderson R, et al. The OPTION trial of adjuvant ovarian protection by goserelin in adjuvant chemotherapy for early breast cancer. J Clin Oncol. 2010; 28: 590 (Ⅱ)
- 34)
- Moore HC, Unger JM, Phillips KA, et al. Goserelin for ovarian protection during breast-cancer adjuvant chemotherapy. N Engl J Med. 2015; 372: 923-32 (Ⅱ)
- 35)
- Munster PN, Moore AP, Ismail-Khan R, et al. Randomized trial using gonadotropin-releasing hormone agonist triptorelin for the preservation of ovarian function during(neo)adjuvant chemotherapy for breast cancer. J Clin Oncol. 2012; 30: 533-8 (Ⅱ)
- 36)
- Roberts J, Ronn R, Tallon N, et al. Fertility preservation in reproductive-age women facing gonadotoxic treatments. Curr Oncol. 2015; 22: e294-304 (レビュー)
- 37)
- Lambertini M, Boni L, Michelotti A, et al. ; GIM Study Group. Ovarian Suppression With Triptorelin During Adjuvant Breast Cancer Chemotherapy and Long-term Ovarian Function, Pregnancies, and Disease-Free Survival: A Randomized Clinical Trial. JAMA. 2015; 314: 2632-40 (Ⅱ)
- 38)
- Demeestere I, Brice P, Peccatori FA, et al. No Evidence for the Benefit of Gonadotropin-Releasing Hormone Agonist in Preserving Ovarian Function and Fertility in Lymphoma Survivors Treated With Chemotherapy: Final Long-Term Report of a Prospective Randomized Trial. J Clin Oncol. 2016; 34: 2568-74 (Ⅱ)
泌尿器
- 総説
妊孕性温存療法の適応となる泌尿器がん
尿路および男性性器に発生する悪性腫瘍としては,腎がん,尿路上皮がん,前立腺がん,精巣腫瘍が代表的疾患である。この中で,20〜40 代に好発する疾患は精巣腫瘍であり,最も妊孕性温存に対する配慮が必要となる。一方で腎がん,前立腺がん,尿路上皮がんは精巣腫瘍より高い罹患率であるが,一般に60 歳以上の高齢者に好発する。ただし,男性の場合は,40〜50 歳以上であっても挙児を希望する場合があり,妊孕性温存に対する対応が必要となる場合がある。20〜40 代の女性に腎がんおよび尿路上皮がんが発症する頻度は低い。以下,各がんにおける疫学と治療法・予後について概説する。
1.精巣腫瘍
1-1.疫学
精巣腫瘍は年間10 万人あたり1〜2 人と稀な腫瘍である。好発年齢が20〜40 代であり,大部分の症例で妊孕性温存に対する配慮が必要である(CQ1〜CQ4)。精巣腫瘍患者では治療開始前から健康成人男子に比べ精液濃度や精子数が低値であることが知られている1)。精巣腫瘍は病理組織学的にセミノーマと非セミノーマに分類される。精巣腫瘍では同時性・異時性に対側精巣に腫瘍が発生することがある。
1-2.標準治療と予後
腫瘍が精巣に限局している場合(病期Ⅰ)には,患側精巣の摘除を行う。再発予防としては,セミノーマでは後腹膜予防照射やカルボプラチン投与が,非セミノーマでは術後補助化学療法が施行されることがある。一方,転移巣を有する場合には,シスプラチンを含んだ多剤併用化学療法が標準治療として実施される。化学療法後残存腫瘍を認めた場合には外科的切除を行う。精巣腫瘍は転移例であっても化学療法および後腹膜リンパ節郭清などの集学的療法で90%以上の症例で治癒が可能である2)。
1-3.妊孕性が障害される病態
精巣腫瘍化学療法の主要薬剤であるシスプラチンは用量依存性に造精機能障害を来し,総投与量500mg/m2 以上では遷延性無精子症のリスクが高くなる(表5-1)。このため,造精機能障害は精巣腫瘍長期サバイバーにおける重要な晩期合併症の一つとして認識されている。精巣腫瘍の所属リンパ節は後腹膜リンパ節であり,後腹膜リンパ節郭清を実施した場合の合併症の一つに射精障害(逆行性射精)がある。また,上述のように精巣腫瘍は同時性・異時性に両側発生することが知られており,その場合には両側精巣摘除や精巣部分切除術が考慮される。実地臨床では精巣摘除後,化学療法を実施する前に精子凍結保存を行うことが多いが,同時性・異時性の両側精巣腫瘍等の特殊な状況で手術により造精機能が廃絶することが予想される場合には,術前または術中に精子凍結保存を実施することが重要となる。精巣部分切除術を施行しても,残存精巣に放射線照射を行った場合には,男性ホルモンの分泌能は保たれるが,造精機能障害は来す。そのため,放射線照射前に精子凍結保存を実施することが重要となる。精巣腫瘍の化学療法開始前の妊孕性温存に関するアルゴリズムを図5-1 に示す。

*CQ 番号をクリックすると解説画面へ移動します。
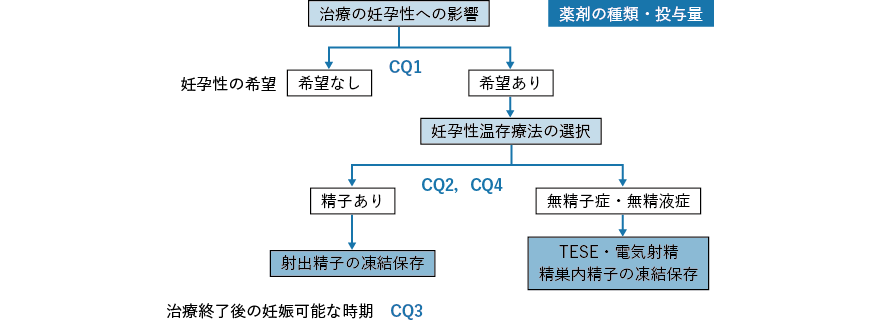
2.尿路上皮がん
2-1.疫学
尿路上皮がんは腎盂,尿管,膀胱,尿道に発生するが,膀胱がんが最も多く,腎盂および尿管に発生する上部尿路がんがこれに続く。膀胱および上部尿路がんの好発年齢は70 歳前後,男女比は前者が約3.9:1,後者が約2.2:1 である3, 4)。尿路上皮がんの特徴は同時性・異時性に多発することであり,治療後の尿路内腔への再発リスクが高い。
2-2.標準治療と予後
転移を有さない尿路上皮がんに対する標準治療は外科的切除である。手術術式は発生部位と深達度により異なる。上部尿路がんに対しては腎尿管全摘術が,筋層非浸潤性膀胱がんには経尿道的切除が,筋層浸潤性膀胱がんには膀胱全摘が標準術式となる。膀胱全摘では,男性は膀胱および前立腺,尿道を摘出する。一方,女性では膀胱・尿道とともに子宮と腟前壁を合併切除する場合と膀胱・尿道摘出のみで子宮と腟は温存する場合とがあり,腫瘍の部位で術式選択がなされる。転移を有する場合には,基本的には全身化学療法が標準治療となる。現在,ゲムシタビン+シスプラチンの2 剤併用療法が最も多く用いられている。生命予後は,病期により異なる。筋層非浸潤性膀胱がんでは再発予防をしない場合の膀胱内再発率は約50%とされているが,生命予後は良好である。一方,筋層浸潤性膀胱がんおよび筋層浸潤性上部尿路がんの場合,外科的切除を行ったとしても5 年生存率は60〜80%である。転移性尿路上皮がんの予後は不良であり,2 年生存率は10〜20%である。
2-3.妊孕性が障害される病態
上部尿路がんや筋層非浸潤性膀胱がんでは,妊孕性が障害されることは少ない。一方,筋層浸潤性膀胱がんでは,膀胱全摘が必要となるため,男性では勃起・射精障害が生じる。また,若年女性で膀胱全摘が必要となる場合は,子宮の合併切除の要否や尿路変向術後状態での妊娠の可否など妊孕性への配慮が必要となる(CQ1)。
3.前立腺がん
3-1.疫学
前立腺がんは泌尿器がんの中で最も罹患率が多い疾患であり,男性がん罹患全体の約14%を占める。典型的な高齢者がんであり,壮年期の患者は割合としては少ない5)(CQ1)。前立腺は男性ホルモン依存性臓器であり,前立腺がんも基本的には男性ホルモンに依存している。
3-2.標準治療・予後
限局性前立腺がんに対しては,前立腺全摘術や放射線治療が標準治療として施行される。内分泌療法が併用されることもある。転移性前立腺がんに対する標準治療は内分泌療法である。前立腺がんは男性ホルモンに感受性があり,内分泌療法としてはluteinizing hormone-releasing hormone(LH-RH)アナログやLH-RH アンタゴニスト,抗アンドロゲン剤の内科的去勢と両側精巣摘除の外科的去勢とがある。去勢抵抗性前立腺がんとなった場合には,タキサン系抗がん薬や新規抗アンドロゲン剤,放射線性治療剤などが使用される。限局性前立腺がんの予後は一般に良好であり,前立腺全摘術や放射線治療が施行されれば,5 年疾患特異的生存率は90%以上である。一方,転移性前立腺がんでは,転移の状態により予後は左右され,5 年疾患特異的生存率は50〜60%程度である。
3-3.妊孕性が障害される病態
一般に前立腺がんは高齢男性に発生するため,妊孕性に対する配慮は不要な場合が多い。しかし,男性では40〜50 歳以上であっても挙児を得ることは可能であり,症例によっては妊孕性に配慮する必要がある。限局性前立腺がんに対する前立腺全摘および放射線治療では勃起射精障害を来す。神経温存手術を施行した場合,勃起能は温存されるが,前立腺は摘出されているため,射精は不可となる。内分泌療法では男性ホルモンを抑制するため,性欲低下とともに造精機能障害を認める。
4.腎がん
4-1.疫学・標準治療・予後
腎がんは男女ともがん罹患全体の2%を占め,男女比は約2.4:1 で男性に多い6)。好発年齢は60 歳以上である。組織型としては,淡明細胞がんが最も多い。転移を認めない病期Ⅰ〜Ⅲ症例には腎部分切除術や腎摘除術が行われる。転移例に対する薬物療法としては,チロシンキナーゼ阻害薬やmammalian target of rapamycin(mTOR)阻害薬などの分子標的治療薬が主に使われる。予後は病期によって異なり,5 年疾患特異的生存率は病期Ⅰ:98%,病期Ⅱ:93%,病期Ⅲ:84%,病期Ⅳ:44%である6)。
4-2.妊孕性が障害される病態
腎がんに対する標準的治療薬である分子標的治療薬による卵巣機能障害や造精機能障害に関する知見はまだ十分ではない。一方で,従来の標準治療であり,現在でも症例によっては用いられることのあるインターフェロン(interferon:IFN)-αによる造精機能障害のリスクは極めて低いとされている。
引用文献
- 1)
- Petersen PM, Skakkebaek NE, Vistisen K, et al. Semen quality and reproductive hormones before orchiectomy in men with testicular cancer. J Clin Oncol. 1999; 17: 941-7
- 2)
- Miki T, Kamoi K, Fujimoto H, et al. Clinical characteristics and oncological outcomes of testicular cancer patients registered in 2005 and 2008: the first large-scale study from the Cancer Registration Committee of the Japanese Urological Association. Int J Urol. 2014; 21: S1-6
- 3)
- Hinotsu S, Akaza H, Miki T, et al. Bladder cancer develops 6 years earlier in current smokers: analysis of bladder cancer registry data collected by the cancer registration committee of the Japanese Urological Association. Int J Urol. 2009; 16: 64-9
- 4)
- Fujimoto H, Nakanishi H, Miki T, et al. Oncological outcomes of renal pelvic and ureteral cancer patients registered in 2005: the first large population report from the Cancer Registration Committee of the Japanese Urological Association. Int J Urol. 2014; 21: 527-34
- 5)
- Fujimoto H, Nakanishi H, Miki T, et al. Oncological outcomes of the prostate cancer patients registered in 2004: report from the Cancer Registration Committee of the JUA. Int J Urol. 2011; 18: 876-81
- 6)
- Kanayama HO, Fukumori T, Fujimoto H, et al. Clinicopathological characteristics and oncological outcomes in patients with renal cell carcinoma registered in 2007: The first large-scale multicenter study from the Cancer Registration Committee of the Japanese Urological Association. Int J Urol. 2015; 22: S1-7
- 7)
- Levine J, Canada A, Stern CJ. Fertility preservation in adolescents and young adults with cancer. J Clin Oncol. 2010; 28: 4831-41
- CQ1
- どのような泌尿器がん患者に妊孕性温存療法を説明すべきか?
- 推奨グレードB
- 不妊のリスクが高いと予想される治療が実施される場合,妊孕性を希望する患者に対しては病状を考慮した上で,治療開始前に妊孕性温存療法に関する説明が推奨される。
背景・目的
治療法の進歩とともに,若年の泌尿器がん患者の治療成績も向上してきている。特に精巣腫瘍では化学療法および手術療法により,多くの患者で治癒が期待できる。その点で,治療後の妊孕性温存がこれらの患者のquality of life(QOL)の面で重要となってくる。一方,実地臨床では妊孕性温存について十分な説明,対策がとられていないという問題点が指摘されている。また,腎がんや膀胱がんなども一定の頻度で若年発症することが知られているが,妊孕性温存に関しては精巣腫瘍よりさらに対策は不十分である。まず実際に治療を施行する腫瘍治療医が,どのような泌尿器がんが妊孕性温存の適応となり得るかを認識し,患者に対し説明することが重要である。また,精子凍結保存を含む妊孕性温存療法が治療の遅延なく実施可能となる体制を全国的に構築することが重要である。本CQ では,妊孕性温存の適応となる泌尿器がんについて概説する。
解説
泌尿器がんの中で若年患者に発症する代表的なものが精巣腫瘍である。精巣腫瘍発症の要因の一つに停留精巣や男性不妊症が挙げられている。また,精巣腫瘍患者では治療開始前から正常側精巣の造精機能障害を認める例も一定の割合で存在する。しかし多くの場合,有転移例に行われるシスプラチン併用化学療法による造精機能障害が妊孕性保持の面で問題となる。標準化学療法であるBEP 療法(ブレオマイシン,エトポシド,シスプラチン)で治療された患者では,治療後1〜2 年以上経過した時点での精液所見が正常である率は41〜57%,乏精子症が23〜24%,無精子症が20〜35%とされている1-5)。治療後の造精機能障害のリスク因子としては,治療前の精液所見,年齢およびシスプラチンの総投与量などが指摘されている6)。また,化学療法後に有意な残存病変を認めた場合,後腹膜リンパ郭清術が実施されるが,神経温存ができないと逆行性射精など射精障害を併発することになる。これらの点から,少なくとも全身化学療法が実施される患者では,治療前に可能な限り精液保存等の妊孕性温存療法について説明し,希望がある場合には対応すべきである。
一方,腎がんや尿路上皮がんでも,近年の結婚年齢の高齢化や不妊症治療技術の進歩などを考慮すると,特に男性では実際に妊孕性温存の対象となり得る年齢層の患者が存在する。日本泌尿器科学会(The Japanese Urological Association:JUA)が集計したがん登録データでは,登録された腎がん患者の13%(475 例/3,663 例)が50 歳未満であった7)。また,転座型腎がんは,若年患者,特に女性に好発し,また悪性度が高いとされる。転座型腎がんを含め,転移を有する腎がんでは分子標的治療薬が広く使われるが,これら薬剤では卵巣機能障害や催奇形性の問題が指摘されている。一方,分子標的治療薬による造精機能障害に関する知見は未だ十分ではない。チロシンキナーゼ阻害薬の動物実験ではスニチニブが造精機能(雄ラット)に影響しないとする報告8)がある一方で,ソラフェニブがマウスの精子数を減少させるとする報告9)もある。したがって,妊孕性温存を希望し,かつ分子標的治療が必要な腎がん患者には,治療開始前に妊孕性温存療法について検討すべきである。また,上部尿路上皮がん登録データ(JUA)では7.2%(108 例/1,509 例)が54 歳以下であった10)。膀胱がんでは,Hinotsu らの集計を参考にすると,男性の約14%が54 歳以下,女性の約3%が44 歳以下と推定される11)。尿路上皮がんではシスプラチン併用化学療法が標準であり,基本的に妊孕性温存を希望する患者への対処は精巣腫瘍と同様と考えられる。尿路上皮がんでは術前または術後補助化学療法,あるいは転移例に対する化学療法など適応の異なる治療が行われるが,転移例に妊孕性温存の説明をする場合は,長期生存率が不良であることにも言及する必要がある。筋層浸潤性膀胱がんでは膀胱全摘・尿路変向術が必要となる。男性の場合には精管を結紮することになるが,将来的に精巣内精子採取術・顕微授精により挙児を得る可能性がある。精巣内精子採取術を避けたい場合には,手術前に精子凍結保存の実施を検討する必要がある。女性でも,症例数は限られているが妊孕性温存を目的とした膀胱全摘・尿路変向術が報告されている12)。泌尿器がんで最も頻度の高い前立腺がんは典型的な高齢者がんであり,前立腺がん登録データ(JUA)では54 歳以下の症例は1.8%(154 例/8,424 例)と稀である13)。一方で,限局性前立腺がんに対する前立腺全摘術や放射線治療,進行性前立腺がんに対する内分泌療法などの標準的治療の大部分が高頻度に射精障害,勃起障害を来し得る。したがって青壮年前立腺がん患者には,治療開始前にこれらの合併症について説明し,妊孕性温存の希望のある場合は精子凍結保存等を説明し,希望があれば実施を検討すべきである14)。
参考にした二次資料
- ASCO ガイドライン
- 1)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 西山博之,宗田 武,市岡健太郎,他.長期精子凍結保存の実施状況に関する全国アンケート調査.泌尿器科紀要.2008; 54: 593-8
- 日本泌尿器科学会 編.精巣腫瘍診療ガイドライン2015 年版.金原出版,東京,2015
- Magelssen H, Haugen TB, von Düring V, et al. Twenty years experience with semen cryopreservation in testicular cancer patients: who needs it? Eur Urol. 2005; 48: 779-85
- Pacey A, Merrick H, Arden-Close E, et al. Implications of sperm banking for health-related quality of life up to 1 year after cancer diagnosis. Br J Cancer. 2013; 108: 1004-11
- Záková J, Lousová E, Ventruba P, et al. Sperm cryopreservation before testicular cancer treatment and its subsequent utilization for the treatment of infertility. Scientific WorldJournal. 2014; 2014: 575978
引用文献
- 1)
- Petersen PM, Hansen SW, Giwercman A, et al. Dose-dependent impairment of testicular function in patients treated with cisplatin-based chemotherapy for germ cell cancer. Ann Oncol. 1994; 5: 355-8 (Ⅴ)
- 2)
- Stephenson WT, Poirier SM, Rubin L, et al. Evaluation of reproductive capacity in germ cell tumor patients following treatment with cisplatin, etoposide, and bleomycin. J Clin Oncol. 1995; 13: 2278-80 (Ⅴ)
- 3)
- Lampe H, Horwich A, Norman A, et al. Fertility after chemotherapy for testicular germ cell cancers. J Clin Oncol. 1997; 15: 239-45 (Ⅴ)
- 4)
- Pectasides D, Pectasides M, Farmakis D, et al. Testicular function in patients with testicular cancer treated with bleomycin-etoposide-carboplatin(BEC(90))combination chemotherapy. Eur Urol. 2004; 45: 187-93 (Ⅴ)
- 5)
- Gandini L, Sgrò P, Lombardo F, et al. Effect of chemo- or radiotherapy on sperm parameters of testicular cancer patients. Hum Reprod. 2006; 21: 2882-9 (Ⅴ)
- 6)
- Meistrich M, Vassilopoulou-sellin R, Lipshultz LI. Gonadal dysfunction. In DeVita VT, Hellman S, Rosenberg SA(eds): Cancer -Principles and practice of oncology(6th edition). JB Lippincott, Philadelphia, 1997, pp2923-39(Ⅵ)
- 7)
- Kanayama HO, Fukumori T, Fujimoto H, et al. Clinicopathological characteristics and oncological outcomes in patients with renal cell carcinoma registered in 2007: The first large-scale multicenter study from the Cancer Registration Committee of the Japanese Urological Association. Int J Urol. 2015; 22: S1-7 (Ⅳb)
- 8)
- Coburn AM, Cappon GD, Bowman CJ, et al. Reproductive toxicity assessment of sunitinib, a multitargeted receptor tyrosine kinase inhibitor, in male and female rats. Birth Defects Res B Dev Reprod Toxicol. 2012; 95: 267-75(Ⅵ)
- 9)
- Shetty SD, Bairy LK. Effect of sorafenib on sperm count and sperm motility in male Swiss albino mice. J Adv Pharm Technol Res. 2015; 6: 165-9 (Ⅵ)
- 10)
- Fujimoto H, Nakanishi H, Miki T, et al. Oncological outcomes of renal pelvic and ureteral cancer patients registered in 2005: the first large population report from the Cancer Registration Committee of the Japanese Urological Association. Int J Urol. 2014; 21: 527-34 (Ⅳb)
- 11)
- Hinotsu S, Akaza H, Miki T, et al. Bladder cancer develops 6 years earlier in current smokers: analysis of bladder cancer registry data collected by the cancer registration committee of the Japanese Urological Association. Int J Urol. 2009; 16: 64-9 (Ⅳb)
- 12)
- Ali-El-Dein B, Mosbah A, Osman Y, et al. Preservation of the internal genital organs during radical cystectomy in selected women with bladder cancer: a report on 15 cases with long term follow-up. Eur J Surg Oncol. 2013; 39: 358-64 (Ⅴ)
- 13)
- Fujimoto H, Nakanishi H, Miki T, et al. Oncological outcomes of the prostate cancer patients registered in 2004: report from the Cancer Registration Committee of the JUA. Int J Urol. 2011; 18: 876-81 (Ⅳb)
- 14)
- Salonia A, Capogrosso P, Castiglione F, et al. Sperm banking is of key importance in patients with prostate cancer. Fertil Steril. 2013; 100: 367-72 (Ⅳb)
- CQ2
- 泌尿器がん患者が治療開始に先立ち妊孕性温存を希望した場合,妊孕性温存療法に伴う治療開始遅延は容認されるか?
- 推奨グレードC1
- 妊孕性温存療法に伴う,がん治療開始遅延は最小限にとどめることが望ましい。また,進行した精巣腫瘍では緊急に治療を開始すべき症例もあり,治療開始遅延の可否は個々の判断による。
背景・目的
精巣腫瘍は青壮年男子に好発する腫瘍であり,転移進行例でも化学療法および手術療法により,多くの患者で治癒が期待できる。精巣腫瘍患者では治療開始前から造精機能障害を高率に認め,かつシスプラチンは用量依存性に造精機能障害を来す。本CQ では精巣腫瘍を中心に精子保存のタイミングと治療開始遅延の妥当性について述べる。
解説
1.精巣腫瘍
全身化学療法が実施される精巣腫瘍患者では,治療前に可能な限り精液保存等の妊孕性温存療法について説明し,希望がある場合は妊孕性温存療法を勧めるべきである。大部分の症例では精子凍結保存による治療開始遅延は容認できる。ただし,緊急化学療法が必要な症例もあり,その場合は十分に説明し同意を得た上で妊孕性温存を断念し,化学療法を先行させる。緊急化学療法が必要な症例としては,神経症状を伴う脳転移例やhuman chorionic gonadotropin(hCG)が著明な高値を示し,転移巣からの出血症状(血痰など)やcomputed tomography(CT)などで転移巣からの出血を認める症例(絨毛がん症候群)などが挙げられる1)。精巣腫瘍患者では高位精巣摘除術前から悪性リンパ腫患者や健康成人男子に比べ精液濃度や精子数が低値であることが知られている2)。精子保存は精巣摘除後にも可能であるが,患側精巣摘除後にはさらに精液所見が不良となることから,精巣摘除前の精子保存を推奨する意見が多い3, 4)。Rives らは術前症例320 例の平均精液濃度が32.2×106/mL に対して,術後症例674 例では24.1×106/mL であったとしている4)。精巣摘除前に無精子症を診断された場合には,精巣摘除時に精巣内精子採取術を同時に施行する可能性も検討可能となる4)。病期Ⅰセミノーマに対して再発予防を目的とした術後照射を行う場合,照射後の精液所見は照射方法によって異なる。例えば30Gy の線量で傍大動脈領域のみの照射(PA 法)と傍大動脈領域および患側の腸骨領域への照射(dogleg 法)では,18 カ月以内に精液濃度が10×106/mL 以上に回復する率は前者で59%,後者で38%であった5)。したがって,精巣摘除前に精子保存を行わず,術後に放射線治療を予定しているセミノーマ症例に対しては,上記を説明した上で,希望する場合は照射開始前に精子保存する。また,照射方法に応じて必要な場合には陰囊部の遮蔽を行う。現在のところ,精巣腫瘍患者が妊孕性温存を希望した場合に容認される治療開始までの遅延期間に関する明確なエビデンスはないが,その目安を表5-2 にまとめた。

2.腎がん
現在のところ腎がんに用いられる薬物療法は分子標的治療薬が中心である。分子標的治療薬を投与中の患者の精子による妊娠成功率や催奇形性に関するエビデンスはない。したがって,分子標的治療が予定され,かつ妊孕性温存を希望する場合は,治療開始前に精子保存を行うことが望ましい。腎がんでは緊急的に分子標的治療が必要な症例は稀であり,治療開始までの期間を利用して実施可能と考えられ,治療開始の遅延がどの程度,許容されるかは,病状に応じた医学的な判断を必要とする。
3.尿路上皮がん
尿路上皮がんに対する化学療法後の妊孕性に関する明確なエビデンスはないが,妊孕性温存を希望し,かつ化学療法が必要な症例への対処は精巣腫瘍と同様と考えられる。筋層浸潤性膀胱がんに膀胱全摘・尿路変向術を予定する場合も精子凍結保存の適応となる。この際に治療開始の遅延がどの程度,許容されるかは,病状に応じた医学的な判断を必要とする。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- Male reproductive health after childhood, adolescent, and young adult cancers: a report from the Children’s Oncology Group. J Clin Oncol. 2012; 30: 3408-16
引用文献
- 1)
- Kandori S, Kawai K, Fukuhara Y, et al. A case of metastatic testicular cancer complicated by pulmonary hemorrhage due to choriocarcinoma syndrome. Int J Clin Oncol. 2010; 15: 611-4 (Ⅴ)
- 2)
- Petersen PM, Skakkebaek NE, Vistisen K, et al. Semen quality and reproductive hormones before orchiectomy in men with testicular cancer. J Clin Oncol. 1999; 17: 941-7 (Ⅴ)
- 3)
- Ostrowski KA, Walsh TJ. Infertility with Testicular Cancer. Urol Clin North Am. 2015; 42: 409-20 (Ⅵ)
- 4)
- Rives N, Perdrix A, Hennebicq S, et al. The semen quality of 1158 men with testicular cancer at the time of cryopreservation: results of the French National CECOS Network. J Androl. 2012; 33: 1394-401 (Ⅳb)
- 5)
- Fosså SD, Horwich A, Russell JM, et al. Optimal planning target volume for stage I testicular seminoma: A Medical Research Council randomized trial. Medical Research Council Testicular Tumor Working Group. J Clin Oncol. 1999; 17: 1146 (Ⅱ)
- CQ3
- 泌尿器がん患者が挙児を希望した場合,治療終了後いつから挙児または妊娠可能となるか?
- 推奨グレードB
-
- 1.男性患者の場合,凍結保存した精子があれば,患者の希望する時期に顕微授精を行うことが可能である。
- 推奨グレードC1
-
- 2.催奇形性を有する薬剤や胎児への安全性に関する情報が十分でない薬剤が使用された場合には,適切な期間の避妊が考慮される。
背景・目的
泌尿器がんの治療成績は早期発見と治療の進歩により改善されている。特に精巣腫瘍では化学療法および手術療法により,多くの患者で治癒が期待できる。このような状況から,がん患者のQOL の向上の観点では,治療後に子どもをもつことへの希望に対して適切な情報提供をすることが重要であり,その点について概説した。
解説
1.精巣腫瘍
精巣腫瘍患者では,挙児希望を有する場合には,原則治療前に精子凍結保存が推奨される。治療前に精子が凍結保存されている場合,治療終了後の時期に関係なく夫婦が希望した時期に凍結保存精子を用いて生殖補助医療(assisted reproductive technology:ART)を行うことが可能である。特に顕微授精〔卵細胞質内精子注入法(intracytoplasmic sperm injection:ICSI)〕の進歩により,抗がん薬治療や全身放射線治療前に凍結した精子を使用して挙児を得ることが可能になった1, 2)。一方,治療開始前の精子凍結保存が実施されていない場合には,治療終了後,一定の期間の避妊が推奨される。一般に,催奇形性を有する薬剤の治験の場合,薬剤の半減期の5 倍に女性の場合は30 日,男性の場合は90 日を加算した避妊期間が推奨されることが多い。また,病状と予後も考慮する必要がある。精巣腫瘍に対する化学療法としては,一般的にシスプラチン併用化学療法が施行され,造精機能障害を来す。シスプラチン併用化学療法4 サイクル以下であれば,治療終了後いったん無精子症になったとしても,長期に観察した場合,造精機能が回復する可能性がある3)。Brydøy らの中央値12 年の長期観察研究では,射精可能な患者に限定した場合,12 年以内の妊娠成功率はBEP 療法2 サイクル,3 サイクルおよび4 サイクルで治療された患者で各々100%,83%,76%であった4)。これらの化学療法を含む治療後の父親の児における先天異常については,精巣腫瘍では多数例のデータはないが,小児がんのコホート研究ではリスクの上昇は観察されていない5)。一方,BEP 療法後の患者の精子では染色体異常の頻度が高いとする報告もある。De Mas らはBEP 療法後6〜17 カ月患者の精子について検討し,健康成人対照群と比べて有意に染色体16, 18, XY での異数性とダイソミーが増加していることを報告している6)。このように,抗がん薬治療や全身放射線治療後の精子形成回復期(2 年間)において精子の染色体異常が確認されている。しかし,精子形成回復期およびその後パートナーが妊娠した場合に胎児に先天異常がみられる頻度が増加するというエビデンスもない。このため,生殖器官への放射線照射が行われた場合,催奇形性を有する薬剤または胎児への安全性に関する情報が十分でない薬剤ががん治療として使用された場合には,挙児希望時にできるだけ遺伝カウンセリングを提供することが望ましいとする意見がある。
2.その他の泌尿器がん
腎がん,尿路上皮がん,前立腺がんなどにおいても,患者が男性で治療開始前に精子凍結保存を実施している場合は,治療終了後の時期に関係なく夫婦が希望した時期に凍結保存精子を用いてART を行うことが可能である。一方,催奇形性を有する薬剤または催奇形性に対する十分な安全性が確認されていない薬剤が使用された場合,薬剤の半減期の5 倍に女性の場合は30 日,男性の場合は90 日を加算した避妊期間を推奨するという意見がある。また,女性患者の場合には,妊娠中に再発した場合には治療開始に影響するため,再発の可能性を加味して避妊期間を検討することが望ましい。
参考にした二次資料
なし
引用文献
- 1)
- Dohle GR. Male infertility in cancer patients: Review of the literature. Int J Urol. 2010; 17: 327-31 (レビュー)
- 2)
- Tournaye H, Dohle GR, Barratt CL. Fertility preservation in men with cancer. Lancet. 2014; 384: 1295-301 (Ⅵ)
- 3)
- Brydøy M, Fosså SD, Klepp O, et al. Paternity following treatment for testicular cancer. J Natl Cancer Inst. 2005; 97: 1580-8 (Ⅳa)
- 4)
- Brydøy M, Fosså SD, Klepp O, et al. Paternity and testicular function among testicular cancer survivors treated with two to four cycles of cisplatin-based chemotherapy. Eur Urol. 2010; 58: 134-40 (Ⅳa)
- 5)
- Chow EJ, Kamineni A, Daling JR, et al. Reproductive outcomes in male childhood cancer survivors: a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med. 2009; 163: 887-94 (Ⅳa)
- 6)
- De Mas P, Daudin M, Vincent MC, et al. Increased aneuploidy in spermatozoa from testicular tumour patients after chemotherapy with cisplatin, etoposide and bleomycin. Hum Reprod. 2001; 16: 1204-8 (Ⅳb)
- CQ4
- 挙児を希望する泌尿器がん患者に勧められる妊孕性温存療法にはどのようなものがあるか?
- 推奨グレードB
-
- 1.男性患者には,精子凍結保存が推奨される。
- 推奨グレードC1
-
- 2.射精液中に精子が存在しない場合は,精巣内精子を採取してこれを凍結保存することも考慮される。
- 推奨グレードD
-
- 3.精巣腫瘍患者に対して,妊孕性温存を目的としたgonadotropin releasing hormone(GnRH)治療は推奨できない。
背景・目的
集学的治療の進歩により,生殖年齢の泌尿器がん患者の治癒率の向上とともに,QOL 向上の一環としての妊孕性温存の要求が高まっている。本CQ では,生殖年齢の泌尿器がん患者の妊孕性を温存する手段についての現時点での指針を示す。
解説
泌尿器がん患者に対し根治治療を行う上で妊孕性に影響を与えると考えられる機序としては,治療による性機能の障害,精路閉塞,精巣喪失,造精機能障害が想定される。がん治療を優先するために不可避であるものは,これを受け入れることが必要である。ここでは,泌尿器がんの中で若年者およびadolescent and young adult(AYA)世代(15〜39 歳)に発生する精巣腫瘍を中心に解説する。単精巣に発生した精巣がんや両側精巣がんに対する精巣温存手術は,適応決定や手術手技に専門性が求められるため,限られた施設で行うことが推奨されている1)。化学療法や放射線治療による造精機能障害軽減を目的とした,視床下部-下垂体-精巣系をブロックするためのGnRH 投与等は,有効性が確かめられていないので推奨できない2)。造精機能障害を来すがん治療を開始する前に,精子を凍結保存することが,将来の挙児の可能性を残す最も確実な手段である3-5)。無精子症である場合でも,精巣内に精子を認めることがあり,その場合には精巣精子を採取して凍結保存することが可能である6, 7)。しかし,本邦ではがん治療施設において同時に精巣内精子採取術を実施できる施設は限られているといった問題がある。造精機能障害を来すがん治療が終了した後に無精子症の場合でも,顕微鏡下精巣内精子採取術を行い,精子を認めることがある。本邦では,47%で精子採取が可能で,顕微授精に用いて27%で挙児が可能であったとする報告がある8)。一方で,凍結保存された精子の利用率は4%と低いことが問題となっている9)。治療開始前に精子凍結保存を行うか否かは,意思決定をするときの患者の病状と医療機関の治療に対する満足度に依存していることから,がん治療に携わる医師が生殖医療機関との連携を積極的にとる役割を果たすことが重要である10)。
参考にした二次資料
なし
引用文献
- 1)
- Woo LL, Ross JH. The role of testis-sparing surgery in children and adolescents with testicular tumors. Urol Oncol. 2016; 34: 76-83 (Ⅵ)
- 2)
- Krause W, Pflüger KH. Treatment with the gonadotropin-releasinghormone agonist buserelin to protect spermatogenesis against cytotoxic treatment in young men. Andrologia. 1989; 21: 265-70 (Ⅳa)
- 3)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10 (Ⅵ)
- 4)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement. (Ⅵ)
- 5)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8 (Ⅵ)
- 6)
- Haddad N, Al-Rabeeah K, Onerheim R, et al. Is ex vivo microdissection testicular sperm extraction indicated for infertile men undergoing radical orchiectomy for testicular cancer? Case report and literature review. Fertil Steril. 2014; 101: 956-9 (Ⅴ)
- 7)
- Schrader M, Müller M, Sofikitis N, et al. “Onco-tese”: testicular sperm extraction in azoospermic cancer patients before chemotherapy-new guidelines? Urology. 2003; 61: 421-5 (Ⅴ)
- 8)
- Shin T, Kobayashi T, Shimomura Y, et al. Microdissection testicular sperm extraction in Japanese patients with persistent azoospermia after chemotherapy. Int J Clin Oncol. 2016; 21: 1167-71 (Ⅴ)
- 9)
- 鈴木康太朗,松崎純一,服部裕介,他.精子を凍結保存した患者のその後の経過.泌尿器科紀要.2007; 53: 539-44 (Ⅴ)
- 10)
- Pacey A, Merrick H, Arden-Close E, et al. Implications of sperm banking for health-related quality of life up to 1 year after cancer diagnosis. Br J Cancer. 2013; 108: 1004-11 (Ⅴ)
小児
- 総説
小児がんの治療成績はここ数十年で飛躍的に改善した。しかし,妊孕性の低下をはじめとする長期合併症は,治癒し得た症例において大きな問題となっている。本項では,小児がん治療医が診断後から治療開始までの短期間で,適切に妊孕性低下のリスクを評価し,生殖医療を専門とする医師と連携して妊孕性温存療法に対応できることを目的として記載した(CQ1〜CQ4)。
1.疫学
小児がんは,小児の死亡原因として「不慮の事故」に次いで頻度の高い事象であり,小児期の病死順位としては第1 位を示す疾患である。本邦の年間発生数は,2,000〜2,500 人,発生率にして15 歳未満人口1 万人あたり1〜1.5 人である。全小児がんにおける各疾患の頻度は,白血病が約40%,脳腫瘍が約20%,骨軟部肉腫が約10%,神経芽腫が約8〜10%,腎芽腫,肝芽腫が約5%を占める。リンパ性白血病は幼児期,胎児性腫瘍は乳幼児期に多いが,肉腫では思春期に好発するものが多い。男女比は1.1:1 で,やや男児に多い。
2.病態
上皮性がんの多い成人がんと異なり,小児がんは,白血病,脳腫瘍,胎児性腫瘍や肉腫がほとんどである。また,小児がんは,臓器に限定されず,全身のあらゆる部位から発生し,進行が早く,初診時に既に遠隔転移や全身播種している例も稀ではない。腫瘤性病変を生検あるいは摘出する前に,全身的な検索と病期,リスク分類を行うことが,その後の治療方針の決定のために必要である。
3.治療
小児がんは,化学療法,放射線治療に感受性のある腫瘍が多く,これらと外科療法をタイミングよく組み合わせ,間断なく,集学的治療を行う。一方で,アルキル化薬をはじめとする化学療法剤の使用や,骨盤,性腺が照射野となる放射線治療は,不妊の原因となりうる。このような治療を行う場合,診断から治療開始までの短い時間で妊孕性低下のリスクを評価し,生殖医療を専門とする医師,看護師,臨床心理士,ソーシャルワーカー等の多職種と連携して,チームで対応する必要がある。小児がん治療医が適切に対応できることを目的として,どのような治療を受ける患者が妊孕性温存療法の適応となるか(CQ1),妊孕性温存療法にはどのような方法があるか(CQ2),妊孕性温存療法を行うために小児がん治療を調整することは可能か(CQ3),小児がん患者の治療後の妊娠・分娩について,どのような情報を提供すべきか(CQ4)について,各CQ で詳述する。小児がん領域においては,本人,家族は診断後の大きな心理的負担の中,短期間の間に妊孕性温存療法に関する意思決定を余儀なくされる。こうした状況に配慮して,医師,看護師,がん相談員を含む多職種が連携して,対応にあたる必要がある。
4.予後
小児がん全体の治療成績はここ数十年で飛躍的に進歩した。小児のリンパ性白血病の予後は90%近くになり著しい改善をみている。一方で,生存率が50%未満の小児がんとして,① Ph1 染色体陽性急性白血病,② Stage 4 神経芽腫(特にMYCN 遺伝子増幅例),③高リスク群横紋筋肉腫(特にキメラ遺伝子陽性胞巣型例),④転移性ユーイング肉腫ファミリー腫瘍,⑤悪性ラブドイド腫瘍,⑥脳幹部グリオーマなどが挙げられる。
小児がん患者の生存率の向上に伴い,成人する小児がん経験者も増加し,治療による晩期の影響が大きな問題となってきた。小児がん治療においては,治療反応性や再発の有無など転帰のみならず,小児期の成長障害や成人後の妊孕性の低下を含む内分泌学的経過,二次がん発症のリスクなどについて,長期的なフォローアップが必要である。そして,その結果を現在の患児および家族へのケアと将来の治療改善のために,フィードバックすることが重要である。
*CQ 番号をクリックすると解説画面へ移動します。
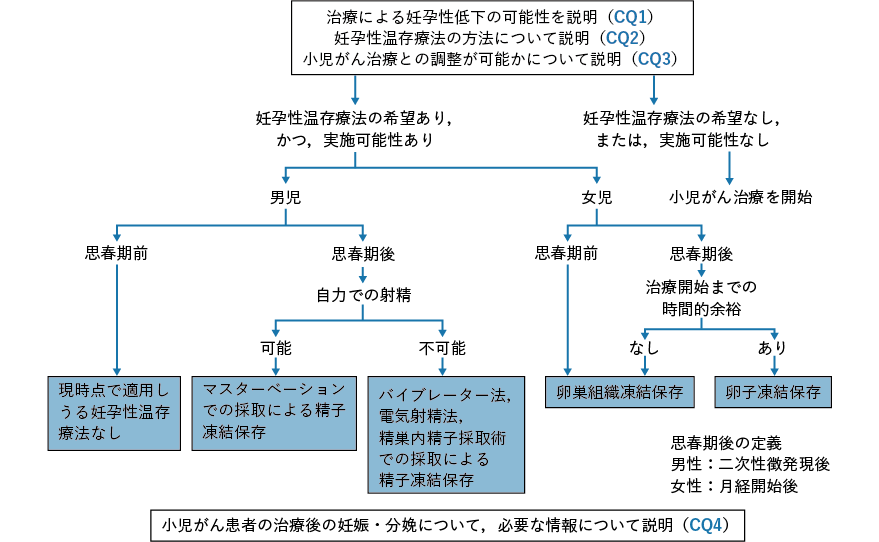
5.小児特有の倫理的配慮
小児患者における妊孕性温存療法の実施に際して,対象が小児患者であるため,小児特有の倫理的配慮が必要となる。日本においては,実地臨床における小児患者に対するインフォームドコンセント,アセントの指針は現段階では存在しないため,米国小児科学会の指針1),小児集団における医薬品の臨床試験に関するガイダンス2),人を対象とした医学系研究に関する倫理指針3)の記載をもとに,小児特有の倫理的配慮について記載した。
アセントとは,米国小児科学会が1995 年に提唱した概念で,小児が自身になされる診療行為について,年齢に応じた説明をなされた上で,診療を受けることに合意することを指す1)。アセントは,①年齢に応じた自身の病状に関する理解,②検査や治療により得られる結果とその意義についての説明,③病状に関する理解と意思決定に及ぼす要因の評価,④提案された医療に合意するかについての意思表明,の4 つの過程からなる。したがって,アセントにおいては,単に小児患者から合意を得ることが目的ではなく,年齢に応じた説明を受け,それを理解した上で,小児患者自身の考えで合意することが重要である。こうした過程により,小児患者は自身の病状をよく理解し,病状に応じて自分自身で決定していく力を養うことが期待される。米国小児科学会では,小学生以降の小児患者の診療における意思決定において,アセントを小児患者自身から得ることを推奨している。また,十分な理解能力を有する思春期以降の小児患者には,親からの同意に加えて,本人からの同意を得ることを推奨している。
小児集団における医薬品の臨床試験に関するガイダンス2)では,中学生以上の小児患者に対して文書によるアセントを得るべきであるとしている。また,アセントの対象年齢について,「全ての被験者は,彼らが理解できる言葉や用語で臨床試験について可能な限り十分な説明を受ける必要がある」と記載されており,ガイダンスについての厚生労働省医薬局審査管理課の質疑応答集では,「7 歳以上であれば,簡単な説明に理解可能と考えられる」との見解を示している4)。
日本では,人を対象とした医学系研究に関する倫理指針3)において,未成年者のインフォームドコンセントとアセントについて記載がある。この指針では,「中学校等の課程を修了している,または,16 歳以上の未成年者」には,研究の実施に関して十分な判断能力を有すると判断され,インフォームドコンセントを受ける必要があるとしている。「中学校等の課程を未修了であり,かつ,16 歳未満の未成年者」には,アセントを得ることを努力義務としている。
以上より,小児患者における妊孕性温存療法の実施に際して,
- ①対象が「中学校等の課程を修了している,または,16 歳以上の小児患者」で十分な判断能力を有すると判断される場合,親だけでなく患者自身からもインフォームドコンセントを得ることが望ましい。
- ②「中学校等の課程を未修了であり,かつ,16 歳未満の小児患者」の場合,親からのインフォームドコンセントだけでなく,本人にも年齢相応の説明を行い,アセントを得ることが望ましい。
引用文献
- 1)
- Guidelines for the ethical conduct of studies to evaluate drugs in pediatric populations. Committee on Drugs, American Academy of Pediatrics. Pediatrics. 1995; 95: 286-94
- 2)
- 小児集団における医薬品の臨床試験に関するガイダンスについて(平成12 年12 月15 日,医薬審第1334 号厚生省医薬安全局審査管理課長通知)
- 3)
- 人を対象とする医学系研究に関する倫理指針(平成26 年12 月22 日,文部科学省・厚生労働省告示第3 号)
- 4)
- 小児集団における医薬品の臨床試験に関するガイダンスに関する質疑応答集(Q&A)について(平成13 年6 月22 日,厚生労働省医薬局審査管理課事務連絡)
- CQ1
- どのような小児がん患者が妊孕性温存療法の適応となるか?
- 推奨グレードB
- がん種にかかわらず,不妊のリスクが高いと予想される治療を受ける小児がん患者は,治療内容と生命予後を考慮した上で,妊孕性温存療法の対象となる。
背景・目的
小児がん患者における妊孕性温存療法の適応については,児や親権者の理解度,また倫理的な背景も考慮すべきであるが,小児がん経験者における不妊の問題を直視し,児や親権者の理解度,倫理的な背景を考慮して対応することが求められる1,2)。児の年齢とともに,①化学療法や放射線治療により性腺機能が低下あるいは消失するもの,②十分ながんの予後が期待できるもの,③妊孕性温存療法を実施する時間的,体力的な余裕のある患者,④卵巣組織凍結については,研究段階の診療であることを本人あるいは保護者が十分に理解できること,などを考慮してその適応を検討した。
対象疾患
小児がん(固形腫瘍)として,脳腫瘍(髄芽腫,胚細胞腫等)・神経芽腫・胚細胞腫(中枢神経以外)・横紋筋肉腫・骨肉腫・ユーイング肉腫・網膜芽腫・非横紋筋肉腫の軟部腫瘍である。治療内容と治療成績を十分加味した上で,生命予後を考慮した場合,妊孕性温存を無視せざるを得ない治療を受ける前に,時間的,体力的に余裕のある患者が妊孕性温存療法の対象となる。
小児血液腫瘍疾患(白血病,リンパ腫など)に対する標準化学療法による妊孕能低下のリスクは20%未満である。しかし,プロカルバジンを含むホジキンリンパ腫に対する化学療法,性腺あるいは骨盤腔を照射野に含む放射線治療,造血細胞移植施行例では妊孕性温存の対象となる。
なお,疾患の詳細は,男女別にして表6-1(女児),表6-2(男児)としても記載した。
(WEB サイト上では2014 年1 月に一部修正あり)
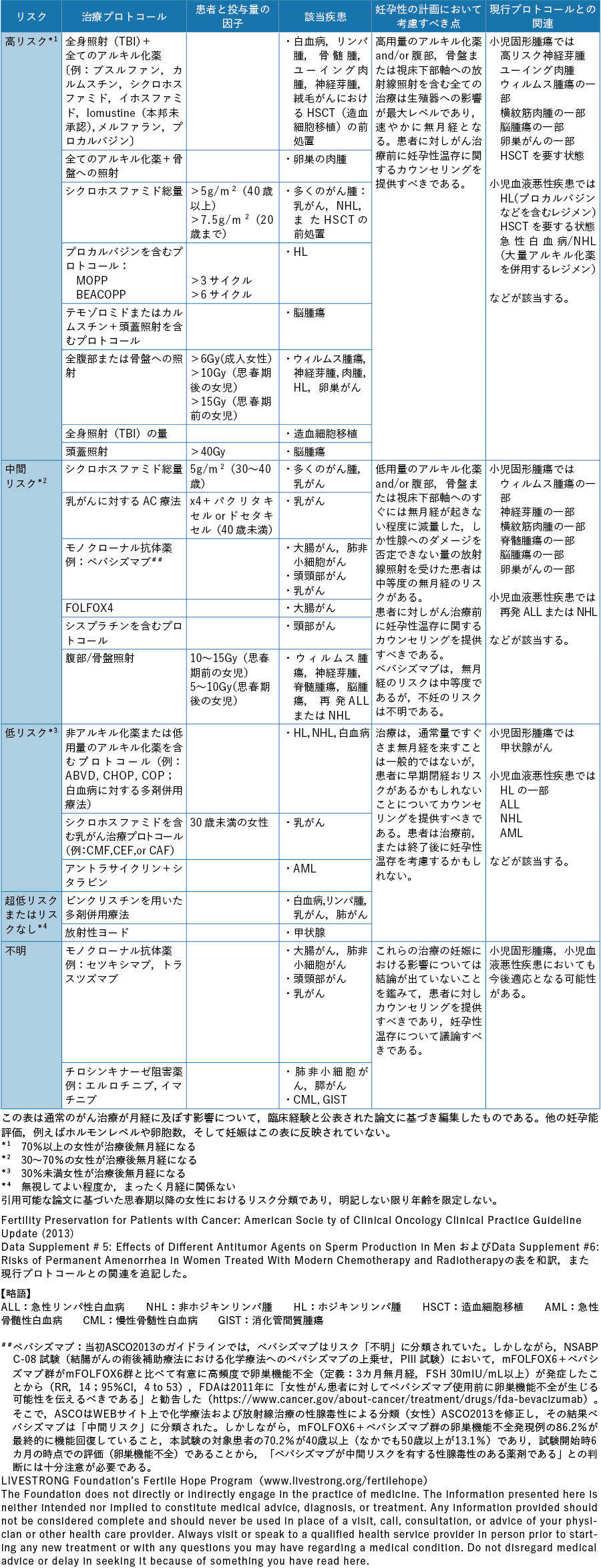
女児
思春期前の女児患者に対しては,現時点では研究段階の方法ではあるが,小児がん女性患者に対する卵巣組織凍結保存を考慮してもよい。その選択基準としては,Edinburgh クライテリア3)を参考にする。思春期前の女児患者に対しては,卵巣組織凍結を提案することが望ましい。一方,思春期後の女児に対しても,抗がん薬投与まで時間的猶予がない場合等は,十分に本人,家族に相談した上で,卵巣組織凍結を考慮してもよい。思春期後は未受精卵子凍結も可能である。
男児
思春期後の男性における妊孕性温存療法(の適応)は,挙児希望者全例にその方法,具体的には治療開始前の精子保存を相談することが望ましい。思春期前の男児における妊孕性温存療法の適応は,その方法が未確立であるため明確なものはない。
造血細胞移植を受ける児
造血細胞移植では,前処置の内容による差はあるものの高率に不可逆的な妊孕性低下が起こるため,思春期後の児または親権者に対して妊孕性温存という考えを示すべきである。
解説
がん治療としての手術,放射線治療,薬物療法(抗がん薬,分子標的治療薬やホルモン製剤)は,男女いずれに対しても妊孕性に影響を与える4)。手術は,性腺そのものの障害,神経や血管障害を惹起して不妊の原因となる4)。
薬物療法や放射線治療は直接的に性腺に障害を与える。女性では卵胞の破壊5-7),男性においては精子の数,活動性の低下,DNA 障害を介す8)。がん治療に関連する不妊の割合は,がん種,年齢,抗がん薬の種類やレジメン,放射線治療の場所と位置などである3, 4, 9)。中枢神経への照射を行う場合のホルモン異常についても特に注意する10)。
現在の小児固形腫瘍の発症頻度11)は,15 歳未満では脳腫瘍,神経芽腫,腎芽腫,胚細胞腫(中枢神経以外),横紋筋肉腫の順で多く,15〜19 歳では胚細胞腫,脳腫瘍,甲状腺腫瘍,悪性メラノーマ,骨肉腫の順となる。これに網膜芽腫,ユーイング肉腫さらに非横紋筋肉腫の軟部腫瘍を加えて頻度の高い小児固形腫瘍と考えた。これらの小児固形腫瘍において,治療介入により不妊のリスクが高まると考えられるものとしては,脳腫瘍(髄芽腫,胚細胞腫等)・高リスク神経芽腫・胚細胞腫(中枢神経以外)・横紋筋肉腫・骨肉腫・ユーイング肉腫・網膜芽腫・非横紋筋肉腫の軟部腫瘍である3-9)。治療成績を十分加味した上で11),これらの一部は妊孕性温存の対象となる。
小児血液悪性疾患においては,成人同様に造血細胞移植前処置,プロカルバジンを用いる化学療法,2.5Gy 以上の精巣への放射線治療,思春期後女児で10Gy の腹部骨盤への照射では不妊のリスクが高い。一方,少量のアルキル化薬と放射線を使用しない治療においては,その影響は限定的であり,急性白血病,悪性リンパ腫に対する標準的な化学療法では低リスクであることが示されている1)(造血器CQ1 の表7-1,表7-2 参照)。造血細胞移植では不可逆的な妊孕性障害が高率で生じ,前処置で用いられる大量化学療法や全身放射線照射(total body irradiation:TBI),年齢の影響が大きい。前処置の内容により影響の程度は異なる。また,強度減弱前処置(reduced-intensity conditioning:RIC)により妊孕性が温存されるかどうかは不明である(造血器CQ2 参照)。
早発閉経を来す小児若年女性の卵巣組織凍結の選択基準としては,Edinburgh クライテリアが現時点で正当性がある3)。すなわち,15 歳以上35 歳未満では抗がん薬や放射線治療を受けていない(15 歳未満では極めて少量または卵巣機能に影響のない薬物投与は可)・5 年以上の生存の機会がある・卵巣機能不全高リスク(50%以上)・説明と同意を得ている(親権者と,可能なら本人)・human immunodeficiency virus(HIV),梅毒,B 型肝炎の血清テストで陰性・未妊娠,未挙児である。
卵巣組織凍結の良い適応は思春期前の女児で12),この方法は,抗がん薬投与を急ぐ思春期後の女児にも可能である。ただし,白血病やリンパ腫などの造血器腫瘍では,抗がん治療前の採取卵巣組織内に腫瘍細胞が混入している可能性があることから,採取時期や移植の際の凍結組織融解・細胞分離らの技術が卵子保存や精子保存とは異なること,現時点では研究段階であり,その実施過程や結果のリスクも異なることに留意すべきである13)。
また,全ての腫瘍において卵巣組織凍結は現時点で研究段階の方法であることに留意する。
未受精卵子の凍結保存に関しては,思春期後の女児において考慮可能である14)。
骨盤に放射線治療を行う必要がある小児がんでは患児卵巣位置移動術が行われる場合もある1)。また,月経発来後女性に対するgonadotropin releasing hormone(GnRH)アゴニスト投与は,現時点ではその有用性が否定的である15)。
男性で思春期発来後のがん患者では,治療開始前の精子保存が可能であり2, 12, 16, 17),その有用性は十分認識され,米国臨床腫瘍学会(American Society of Clinical Oncology:ASCO)のガイドライン1)やWEB サイト2)上にも,精子保存に関する記載があり,英国でも2003 年から既に精子保存を提示すべきとの認識がある17)。そのため本邦でも思春期発来後の男児において,家族や本人に妊孕性温存の方法を提示することが望ましいと考えられる。一方で,思春期前の男児では,明確な妊孕性温存の適応や方法論のエビデンスはなく,精巣組織の保存もあくまで研究的に,施設の倫理委員会承認下でのみ行われるべきである1, 2)。
思春期後で造血細胞移植を受ける予定の患者に対しては,妊孕性温存に関する情報を提供し,可能な方法を実行することを考慮する18)。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- CancerNet (American Society of Clinical Oncology(ASCO)HP). https://www.cancer.net/
- Loren AW. Fertility issues in patients with hematologic malignancies. Hematology Am Soc Hematol Educ Program, 2015. 2015; 138-45
- Lambertini M, Del Mastro L, Pescio MC, et al. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Med. 2016; 14: 1
- Jadoul P, Dolmans MM, Donnez J. Fertility preservation in girls during childhood: is it feasible, efficient and safe and to whom should it be proposed? Hum Reprod Update. 2010; 16: 617-30
- Jahnukainen K, Stukenborg JB. Clinical review: Present and future prospects of male fertility preservation for children and adolescents. J Clin Endocrinol Metab. 2012; 97: 4341-51
- Kelvin JF, Kroon L, Ogle SK. Fertility preservation for patients with cancer. Clin J Oncol Nurs. 2012; 16: 205-10
引用文献
- 1)
- Lee SJ, Schover LR, Partridge AH, et al. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol. 2006; 24: 2917-31 (ガイドライン)
- 2)
- Wallace WH, Thomson AB, Kelsey TW. The radiosensitivity of the human oocyte. Hum Reprod. 2003; 18: 117-21 (Ⅳa)
- 3)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 4)
- Wallace WH, Thomson AB, Saran F, et al. Predicting age of ovarian failure after radiation to a field that includes the ovaries. Int J Radiat Oncol Biol Phys. 2005; 62: 738-44 (Ⅳb)
- 5)
- Kalich-Philosoph L, Roness H, Carmely A, et al. Cyclophosphamide triggers follicle activation and “burnout”; AS101 prevents follicle loss and preserves fertility. Sci Transl Med. 2013; 5: 185ra62 (Ⅵ)
- 6)
- Thomson AB, Campbell AJ, Irvine DC, et al. Semen quality and spermatozoal DNA integrity in survivors of childhood cancer: a case-control study. Lancet. 2002; 360: 361-7 (Ⅳa)
- 7)
- Wallace WH, Anderson RA, Irvine DS. Fertility preservation for young patients with cancer: who is at risk and what can be offered? Lancet Oncol. 2005; 6: 209-18 (レビュー)
- 8)
- Wallace WH, Smith AG, Kelsey TW, et al. Fertility preservation for girls and young women with cancer: population-based validation of criteria for ovarian tissue cryopreservation. Lancet Oncol. 2014; 15: 1129-36 (Ⅳa)
- 9)
- Pizzo PA, Poplack DG, eds. Principles and practice of pediatric oncology. 7th ed. Lippincott Williams & Wilkins, Philadelphia, 2016, pp xxiv, 1296 (その他)
- 10)
- CancerNet (American Society of Clinical Oncology(ASCO)HP). http://www.cancer.net/ (その他)
- 11)
- blue DM, Kawashima T, Stovall M, et al. Fertility of female survivors of childhood cancer: a report from the childhood cancer survivor study. J Clin Oncol. 2009; 27: 2677-85 (Ⅲ)
- 12)
- Lambertini M, Del Mastro L, Pescio MC, et al. Cancer and fertility preservation: international recommendations from an expert meeting. BMC Med. 2016; 14: 1 (Ⅵ)
- 13)
- Loren AW. Fertility issues in patients with hematologic malignancies. Hematology Am Soc Hematol Educ Program, 2015. 2015: 138-45 (Ⅵ)
- 14)
- Oktay K, Bedoschi G. Oocyte cryopreservation for fertility preservation in postpubertal female children at risk for premature ovarian failure due to accelerated follicle loss in Turner syndrome or cancer treatments. J Pediatr Adolesc Gynecol. 2014; 27: 342-6 (Ⅴ)
- 15)
- Demeestere I, Brice P, Peccatori FA, et al. No evidence for the benefit of gonadotropin-releasing hormone agonist in preserving ovarian function and fertility in lymphoma survivors treated with chemotherapy: final longterm report of a prospective randomized trial. J Clin Oncol. 2016; 34: 2568-74 (Ⅱ)
- 16)
- Ginsberg JP, Ogle SK, Tuchman LK, et al. Sperm banking for adolescent and young adult cancer patients: sperm quality, patient, and parent perspectives. Pediatr Blood Cancer. 2008; 50: 594-8 (Ⅲ)
- 17)
- Wallace WH, Thomson AB. Preservation of fertility in children treated for cancer. Arch Dis Child. 2003; 88: 493-6 (Ⅵ)
- 18)
- Joshi S, Savani BN, Chow EJ, et al. Clinical guide to fertility preservation in hematopoietic cell transplant recipients. Bone Marrow Transplant. 2014; 49: 477-84 (Ⅵ)
- CQ2
- 小児がん患者の妊孕性温存療法にはどのような方法があるか?
- 推奨グレードC1
-
- 1.思春期以降の女児の場合は,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 2.思春期前の女児に対する妊孕性温存法としては卵巣組織凍結保存が唯一の方法である。また思春期以降でも,治療開始までに時間的猶予がない場合は,卵巣組織凍結保存の対象となる。ただし,現在は研究段階にあり,限られた施設で臨床研究として行われるべきである。
- 推奨グレードB
-
- 3.女児の場合,思春期前後を問わず,骨盤内への放射線治療に対しては,照射野外への卵巣位置移動術が推奨される。
- 推奨グレードB
-
- 4.思春期以降の男児の場合は,精子凍結保存が推奨される。
- 推奨グレードなし
-
- 5.思春期前の男児では,現時点で適用しうる妊孕性温存療法はない。
背景・目的
小児がんの治療成績は向上しており,小児がん全体の5 年生存率は8 割に達するとされている。小児がん経験者が増加するとともに,晩期合併症を軽減し,より良いquality of life(QOL)を目指すことが重要となってきた。その中で妊孕性温存は重要な課題である。本CQ では,小児がん患者の妊孕性温存療法について,エビデンスに基づいて評価し解説する。
解説
2013 年にASCO から報告された,がん患者の妊孕性温存に関するガイドライン1)や米国生殖医学会(American Society for Reproductive Medicine:ASRM)倫理委員会の意見2)では,小児において推奨される確立された妊孕性温存法は,精子および未受精卵子の凍結保存のみである。しかしながら,これらは思春期以降の患者にしか適用されない。したがって,小児がん患者の妊孕性温存療法の選択肢は極めて限られている。
思春期前の患児については,卵巣組織および精巣組織凍結保存が確実性のある唯一の妊孕性温存法であるが,いずれも研究段階にある。これらは倫理委員会の審査を受けた,限られた施設での臨床研究として行われるべきであるとされる1, 2)。また,卵巣組織や精巣組織の凍結保存を行う場合は,がん細胞の混入についても注意が必要である。
全身治療による性腺障害が小さく放射線治療による影響が強いと予想される場合は,性腺遮蔽や放射線照射野外への性腺位置移動術による障害の軽減が試みられるべきである。また小児の妊孕性温存療法を行う場合,がん治療までの限られた時間の中で,両親等代諾者のインフォームドコンセントに加え,年齢に応じて適切なインフォームドアセントが行われるべきである3)。
以下に小児に適応となる妊孕性温存療法を個々に評価してその適応を記載する。なお,小児がんにおける妊孕性温存療法についてのエビデンスは,これまでランダム化比較試験(randomized controlled trial:RCT)によって証明されたものはなく,全て症例集積のみとなっている。
女児
- 未受精卵子凍結:未受精卵子凍結・融解後の挙児獲得は近年,成人においては,妊娠率は受精卵に比較して低いものの,確立された方法となってきている。一方,凍結・融解した卵子と新鮮卵子の比較において臨床妊娠率に差はなかったというRCT が報告されている4)。前述のようにASCO1)やASRM2)においても推奨されている妊孕性温存療法である。しかしながら,月経発来後の女児に限られ,排卵刺激が必要でがん治療開始までに約2 週間の期間が必要であり経腟的操作を要するため,小児において適応が難しい側面を有している5, 6)。
- 卵巣組織凍結:月経が発来していない場合は,未受精卵子凍結は不可能であるため,研究段階であるが卵巣組織凍結のみが唯一の妊孕性温存治療の選択肢となる7)。また,年齢に関する適格基準は臨床試験により異なるが,世界的には生後10 カ月の児に対しても凍結保存を行った報告がある8)。本邦の臨床研究においても0 歳から適応としている施設もある。
- 卵巣機能温存におけるGnRH アゴニストによる卵巣保護:2013 年のASCO ガイドラインにおいて信頼性は高くないとして推奨されていなかった1)。Prevention of Early Menopause Study(POEMS)において大規模なRCT により有効性が証明された9)が,その後リンパ腫を対象とした臨床試験では有効性は示されなかった10)。また対象は若年成人で,これがそのまま小児に適応されるかどうかは今後の研究結果を待たなければならない。なお,GnRH アゴニストは月経発来前の女児には適応はなく,月経発来後の女児に限られる。したがって現時点では小児がんの妊孕性温存療法としては推奨されない。
- 卵巣位置移動術:骨盤に放射線治療を行う必要がある小児がん患児に限られるが,ASCO でも推奨されている選択肢の一つである1)。ただし,小児例での報告は限られている11)。成人女性では子宮頸がん症例を筆頭に多くの観察研究が行われており,対象患者の65%以上で機能温存が得られていることから12),小児がん患児にも積極的に検討されるべき方法である13)。
男児
- 精子凍結:思春期以降の男児において確立された妊孕性温存療法である。射精により精子採取が可能な場合,がんに対する治療開始を遅らせることなく採取可能である。射精ができない患者の場合は,全身麻酔下電気刺激による射精14)も推奨されている。また,精子凍結は治療開始前に行われるべきで,治療中や治療後に精子凍結を行った場合,精子の染色体や構造に影響が出ている可能性があることが指摘されている15)。
- 精巣組織凍結:現在までに精巣組織凍結が臨床で行われた報告はない16)。しかしながら思春期前の男児においては,この方法が実用化されなければ治療前の精巣組織温存は不可能であるため,今後研究の進展が期待される。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility preservation in young women with breast cancer. J Assist Reprod Genet. 2012; 29: 469-72
- 4)
- Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines
引用文献
- 1)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 2)
- Ethics Committee of American Society for Reproductive M. Fertility preservation and reproduction in patients facing gonadotoxic therapies: a committee opinion. Fertil Steril. 2013; 100: 1224-31 (Ⅵ)
- 3)
- Informed consent, parental permission, and assent in pediatric practice. Committee on Bioethics, American Academy of Pediatrics. Pediatrics. 1995; 95: 314-7 (Ⅵ)
- 4)
- Potdar N, Gelbaya TA, Nardo LG. Oocyte vitrification in the 21st century and post-warming fertility outcomes: a systematic review and meta-analysis. Reprod Biomed Online. 2014; 29: 159-76 (Ⅰ)
- 5)
- Levine JM, Kelvin JF, Quinn GP, et al. Infertility in reproductive-age female cancer survivors. Cancer. 2015; 121: 1532-9 (レビュー)
- 6)
- 吉岡伸人,鈴木 直.小児・思春期がんの妊孕性温存.臨床婦人科産科.2015; 69: 40-5 (レビュー)
- 7)
- Metzger ML, Meacham LR, Patterson B, et al. Female reproductive health after childhood, adolescent, and young adult cancers: guidelines for the assessment and management of female reproductive complications. J Clin Oncol. 2013; 31: 1239-47 (Ⅳa)
- 8)
- Jadoul P, Dolmans MM, Donnez J. Fertility preservation in girls during childhood: is it feasible, efficient and safe and to whom should it be proposed? Hum Reprod Update. 2010; 16: 617-30 (レビュー)
- 9)
- Moore HC, Unger JM, Phillips KA, et al. Goserelin for ovarian protection during breast-cancer adjuvant chemotherapy. N Engl J Med. 2015; 372: 923-32 (Ⅱ)
- 10)
- Demeestere I, Brice P, Peccatori FA, et al. No Evidence for the Benefit of Gonadotropin-Releasing Hormone Agonist in Preserving Ovarian Function and Fertility in Lymphoma Survivors Treated With Chemotherapy: Final Long-Term Report of a Prospective Randomized Trial. J Clin Oncol. 2016; 34: 2568-74 (Ⅱ)
- 11)
- Barahmeh S, Al Masri M, Badran O, et al. Ovarian transposition before pelvic irradiation: indications and functional outcome. J Obstet Gynaecol Res. 2013; 39: 1533-7 (Ⅴ)
- 12)
- Gubbala K, Laios A, Gallos I, et al. Outcomes of ovarian transposition in gynaecological cancers; a systematic review and meta-analysis. J Ovarian Res. 2014; 7: 69 (Ⅰ)
- 13)
- Irtan S, Orbach D, Helfre S, et al. Ovarian transposition in prepubescent and adolescent girls with cancer. Lancet Oncol. 2013; 14: e601-8 (レビュー)
- 14)
- Adank MC, van Dorp W, Smit M, et al. Electroejaculation as a method of fertility preservation in boys diagnosed with cancer: a single-center experience and review of the literature. Fertil Steril. 2014; 102: 199-205. e191 (Ⅳa)
- 15)
- Nangia AK, Krieg SA, Kim SS. Clinical guidelines for sperm cryopreservation in cancer patients. Fertil Steril. 2013; 100: 1203-9 (ガイドライン)
- 16)
- Goossens E, Van Saen D, Tournaye H. Spermatogonial stem cell preservation and transplantation: from research to clinic. Hum Reprod. 2013; 28: 897-907 (レビュー)
- CQ3
- 妊孕性温存療法のために,小児がん治療を調整することは可能か?
- 推奨グレードC1
- 治療の遅延が予後に影響を与えないと判断される場合,がん治療の調整が考慮される。
背景・目的
小児がん患者が妊孕性温存療法を行う場合,予後への影響がないことが前提となるが,小児がん治療の遅延を必要とする場合がある。一方で,小児がんは進行が早く,診断後は速やかな治療開始が望ましい。そこで,妊孕性温存療法のために,小児がん治療を調整することが可能か検討した。
解説
検討のためには,化学療法の開始時期を比較した前方視的試験が必要となるが,実際にはこのような臨床試験の設定は不可能であり,これまでに報告はない。後方視的検討については,症状発現から診断までの時間と予後との関係を検討した報告1)はあるものの,診断後の化学療法開始時期の遅延とは異なると考えられ,診断後の化学療法開始時期が予後に及ぼす影響に関しての検討は検索し得なかった。以上より,治療開始の遅延が予後にどれだけ影響するかは不明であるが,妊孕性温存療法に要する時間が短いほど予後に与える影響は少ないと考えられるため,妊孕性温存療法の施行に関しては,本人,家族,医療者で十分に話し合い,決定せざるを得ない状況であると考えられる。
妊孕性温存療法の治療法,適応などは,CQ1,CQ2 に譲り,ここでは主に,
(1)個々の妊孕性温存療法施行のために必要なおおよその時間
(2)妊孕性温存療法のために起こりうる原疾患,および,その治療へ及ぼす影響
(3)児の発育への影響
などにつき説明する。個々の症例において妊孕性温存療法のために,小児がん治療を調整することは可能かどうかの判断の根拠としていただきたい。
1.未受精卵子凍結
未受精卵子凍結は,月経開始後の児について,未受精卵子凍結保存可能な施設との連携ができる場合,選択肢として挙げられる2)。
未受精卵子凍結は,採卵周期開始から採卵まで少なくとも2〜4 週間程度を必要とし,進行が緩やかな小児がんにおいてのみ許容される妊孕性温存療法と考えられる3, 4)。この場合,採卵後翌日から3 日後にがん治療開始が可能である。また,月経量の増加が予想されるので,血小板減少のある場合,注意を要する。
2.卵巣組織凍結
卵巣組織凍結保存においては,創傷治癒にかかる時間を考慮して3 日間から1 週間程度の期間を必要とする。卵巣組織凍結保存は,化学療法の途中で行われた場合でも挙児の報告があり5-7),病状の進行が急速であったため治療開始前に妊孕性温存療法ができなかった児に対して,治療開始後の妊孕性温存療法の選択肢となる。ただし,卵子へ直接影響を与える抗がん薬では化学療法終了後,半年から1 年間は卵子へのDNA 損傷などの可能性があり,妊孕性温存療法施行時期の判断については抗がん薬の種類についても考慮に入れ,病状とともに本人,家族と相談の上,行われるべきである8)。
月経が発来していない場合は,未受精卵子凍結は不可能であるため,研究段階であるが卵巣組織凍結のみが唯一の妊孕性温存療法の選択肢となる2)。また,年齢に関する適格基準は臨床試験により異なるが,世界的には生後10 カ月の児に対しても凍結保存を行った報告がある9)。本邦の臨床研究においても0 歳から適応としている施設もある。
3.精子凍結
思春期以降の児を対象として,マスターベーション,バイブレーター法,電気射精法(electroejaculation),精巣内精子採取術(testicular sperm extraction:TESE)が選択肢として挙げられる10)。マスターベーション,バイブレーター法,電気射精法による精子採取が可能な場合,精子保存に要する時間は短時間であり11),保存後に直ちに小児がん治療開始が可能である。TESE のような侵襲的な手技による精子採取を必要とする場合,創傷治癒にかかる時間を考慮する必要があるが,治療延期の期間は1 週間以内であると考えられる12)。女性と比べて男性においては,遅延が少なく小児がん治療を開始できると考えられる13)。
4.性腺位置移動術
放射線照射に伴う性腺機能障害を軽減させるために,放射線治療開始前に精巣位置移動,卵巣位置移動による性腺への放射線曝露の回避などを検討することが望ましい。いずれも手術により性腺移動するため,創傷治癒としては術後3 日から1 週間ほどの期間を要する。ただし,全身放射線照射(TBI)症例についてはその対象とはならない。
妊孕性温存療法に要する時間を短くするために,事前に小児がん治療を専門とする医師と生殖医療を専門とする医師の連携体制を整え,対象症例を認めた場合,速やかに対応できるよう準備しておくことが望ましい13)。また,本人,家族は診断後の大きな心理的負担の中,短期間の間に妊孕性温存療法に関する意思決定を余儀なくされる13)。こうした状況に配慮して,医師,看護師,がん相談員を含む多職種が連携して,対応にあたる必要がある13)。
以上より,原則として,小児がんの治療を最優先事項として考える中で,原疾患の治療前,または,治療中に妊孕性温存療法を行う時間の猶予があると判断できる状態に限り,妊孕性温存療法のために小児がん治療を調整することが可能であると考えられる。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- Female reproductive health after childhood, adolescent, and young adult cancers: guidelines for the assessment and management of female reproductive complications. J Clin Oncol. 2013; 31: 1239-47
- Male reproductive health after childhood, adolescent, and young adult cancers: a report from the Children’s Oncology Group. J Clin Oncol. 2012; 30: 3408-16
- Children’s Oncology Group. Long-term follow-up guidelines for survivors of childhood, adolescent and young adult cancers, Version 4.0. Arcadia, CA: Children’s Oncology Group; October 2013; Available on-line.
http://www.survivorshipguidelines.org
引用文献
- 1)
- Brasme JF, Chalumeau M, Oberlin O, et al. Time to diagnosis of Ewing tumors in children and adolescents is not associated with metastasis or survival: a prospective multicenter study of 436 patients. J Clin Oncol. 2014; 32: 1935-40 (Ⅳa)
- 2)
- Metzger ML, Meacham LR, Patterson B, et al. Female reproductive health after childhood, adolescent, and young adult cancers: guidelines for the assessment and management of female reproductive complications. J Clin Oncol. 2013; 31: 1239-47 (Ⅳa)
- 3)
- Jeruss JS, Woodruff TK. Preservation of fertility in patients with cancer. N Engl J Med. 2009; 360: 902-11 (Ⅳa)
- 4)
- von Wolff M, Montag M, Dittrich R, et al. Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35 (Ⅳa)
- 5)
- Meirow D, Levron J, Eldar-Geva T, et al. Pregnancy after transplantation of cryopreserved ovarian tissue in a patient with ovarian failure after chemotherapy. N Engl J Med. 2005; 353: 318-21 (Ⅴ)
- 6)
- Demeestere I, Simon P, Buxant F, et al. Ovarian function and spontaneous pregnancy after combined heterotopic and orthotopic cryopreserved ovarian tissue transplantation in a patient previously treated with bone marrow transplantation: case report. Hum Reprod. 2006; 21: 2010-4 (Ⅴ)
- 7)
- Macklon KT, Jensen AK, Loft A, et al. Treatment history and outcome of 24 deliveries worldwide after autotransplantation of cryopreserved ovarian tissue, including two new Danish deliveries years after autotransplantation. J Assist Reprod Genet. 2014; 31: 1557-64 (Ⅴ)
- 8)
- Hyman JH, Tulandi T. Fertility preservation options after gonadotoxic chemotherapy. Clin Med Insights Reprod Health. 2013; 7: 61-9 (Ⅳa)
- 9)
- Jadoul P, Dolmans MM, Donnez J. Fertility preservation in girls during childhood: is it feasible, efficient and safe and to whom should it be proposed? Hum Reprod Update. 2010; 16: 617-30 (レビュー)
- 10)
- Kenney LB, Cohen LE, Shnorhavorian M, et al. Male reproductive health after childhood, adolescent, and young adult cancers: a report from the Children’s Oncology Group. J Clin Oncol. 2012; 30: 3408-16 (Ⅳa)
- 11)
- Schmiegelow ML, Sommer P, Carlsen E, et al. Penile vibratory stimulation and electroejaculation before anticancer therapy in two pubertal boys. J Pediatr Hematol Oncol. 1998; 20: 429-30 (Ⅴ)
- 12)
- Berookhim BM, Mulhall JP. Outcomes of operative sperm retrieval strategies for fertility preservation among males scheduled to undergo cancer treatment. Fertil Steril. 2014; 101: 805-11 (Ⅴ)
- 13)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- CQ4
- 小児がん患者の治療後の妊娠・分娩について,どのような情報を提供すべきか?
- 推奨グレードB
-
- 1.小児がん経験者が妊娠もしくはパートナーが妊娠した場合,がんの治療に伴う出生児の先天異常の有意なリスク増加は観察されていないことを説明する。
- 推奨グレードB
-
- 2.小児がん経験者の女性の妊娠・分娩に際しては,がんの種類,治療時の年齢,治療内容によりリスクが異なることを説明する。
- 推奨グレードB
-
- 3.腹部・骨盤部への放射線照射歴のある女性では,流産・早産のリスクに配慮して妊娠から分娩まで慎重に管理する必要があることを説明する。
背景・目的
小児がんの治療予後改善に伴い長期生存が可能となり,小児がん経験者に挙児を得られる可能性がある。がんの治療による不妊と早発閉経のリスクとともに,妊孕性が維持された場合の妊娠・分娩における母体と出生児の健康問題が注目されている。がん治療に伴う出生児の先天異常の増加は否定的だが,早産のリスク増加などが報告されていることから,海外の大規模コホート研究の結果をもとに,小児がん経験者の妊娠・分娩におけるリスクについて検討した。
解説
小児がん経験者の妊娠・分娩について検討する場合,小児がんの種類,治療を受けた年齢,治療内容(化学療法,放射線治療,外科的治療)等の治療サマリーと,晩期合併症の有無を把握することが重要である。一般に成人のがん患者では,身体の回復に要する時間と再発リスクおよび生殖細胞への影響に配慮し,治療後の妊娠許可まで時間をあけるように指導される。一方,小児期にがんの治療を受けた患者の場合,成人して挙児の可能性について考えるまでには長い時間がある。海外では大規模コホート研究を含む複数の調査において,主に後方視的研究として小児がん経験者の妊娠における先天異常,流産・早産,低出生体重児,新生児死亡のリスクについて検討が行われてきた。
近年がん患者の妊孕性温存療法が注目され,徐々に取り組まれるようになってきた。しかし,小児がん患者における妊孕性温存療法後の妊娠・分娩に関する報告は少なく,エビデンスが十分に確立していない。本邦ではこれまで小児がん患者の妊娠・分娩について大規模調査が行われておらず,また妊孕性温存療法後の小児がん経験者は現時点で少数であることから,今後長期フォローアップ外来における相談支援体制を整備するとともに,長期予後データを集積していく必要がある。以上より,海外でのエビデンスに基づき,小児がん経験者の妊娠・分娩における先天異常,流産・早産,低出生体重児,新生児死亡のリスクについて検索した。
小児がん経験者から出生した児について多数例で検討した代表的な論文によると,がん治療による先天異常のリスク増加は否定的と報告されている1-3)。放射線治療と先天異常のリスクについても有意差なしと報告されている4)。ただし発がんリスクのある遺伝性疾患の場合は,出生児においてもリスクがあるため,遺伝カウンセリングと出生後の注意深いフォローアップが必要である(総論CQ4 参照)。
女性の小児がん経験者の場合,がん治療が妊娠・分娩に影響を及ぼす可能性があるため,症例ごとにリスクを評価する必要がある。特に腹部・骨盤への放射線照射歴を有する場合は,不妊・早発閉経のみならず,妊娠分娩管理に注意が必要である。腹部・骨盤への照射により流産・早産,低出生体重児の増加が認められるとの報告があり5-11),死産・新生児死亡の増加も報告されている5)。子宮への障害の程度は照射部位,線量,治療時の年齢と相関し,子宮と卵巣への10Gy 以上の照射から,また思春期前の女児ではより低線量(1.00〜2.49Gy)からリスクが増加するとも報告されている5)。子宮筋の線維化による伸展障害,子宮容量の減少,血管障害,内膜障害などがその要因と考えられる。胸部への照射歴がある場合は心筋障害について,頭部への照射歴がある場合は下垂体機能異常(治療後の時間経過とともに頻度が増加)や神経認知機能の異常の合併について注意が必要である。
化学療法に関しては,流産・早産,低出生体重児の増加は上記の研究において認めなかったと報告されている。ただし妊娠中は循環血液量が増えるため,蓄積性心毒性のあるアントラサイクリン系抗がん薬による心不全や,白金製剤による腎機能障害など,晩期合併症のリスクに応じた妊娠から分娩までの慎重な母体管理が必要である。
外科的治療に関しては,脳腫瘍に対する術後では下垂体機能異常やてんかんなどの合併について,腹部・骨盤内腫瘍に対する術後では腹腔内癒着による影響や経腟分娩の可否などについて,症例ごとに検討する必要がある。
男性の小児がん経験者の場合,パートナーの女性の妊娠・分娩において,母体の異常および出生児の流産・早産,低出生体重児,新生児死亡のリスクは増加しないと報告されている5, 6, 12, 13)。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Hyman JH, Tulandi T. Fertility preservation options after gonadotoxic chemotherapy. Clin Med Insights Reprod Health. 2013; 7: 61-9
- Hudson MM. Reproductive outcomes for survivors of childhood cancer. Obstet Gynecol. 2010; 116: 1171-83
- blue DM, Sklar CA, Boice JD Jr, et al. Ovarian failure and reproductive outcomes after childhood cancer treatment: results from the Childhood Cancer Survivor Study. J Clin Oncol. 2009; 27: 2374-81
- Bessho F, Kobayashi M. Adult survivors of children’s cancer and their offspring. Pediatr Int. 2000; 42: 121-5
- 岩井艶子.小児がん経験者の結婚,妊娠,分娩,児に関する研究.厚生労働省がん研究助成金報告書(研究代表者 石田也寸志). 2010; 122-123
- Miyoshi Y, Yorifuji T, Horikawa R, et al. Gonadal function, fertility, and reproductive medicine in childhood and adolescent cancer patients: a national survey of Japanese pediatric endocrinologists. Clin Pediatr Endocrinol. 2016; 25: 45-57
- Miyoshi Y, Yorifuji T, Horikawa R, et al. Childbirth and fertility preservation in childhood and adolescent cancer patients: a second national survey of Japanese pediatric endocrinologists. Clin Pediatr Endocrinol. 2017; 26: 81-8
- Children’s Oncology Group. Long-Term Follow-Up Guidelines for Survivors of Childhood, Adolescent, and Young Adult Cancers. Version 4.0. Available at. http://www.survivorshipguidelines.org(accessed August 07, 2016)
- 日本小児内分泌学会CCS 委員会.小児がん経験者(CCS)のための医師向けフォローアップガイド(ver1.2)2016. Available at.
http://jspe.umin.jp/medical/gui.html(accessed October 14, 2016) - 関口将軌,三善陽子,左合治彦.小児がん既往妊娠.周産期医学.2016; 46: 1263-7
- Armenian AH, Hudson MM, Mulder RL, et al. Recommendations for cardiomyopathy surveillance for survivors of childhood cancer: a report from the International Late Effects of Childhood Cancer Guideline Harmonization Group. Lancet Oncol. 2015; 16: e123-36
引用文献
- 1)
- Signorello LB, Mulvihill JJ, blue DM, et al. Congenital anomalies in the children of cancer survivors: a report from the childhood cancer survivor study. J Clin Oncol. 2012; 30: 239-45 (Ⅳa)
- 2)
- Winther JF, Olsen JH, Wu H, et al. Genetic disease in the children of Danish survivors of childhood and adolescent cancer. J Clin Oncol. 2012; 30: 27-33 (Ⅳa)
- 3)
- Winther JF, Boice JD Jr, Mulvihill JJ, et al. Chromosomal abnormalities among offspring of childhood-cancer survivors in Denmark: a population-based study. Am J Hum Genet. 2004; 74: 1282-5 (Ⅳa)
- 4)
- Winther JF, Boice JD Jr, Frederiksen K, et al. Radiotherapy for childhood cancer and risk for congenital malformations in offspring: a population-based cohort study. Clin Genet. 2009; 75: 50-6 (Ⅳa)
- 5)
- Signorello LB, Mulvihill JJ, blue DM, et al. Stillbirth and neonatal death in relation to radiation exposure before conception: a retrospective cohort study. Lancet. 2010; 376: 624-30 (Ⅳa)
- 6)
- Reulen RC, Zeegers MP, Wallace WH, et al; British Childhood Cancer Survivor Study. Pregnancy outcomes among adult survivors of childhood cancer in the British Childhood Cancer Survivor Study. Cancer Epidemiol Biomarkers Prev. 2009; 18: 2239-47 (Ⅳa)
- 7)
- Gao W, Liang JX, Yan Q. Exposure to radiation therapy is associated with female reproductive health among childhood cancer survivors: a meta-analysis study. J Assist Reprod Genet. 2015; 32: 1179-86 (Ⅳa)
- 8)
- blue DM, Lange JM, Peabody EM, et al. Pregnancy outcome after treatment for Wilms tumor: a report from the national Wilms tumor long-term follow-up study. J Clin Oncol. 2010; 28: 2824-30 (Ⅳa)
- 9)
- Mueller BA, Chow EJ, Kamineni A, et al. Pregnancy outcomes in female childhood and adolescent cancer survivors: a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med. 2009; 163: 879-86 (Ⅳa)
- 10)
- Signorello LB, Cohen SS, Bosetti C, et al. Female survivors of childhood cancer: preterm birth and low birth weight among their children. J Natl Cancer Inst. 2006; 98: 1453-61 (Ⅳa)
- 11)
- blue DM, Whitton JA, Stovall M, et al. Pregnancy outcome of female survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. Am J Obstet Gynecol. 2002; 187: 1070-80 (Ⅳa)
- 12)
- Gunnes MW, Lie RT, Bjørge T, et al. Reproduction and marriage among male survivors of cancer in childhood, adolescence and young adulthood: a national cohort study. Br J Cancer. 2016; 114: 348-56 (Ⅳa)
- 13)
- Chow EJ, Kamineni A, Daling JR, et al. Reproductive outcomes in male childhood cancer survivors: a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med. 2009; 163: 887-94 (Ⅳa)
造血器
- 総説
代表的な造血器悪性腫瘍は,白血病および類縁疾患,リンパ腫,骨髄腫に大別される。
白血病は急性骨髄性白血病,急性リンパ性白血病,慢性骨髄性白血病,慢性リンパ性白血病に分類され,本邦における白血病全体の年齢調整罹患率(2011 年)は人口10 万人あたり男性8.0 人,女性5.3 人で,年間約12,000 人が罹患している。60 歳以上での発症が多いものの,40 歳未満の患者が15%(約1,900 人)存在する。
白血病の類縁疾患には骨髄異形成症候群,骨髄増殖性疾患(真性多血症,本態性血小板血症,骨髄線維症)が含まれるが,60 歳以上の高齢者に多い。
リンパ腫はホジキンリンパ腫と非ホジキンリンパ腫に大別される。本邦における年齢調整罹患率(2011 年)は人口10 万人あたり男性13.9 人,女性9.2 人であり,年間約25,000 人が罹患している。40 歳未満の患者は全体の5%程度(約1,400 人)である。
骨髄腫の本邦における年齢調整罹患率(2011 年)は人口10 万人あたり男性3.0 人,女性2.4 人で,年間約7,000 人が罹患している。本疾患は高齢者に好発し,40 歳未満の罹患率は全体の0.7%(約50 人)と極めて稀である。
本ガイドラインにおいて,若年者の発症頻度が極めて少ない疾患については本総説での記述にとどめており,CQ 内では触れていない。CQ1〜CQ5 については,若年者に多い造血器悪性腫瘍に対する治療(化学療法,放射線治療,分子標的治療薬,造血幹細胞移植)の妊孕性への影響と温存方法について,CQ6 では「治療後に妊孕性が温存され妊娠に至った場合,出生児に問題がないのか?」という一つの大きな命題について記述した。
1.疫学
1-1.急性白血病
白血病全体の年齢調整罹患率(2011 年)は人口10 万人あたり男性8.0 人,女性5.3 人であるが1),その中で急性骨髄性白血病の発症頻度は10 万人に3〜4 人,発症年齢中央値は60 歳で大多数は成人発症である2)。それに対して急性リンパ性白血病は10 万人に1 人程度の発症頻度であり,ピークが2〜4 歳と小児に多い傾向がある3)。
1-2.慢性骨髄性白血病
慢性骨髄性白血病の発症年齢中央値は45〜55 歳で,男女比は1.3〜2.0:1 とやや男性に多い傾向があり,発症頻度は年間10 万人に1 人である。小児発症は全体の5%未満と少ない3)。
1-3.骨髄異形成症候群
本邦における発症頻度の正確なデータはないが,10 万人あたり2.7 人で,やや男性に多い傾向と言われている。発症年齢の中央値は60 代で男女比は1.9:1 と男性に多い傾向がある2)。
1-4.骨髄増殖性疾患
真性多血症,本態性血小板血症,骨髄線維症のいずれも50〜60 代での発症が多く,妊孕性温存が問題になるケースは多くない。しかし,本態性血小板血症に関しては40 歳未満の患者が10〜25%を占めると報告されている2)。
1-5.リンパ腫
本邦におけるリンパ腫全体の年齢調整罹患率(2011 年)は人口10 万人あたり男性13.9 人,女性9.2 人である1)。ホジキンリンパ腫の発生頻度は欧米と比べ低く,人口10 万人あたり0.2〜0.5 人と推定されている2)。男女比は1.3〜1.8:1 とやや男性に多い。発症年齢においては,15〜35 歳と50 歳以降の2 相性パターンをとるとされる3)。非ホジキンリンパ腫については多彩な病型を含むため正確なデータはないが,ホジキンリンパ腫がリンパ腫全体の5%前後の頻度と考えられていることから,人口10 万人あたり10 人前後の発症と推定される。
*CQ 番号をクリックすると解説画面へ移動します。
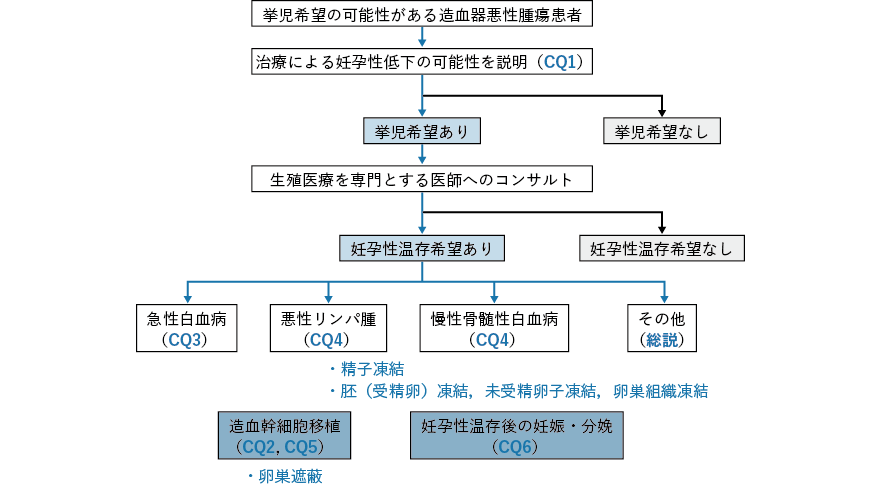
1-6.多発性骨髄腫
骨髄腫の本邦における年齢調整罹患率(2011 年)は人口10 万人あたり男性3.0 人,女性2.4 人である1)。60〜70 代の高齢者に多く2),男女比は1.2:1 で男性にやや多い。ごく稀ではあるが若年発症の多発性骨髄腫も存在する。
2.病態
2-1.急性白血病
急性白血病は,分化・成熟が障害された造血系細胞が異常増殖する腫瘍性疾患である。主な自覚症状は,正常造血機能の低下による貧血,血小板減少による出血傾向,好中球減少による感染症であるが,腫瘍細胞の臓器浸潤により様々な全身症状を呈することがある2, 3)。
2-2.慢性骨髄性白血病
健診時の血液検査における白血球数増加がきっかけになることが多く,80%以上の症例が慢性期で診断され,多くは無症状である2)。無治療では最終的に急性転化し,急性白血病の病態となる。
2-3.骨髄異形成症候群
骨髄異形成症候群は無効造血を特徴とする腫瘍性の造血障害である。正常造血機能の低下による貧血,血小板減少による出血傾向,好中球減少による感染症に加え,急性白血病への進展が問題となる2, 3)。
2-4.骨髄増殖性疾患
骨髄増殖性疾患は造血幹細胞レベルでの腫瘍化によって生じる。真性多血症は,血液粘稠度の亢進による血流うっ滞症状および二次的な高血圧,血栓塞栓が起こる。骨髄線維症は脾腫,全身倦怠感が主症状である。本態性血小板血症は,頭痛などの血管運動性症状,および血栓・出血症状が問題となる2, 3)。
2-5.リンパ腫
ホジキンリンパ腫は頸部,縦隔リンパ節腫脹の他,いわゆるB 症状(発熱,体重減少,盗汗)を伴うことも多い。非ホジキンリンパ腫は全身のリンパ節に発症するだけでなく,リンパ節以外の諸臓器にも発症し得る。リンパ腫細胞の臓器浸潤による様々な全身症状の他,腫大したリンパ節による周辺臓器の圧迫症状が問題になることもある2, 3)。
2-6.多発性骨髄腫
骨髄にて形質細胞がクローン性に増殖する腫瘍性疾患で,易感染性や貧血などの他,二次性に骨病変や腎障害が問題となる2, 3)。
3.治療
3-1.急性白血病
骨髄性・リンパ性で使用する抗がん薬が異なる。急性骨髄性白血病の治療は,アントラサイクリンとシタラビンの併用療法による寛解導入療法,その後に地固め療法を3〜4 サイクル行うのが一般的である4)。一方,急性リンパ性白血病においては,アントラサイクリン,ビンクリスチン,シクロホスファミド,L-アスパラギナーゼなど寛解導入の段階から多剤併用となる。寛解後療法では,寛解導入療法で用いた薬剤に加え,シタラビン,メトトレキサート,6-メルカプトプリンなどが用いられる3)。急性白血病に対する主な標準的化学療法の妊孕性への影響,および注意を要する薬剤についてはCQ1 で取り上げた。
急性白血病における妊孕性温存の最大の問題点は,そのタイミングである。多くの急性白血病患者は,診断確定後速やかな治療開始を要するため,特に女性においては治療開始前の妊孕性温存は現実的ではない。このような背景においての妊孕性温存について,CQ3 で取り上げた。また予後不良因子をもつ例,再発・難治例においては造血幹細胞移植が考慮されるため,その影響および妊孕性温存療法に関してはCQ2,CQ5 で述べた。
3-2.慢性骨髄性白血病
慢性骨髄性白血病は骨髄増殖性疾患の一病型であるが,他疾患と治療法を大きく異にする。標準治療はチロシンキナーゼ阻害薬で,その第一世代であるイマチニブの導入以後,造血幹細胞移植の適応となる患者は激減している。近年ではさらに高い治療効果を示す第二世代のニロチニブ,ダサチニブ,さらにボスチニブ,ポナチ二ブと新規薬剤が次々と登場している4)。これらの薬剤の妊孕性への影響は未だ結論が出ておらず,若年者に対する使用においては妊孕性を考慮する必要があるため,注意喚起の意味も込めてCQ4 で取り上げた。
3-3.骨髄異形成症候群
近年使用頻度が急速に増加している脱メチル化阻害薬のアザシチジンについては,妊孕性への影響に関する報告がほとんど見当たらない。また,本疾患に対する根治可能な治療は同種造血幹細胞移植に限られるため,若年者については診断時から妊孕性に関して考慮しておく必要がある。
3-4.骨髄増殖性疾患
真性多血症は瀉血,ハイドロキシウレアによる循環赤血球量コントロールが行われるが,40 歳未満の発症が5%程度であり妊孕性温存が問題になることは少ない。本態性血小板血症に関しては,40 歳未満の患者が10〜25%を占めると報告されている。現在,本疾患に対して使用される薬剤はハイドロキシウレア,アナグレリドの2 剤である4)。ハイドロキシウレアについては催奇形性の報告があるのみならず,男性の鎌状赤血球症患者において一時的な無精子症の報告が少数ある。アナグレリドについては妊孕性に関する報告がなく,影響の有無は不明である。
3-5.リンパ腫
ホジキンリンパ腫においては,寛解導入に使用される標準治療はABVD 療法(ドキソルビシン,ブレオマイシン,ビンブラスチン,ダカルバジン)に代表される化学療法であるが4),放射線治療の追加が考慮されることがある。非ホジキンリンパ腫は多くの疾患単位が含まれ,治療内容もその組織型により異なる。最も頻度の高い,びまん性大細胞型においては,リツキシマブ併用CHOP 療法(シクロホスファミド,ドキソルビシン,ビンクリスチン,プレドニゾロン)が基本となるが4),組織型ごとに最適な化学療法が検討されており,予定治療によって妊孕性への影響を個々に判断する必要がある。治療の妊孕性への影響はCQ1,考慮される妊孕性温存療法に関してはCQ4 で取り上げた。
3-6.多発性骨髄腫
近年,多発性骨髄腫はボルテゾミブ,レナリドミドなど新規薬剤の開発により奏効が得られるようになってきた4)。若年発症の多発性骨髄腫においては,大量メルファランによる前処置+自家末梢血幹細胞移植4)を考慮することになるため,できるだけ早期に妊孕性温存を考慮することが望ましい。
引用文献
- 1)
- がん情報サービス.がんの統計 ’15. http://ganjoho.jp/reg_stat/statistics/brochure/backnumber/2015_jp.html
- 2)
- 杉本恒明,矢崎義雄 総編集.内科学 第九版.朝倉書店,東京,2007
- 3)
- 浅野茂隆,池田康夫,内山 卓 監修.三輪血液病学 第3 版.文光堂,東京,2006
- 4)
- 日本血液学会編.造血器腫瘍診療ガイドライン2013 年版.金原出版,東京,2013
- CQ1
- どのような造血器悪性腫瘍患者が妊孕性温存の適応となるか?
- 推奨グレードC1
-
- 1.疾患を問わず,可能な限り治療開始前に妊孕性温存を考慮する。
- 推奨グレードC1
-
- 2.治療開始前に妊孕性温存ができなかった場合,治療方針変更に際しては再度,妊孕性温存を考慮する。
背景・目的
造血器悪性腫瘍に対する治療には,化学療法,放射線治療,分子標的治療が含まれる。さらに,造血器悪性腫瘍に特徴的な治療として造血幹細胞移植がある。急性白血病,非ホジキンリンパ腫,ホジキンリンパ腫に対する標準化学療法による造精機能や月経への影響は低リスク群に分類されているが,プロカルバジンを含むホジキンリンパ腫に対する化学療法,性腺あるいは骨盤腔を照射野に含む放射線治療,造血幹細胞移植の前処置では,男女ともに妊孕性は著明に低下する。
このように,同一疾患患者においても治療経過によっては妊孕性に大きな影響を及ぼす治療へと進む可能性があることから,どのような造血器悪性腫瘍患者が妊孕性温存の適応となるかを検討した。
解説
2006 年の米国臨床腫瘍学会(American Society of Clinical Oncology:ASCO)ガイドライン,2010 年のLevine らのレビュー,および2013 年のASCO ガイドラインUpdate をもとに,造血器腫瘍に対する治療の妊孕性に及ぼす影響を表7-1 および表7-2 に示す。
女性における薬剤による遷延性無月経については,多くの造血器腫瘍に対しての標準治療が低リスク(<30%)に分類されるが,造血幹細胞移植前処置やプロカルバジンを含むCOPP 療法(シクロホスファミド,ビンクリスチン,プロカルバジン,プレドニゾロン),BEACOPP 療法(ブレオマイシン,エトポシド,ドキソルビシン,COPP 療法の4 剤)などは高リスク(>70%)に分類される。放射線治療については,成人で6Gy,思春期後女子で10Gy の腹部骨盤への照射は高リスクに分類されている(表7-1)。


これらの分類の根拠となる報告の多くは,いずれもエビデンスレベルは高くなく,急性骨髄性白血病に対するアントラサイクリン+シタラビン療法1),非ホジキンリンパ腫に対するCHOP 療法2)(シクロホスファミド,ドキソルビシン,ビンクリスチン,プレドニゾロン)やhCVAD 療法3)(シクロホスファミド,ドキソルビシン,ビンクリスチン,デキサメタゾン)などが低リスクである根拠はいずれも少数の後方視的コホート研究の結果である。最も多くの知見が蓄積されているホジキンリンパ腫では,ABVD 療法(ドキソルビシン,ブレオマイシン,ビンブラスチン,ダカルバジン)は低リスクに分類されるが,標準量で不妊の高リスクとなるアルキル化薬を含む治療レジメンは高リスクであるとともに,影響が特に30 歳以上で強く表れることが示されている4, 5)。
男性においては,造血幹細胞移植前処置,プロカルバジンを用いる化学療法,2.5Gy 以上の精巣への放射線治療(男児では6Gy 以上)にて遷延性の無精子症となる。一方,標準量で不妊の高リスクとなるアルキル化薬と放射線を使用しない治療においては,その影響は限定的であり,急性白血病,リンパ腫に対する標準的な化学療法の造精機能への影響は,一時的で低リスクであることが示されている(表7-2)。
造血幹細胞移植に関しては,前処置の内容による差はあるものの,高率に不可逆的な妊孕性低下が起こる(CQ2 参照)。
妊孕性への影響の強さは抗がん薬の種類や投与量,放射線の照射線量,さらに患者の年齢によっても異なるため,疾患を問わず,可能な限り治療前に妊孕性低下のリスクを説明し,妊孕性温存の意思確認と機会の提供を行うことが望ましい。妊孕性温存療法施行の時期には十分な注意を要する。急性白血病や中・高悪性度リンパ腫においては疾患の進行が急速であるため,治療開始前の妊孕性温存は非現実的である。治療開始の遅れは生命予後に影響するため原疾患治療を優先するべきであること,および妊孕性温存のタイミングは治療開始前に限られたものではないこと,を患者に伝える必要がある。
慢性骨髄性白血病治療薬であるチロシンキナーゼ阻害薬については,2013 年ASCO ガイドラインUpdate においても第一世代のイマチニブがリスク不明に分類されている。第二世代以降の薬剤(ニロチニブ,ダサチニブなど)に関しての知見はさらに不十分で,妊孕性への影響は未だ定まっていない。イマチニブにおいて動物モデルで報告された催奇形性についても,第二世代以降の薬剤については十分な知見が存在しない6)。長期データが揃うまでは,これらのことを患者に説明し,希望があれば治療開始前の妊孕性温存を検討する。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- 3)
- Fertility considerations in young women with hematological malignancies. J Assist Reprod Genet. 2012; 29: 479-87
- Loren AW. Fertility issues in patients with hematologic malignancies. Hematology Am Soc Hematol Educ Program, 2015. 2015: 138-45
- 神田善伸.がんサバイバーの妊孕性-造血器腫瘍患者の妊孕性温存対策.癌と化学療法.2015; 42: 261-6
引用文献
- 1)
- Leung W, Hudson MM, Strickland DK, et al. Late effects of treatment in survivors of childhood acute myeloid leukemia. J Clin Oncol. 2000; 18: 3273-9 (Ⅳa)
- 2)
- Elis A, Tevet A, Yerushalmi R, et al. Fertility status among women treated for aggressive non-Hodgkin’s lymphoma. Leuk Lymphoma. 2006; 47: 623-7 (Ⅳa)
- 3)
- Seshadri T, Hourigan MJ, Wolf M, et al. The effect of the Hyper-CVAD chemotherapy regimen on fertility and ovarian function. Leuk Res. 2006; 30: 483-5 (Ⅴ)
- 4)
- Haukvik UK, Dieset I, Bjøro T, et al. Treatment-related premature ovarian failure as a long-term complication after Hodgkin’s lymphoma. Ann Oncol. 2006; 17: 1428-33 (Ⅳa)
- 5)
- Behringer K, Breuer K, Reineke T, et al; German Hodgkin’s Lymphoma Study Group. Secondary amenorrhea after Hodgkin’s lymphoma is influenced by age at treatment, stage of disease, chemotherapy regimen, and the use of oral contraceptives during therapy: a report from the German Hodgkin’s Lymphoma Study Group. J Clin Oncol. 2005; 23: 7555-64 (Ⅳb)
- 6)
- Palani R, Milojkovic D, Apperley JF. Managing pregnancy in chronic myeloid leukaemia. Ann Hematol. 2015; 94 Suppl 2: S167-76 (Ⅵ)
- CQ2
- 造血幹細胞移植が妊孕性に及ぼす影響について,どのような情報提供をすべきか?
- 推奨グレードB
-
- 1.男女ともに,不可逆的な妊孕性の障害が高率で生じることを説明する。
- 推奨グレードC1
-
- 2.強度減弱前処置(reduced intensity conditioning:RIC)により妊孕性が温存されるかどうかは不明であることを説明する。
背景・目的
造血幹細胞移植では前処置で大量化学療法や全身放射線照射(total body irradiation:TBI)が行われ,通常のがん治療と比べ妊孕性に対する影響は大きい。移植治療の成績向上に伴い長期サバイバーが増えており,妊孕性の喪失はquality of life(QOL)に大きな影響を及ぼすことから,造血幹細胞移植が妊孕性に及ぼす影響について,どのように説明すべきかを検討した。
解説
以下に男女別の影響を述べるが,移植前の妊孕性について検討されていないなど正確な評価は難しい。
1.女性の卵巣機能への影響
Borgmann-Staudt らの後方視的研究によると,同種移植後に妊孕性の障害は83%(追跡期間中央値移植後6 年)にみられた1)。また,Jadoul らの単施設の横断研究によると,19 歳未満で移植を受けた女性では,46%(35 例中16 例)が移植後卵巣機能を維持したが,移植後10 年では36%に低下した2)。女性においても移植前処置で用いられるTBI と大量ブスルファンの影響は大きい。ブスルファンにより卵巣機能はほぼ障害される3-5)。TBI を受けた女性は10〜14%で卵巣機能が回復する6)。Sanders らの単施設の後方視的研究では,10Gy 以上のTBI を受けた女性の10%で卵巣機能が回復した5)。Sarafoglou らの単施設の後方視的研究では,思春期前ではTBI の妊孕性への影響は少なく,56%が卵巣機能を保持した7)。シクロホスファミド単独の前処置では半数以上に回復が期待され,特に25 歳未満の若年で高率である6)。年齢に関し,治療開始時年齢(≧13 歳)1)や移植時年齢(>10 歳)2)が卵巣機能不全のリスク因子として報告されている。なお,既述のSanders らの報告では,移植後の妊娠率は4.5%であった5)。
2.男性の精子形成への影響
Borgmann-Staudt らの多施設の後方視的研究によると,同種移植後に妊孕性の障害は69%(追跡期間中央値移植後6 年)にみられた1)。また,European Group for Blood and Marrow Transplantation(EBMT)の後方視的研究によると,同種移植後期間中央値63 カ月で無精子症が69%にみられた。移植後の時間経過とともに精子形成は回復傾向にあり,無精子症はのちに回復する可能性がある8)。精子形成に大きな影響を与えるのは,移植前処置で用いられるTBI と大量ブスルファンである。TBI を受けた81%が無精子症で,正常は1%のみであり,7.5Gy 以上のTBI が無精子症の最大のリスク因子であった8)。また,Anserini らの単施設の後方視的研究では,同種移植後の無精子症は,前処置がシクロホスファミド+ブスルファンまたはthiotepa(本邦未承認)では50%(移植後期間中央値4.6 年),シクロホスファミド単独では10%(移植後期間中央値2.5 年)であったと報告している9)。その他のリスク因子として,移植時年齢25〜30 歳より上と,非TBI 症例での慢性移植片対宿主病が示されている8, 10)。上述のEBMT からの報告では,211 人の同種移植患者のうち14%が子どもを有し,移植後中央値7.2 年(1〜21.6 年)で第一子を得た(11 人が自然妊娠,11 人が凍結保存した精子を用いて。7 人は不明)8)。
3.RIC について
近年は若年者に対してもRIC が増えているが,骨髄破壊的前処置と比較し,妊孕性が温存されるかどうかは不明である。現状ではRIC のほとんどはフルダラビンとアルキル化薬(ブスルファン,シクロホスファミド,メルファラン)の併用で行われており,卵巣機能不全が10%11)や37.5%12)と低い報告もあるが,86%との報告もある13)。アルキル化薬のなかでも卵巣毒性が著しく強いブスルファンと,比較的弱いシクロホスファミドやメルファランの間に大きな差があり,それが報告による卵巣機能不全の頻度の差につながっているのかもしれない。いずれも少数例の報告である。また,無精子症に関する報告も乏しく,今後の症例の集積が待たれる。一方で,多くの疾患でRIC では造血器腫瘍の再発率が上昇することが示されており,妊孕性温存のみを目的としたRIC の適用は一般的には推奨されない。
参考にした二次資料
Joshi S, Savani BN, Chow EJ, et al. Clinical guide to fertility preservation in hematopoietic cell transplant recipients. Bone Marrow Transplant. 2014; 49: 477-84
引用文献
- 1)
- Borgmann-Staudt A, Rendtorff R, Reinmuth S, et al. Fertility after allogeneic haematopoietic stem cell transplantation in childhood and adolescence. Bone Marrow Transplant. 2012; 47: 271-6 (Ⅳb)
- 2)
- Jadoul P, Anckaert E, Dewandeleer A, et al. Clinical and biologic evaluation of ovarian function in women treated by bone marrow transplantation for various indications during childhood or adolescence. Fertil Steril. 2011; 96: 126-33 (Ⅳb)
- 3)
- Thibaud E, Rodriguez-Macias K, Trivin C, et al. Ovarian function after bone marrow transplantation during childhood. Bone Marrow Transplant. 1998; 21: 287-90 (Ⅴ)
- 4)
- Teinturier C, Hartmann O, Valteau-Couanet D, et al. Ovarian function after autologous bone marrow transplantation in childhood: high-dose busulfan is a major cause of ovarian failure. Bone Marrow Transplant. 1998; 22: 989-94 (Ⅳb)
- 5)
- Sanders JE, Hawley J, Levy W, et al. Pregnancies following high-dose cyclophosphamide with or without highdose busulfan or total-body irradiation and bone marrow transplantation. Blood. 1996; 87: 3045-52 (Ⅳb)
- 6)
- Socie G, Salooja N, Cohen A, et al. Nonmalignant late effects after allogeneic stem cell transplantation. Blood. 2003; 101: 3373-85 (レビュー)
- 7)
- Sarafoglou K, Boulad F, Gillio A, et al. Gonadal function after bone marrow transplantation for acute leukemia during childhood. J Pediatr. 1997; 130: 210-6 (Ⅳb)
- 8)
- Rovó A, Aljurf M, Chiodi S, et al. Ongoing graft-versus-host disease is a risk factor for azoospermia after allogeneic hematopoietic stem cell transplantation: a survey of the Late Effects Working Party of the European Group for Blood and Marrow Transplantation. Haematologica. 2013; 98: 339-45 (Ⅳb)
- 9)
- Anserini P, Chiodi S, Spinelli S, et al. Semen analysis following allogeneic bone marrow transplantation. Additional data for evidence-based counselling. Bone Marrow Transplant. 2002; 30: 447-51 (Ⅳb)
- 10)
- Savani BN, Kozanas E, Shenoy A, et al. Recovery of spermatogenesis after total-body irradiation. Blood. 2006; 108: 4292-3 (Ⅳa)
- 11)
- Phelan R, Mann E, Napurski C, et al. Ovarian function after hematopoietic cell transplantation: a descriptive study following the use of GnRH agonists for myeloablative conditioning and observation only for reduced-intensity conditioning. Bone Marrow Transplant. 2016; 51: 1369-75 (Ⅳa)
- 12)
- Cheng YC, Saliba RM, Rondón G, et al. Low prevalence of premature ovarian failure in women given reduced-intensity conditioning regimens for hematopoietic stem-cell transplantation. Haematologica. 2005; 90: 1725-6 (Ⅳb)
- 13)
- Assouline E, Crocchiolo R, Prebet T, et al. Impact of reduced-intensity conditioning allogeneic stem cell transplantation on women’s fertility. Clin Lymphoma Myeloma Leuk. 2013; 13: 704-10 (Ⅴ)
- CQ3
- 挙児希望を有する急性白血病患者に勧められる妊孕性温存療法は?
- 推奨グレードB
-
- 1.初回の標準的な化学療法では妊孕性は保たれることが多いが,施設として可能であれば,生殖医療を専門とする医師への迅速な相談が推奨される。
- 推奨グレードB
-
- 2.パートナーがいる女性患者では,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 3.パートナーがいない女性患者では,未受精卵子凍結保存が考慮される。
- 推奨グレードC2
-
- 4.パートナーの有無にかかわらず,卵巣組織凍結保存は将来的な技術の発展に期待して一部の施設で研究的に行われているが,白血病細胞の混入の危険性のために一般的には推奨されない。
- 推奨グレードC2
-
- 5.Gonadotropin releasing hormone(GnRH)アゴニストの使用は月経コントロール目的に考慮されるが,妊孕性温存目的での使用は推奨されない。
- 推奨グレードB
-
- 6.男性患者では,可能な限り治療前に精子凍結保存が推奨される。
背景・目的
急性白血病の治療は,若年期の患者を対象にすることも多い。治癒を目指すためには,まずは完全寛解を得ることが重要で,早急に殺細胞薬を用いた強力な併用化学療法が必要になる。特に女性患者においては治療開始前に妊孕性温存の時間的猶予はない。妊孕性低下リスクが高い治療の可能性がある急性白血病において,勧められる妊孕性温存療法を検討した。
解説
女性患者の場合,アルキル化薬の使用量は比較的少ないため,急性骨髄性白血病と急性リンパ性白血病に対する標準的な化学療法で永続的不妊になる可能性は30%未満である。しかし,アントラサイクリン系薬剤やその他の抗がん薬使用により,妊孕性を保持できる期間が短縮する可能性があるため,早発閉経リスクの説明を含めた患者に対するカウンセリングは必要である。男性患者の場合は,性腺機能不全に至る可能性は低く,化学療法直後に精子形成能は低下するが,徐々に回復することが多い1-4)。
女性患者には胚(受精卵)凍結保存と未受精卵子凍結保存も選択肢に挙がるが,採卵までに2 週間程度必要なため,急性白血病の初発時にそのタイミングを計ることは困難である。さらに血小板減少や凝固異常を合併している場合は採卵自体がリスクとなる1, 5)。治療後に採取を施行することは可能である。施設的に可能であれば,初回治療時から,あるいは完全寛解到達後に,一連の治療終了後の方針を生殖医療を専門とする医師と相談することが推奨される1)。パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。
卵巣組織凍結保存は,卵巣への腫瘍細胞の混入のリスクがあるため急性白血病患者では推奨されていないが1, 6),将来的な技術の発展に期待して一部の施設で研究的に行われている。Dolmans らは391 例の悪性腫瘍患者に対する卵巣組織凍結を報告しているが,そのうち39 名が急性白血病であった7)。さらにGreve らも21 例の急性白血病を含む25 例の造血器悪性腫瘍に対する卵巣組織凍結の実施を報告している8)。最近ではデンマークから176 名の卵巣組織凍結の後方視的コホート研究が報告されているが,そのうち30 例は急性白血病を含んでいる9)。これらのグループにより卵巣組織への白血病細胞混入リスクが検討されている。寛解期に採取された卵巣組織においては白血病細胞の混入の可能性が低いとの報告はあるものの,最終的な結論には至っておらず,これまでのところ白血病患者に対する卵巣組織移植の報告はない。本邦においても,最終的に造血幹細胞移植が必要となった場合には卵巣機能の廃絶リスクが非常に高いことを鑑み,卵巣移植を前提としない卵巣組織凍結が各施設の倫理委員会で審査のもと既に行われている。
急性白血病患者の寛解導入療法ではGnRH アゴニストや経口避妊薬の投与は,重篤な子宮出血の予防として実臨床で用いられるが,卵巣保護による妊孕性温存目的での使用は推奨されない。
男性患者では精子保存が選択肢として挙げられる。簡便で有用な方法である1)。化学療法後は良質な精子を数多く得ることが困難と予想され,可能な限り初回化学療法前の保存が推奨される10)。治療開始前に精子凍結保存が実施できなかった場合には,高リスク治療開始前に再度精子凍結保存の適応を検討することが望ましい。
参考にした二次資料
なし
引用文献
- 1)
- Loren AW. Fertility issues in patients with hematologic malignancies. Hematology Am Soc Hematol Educ Program, 2015. 2015: 138-45 (Ⅵ)
- 2)
- Rossi BV, Missmer S, Correia KF, et al. Ovarian reserve in women treated for acute lymphocytic leukemia or acute myeloid leukemia with chemotherapy, but not stem cell transplantation. ISRN Oncol. 2012; 2012: 956190(Ⅳb)
- 3)
- Blumenfeld Z. Chemotherapy and fertility. Best Pract Res Clin Obstet Gynaecol. 2012; 26: 379-90 (Ⅵ)
- 4)
- Leader A, Lishner M, Michaeli J, et al. Fertility considerations and preservation in haemato-oncology patients undergoing treatment. Br J Haematol. 2011; 153: 291-308 (Ⅵ)
- 5)
- 中山一隆,上野直人.血液疾患の治療と妊孕性.臨床血液.2008; 49: 182-92 (Ⅵ)
- 6)
- ISFP Practice Committee, Kim SS, Donnez J, et al. Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8 (Ⅵ)
- 7)
- Dolmans MM, Marinescu C, Saussoy P, et al. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe. Blood. 2010; 116: 2908-14 (Ⅴ)
- 8)
- Greve T, Clasen-Linde E, Andersen MT, et al. Cryopreserved ovarian cortex from patients with leukemia in complete remission contains no apparent viable malignant cells. Blood. 2012; 120: 4311-6 (Ⅴ)
- 9)
- Jensen AK, Rechnitzer C, Macklon KT, et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: focus on pubertal development. Hum Reprod. 2017; 32: 154-64 (Ⅳb)
- 10)
- 神田善伸.がんサバイバーの妊孕性-造血器腫瘍患者の妊孕性温存対策.癌と化学療法.2015; 42: 261-6 (Ⅵ)
- CQ4
- 挙児希望を有するその他の造血器悪性腫瘍患者に勧められる妊孕性温存療法は?
リンパ腫
- 推奨グレードB
-
- 1.パートナーがいる女性患者では,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.パートナーがいない女性患者では,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 3.パートナーの有無にかかわらず,卵巣組織凍結保存は研究段階であるものの,胚(受精卵)または未受精卵子凍結保存までの時間的猶予がない場合や思春期前など排卵誘発が困難な場合,施行可能な施設において考慮される。
- 推奨グレードC2
-
- 4.GnRH アゴニストの使用は月経コントロール目的に考慮されるが,妊孕性温存目的での使用は推奨されない。
- 推奨グレードB
-
- 5.男性患者では,可能な限り治療前に精子凍結保存が推奨される。
慢性骨髄性白血病
(分子標的治療薬の妊孕性への影響が不明であることを患者に説明し,妊孕性温存療法を希望する場合)
- 推奨グレードB
-
- 1.分子標的治療薬治療開始前に,パートナーがいる女性患者では,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.分子標的治療薬治療開始前に,パートナーがいない女性患者では,未受精卵子凍結保存が考慮される。
- 推奨グレードB
-
- 3.男性患者では,可能な限り治療前に精子凍結保存が推奨される。
背景・目的
妊娠可能年齢に好発する急性白血病以外の造血器腫瘍として,リンパ腫および慢性骨髄性白血病を取り上げた。それ以外の造血器腫瘍については,好発年齢が高齢であり妊孕性に関する情報はほとんどないため,本CQ では取り上げず,総説で解説を加えた。
リンパ腫において,低リスクに分類される治療(CQ1 参照)は妊孕性が保たれる可能性が高く,不必要に治療延期をすべきではない。しかし,治療経過によって高リスクに分類されるアルキル化薬や造血幹細胞移植へと進む可能性は否定できない。
慢性骨髄性白血病に対するイマチニブの催奇形性は明らかになっている。第二世代以降のチロシンキナーゼ阻害薬の催奇形性および妊孕性に対する影響は定まっていない。今後もさらに多くの分子標的治療薬が登場してくると思われ,個々の薬剤の催奇形性,妊孕性に注意する必要がある。
これらの背景のある両疾患において勧められる妊孕性温存療法を検討した。
解説
女性患者の妊孕性温存療法については,胚(受精卵)凍結,および未受精卵子凍結保存が第一選択となる。2006 年のEuropean Society of Human Reproduction and Embryology(ESHRE)の報告は一般的な胚(受精卵)凍結保存では,凍結融解胚あたり約20%の妊娠と,10%強の生児獲得が示されており1),悪性リンパ腫患者においてもそれに準じた挙児可能性が期待されている。パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。
卵巣組織凍結については研究段階である。Dolmans らは2012 年までに計391 例の悪性疾患に対する卵巣組織凍結を報告しているが,そのうち111 例にリンパ腫患者が含まれている2)。卵巣組織移植により生児を得た報告にもリンパ腫患者は少なくない3)。2013 年にRosendahl らは,33 例と少数例ではあるものの,移植された凍結卵巣組織による再発の報告はなかったと報告している4)。さらに,2017 年にはデンマークの15 年間全176 例の卵巣組織凍結の後方視的コホート研究が発表されたが,そのうち31 例はリンパ腫患者であった5)。本邦においても,2016 年4 月現在,全国20 施設で行われている(日本がん・生殖医療学会WEB サイト)が,卵子保存を行う時間的猶予のない患者において今後症例数の増加が予想される。
GnRH アゴニストに関してはこれまで評価が一定しなかったが,最近,前方視的ランダム化比較試験(randomized controlled trial:RCT)の5 年フォローアップの最終解析が報告された。ホジキンリンパ腫,非ホジキンリンパ腫をともに含む計129 例がエントリーし,最低2 年のフォローアップが可能であった67 例(GnRH アゴニスト群:32 例,コントロール群:35 例)が評価可能であった。Anti-müllerian hormone(AMH),follicle stimulating hormone(FSH)レベルは両群で同等で,妊娠率にも有意差がなかったことから,GnRH アゴニストの優位性は示されなかった6)。
男性患者の妊孕性温存療法については,最近のEuropean Organization for Research and Treatment of Cancer(EORTC)-GELA Lymphoma Group のコホート研究において,挙児希望がありながら自然挙児のない男性ホジキンリンパ腫の長期サバイバー78 名のうち,48 名(62%)が凍結精子を用いて挙児に成功していると報告された7)。悪性リンパ腫を1/3 含むコホートを用いた別の研究においても同様に60%を上回る挙児率が報告されており8),その簡便性からも精子凍結保存は男性における妊孕性温存療法の第一選択である。化学療法後は良質な精子を数多く得ることが困難と予想され,可能な限り初回化学療法前の保存が推奨される。治療開始前に精子凍結保存が実施できなかった場合には,高リスク治療開始前に再度精子凍結保存の適応を検討することが望ましい。
慢性骨髄性白血病に著効するチロシンキナーゼ阻害薬の妊孕性への影響について明らかにされているのは,男性患者のイマチニブ治療は問題がないことのみである。特に近年第一選択薬として用いられる第二世代チロシンキナーゼ阻害薬(ダサチニブ,ニロチニブ)に関するデータは男性患者,女性患者ともに乏しく,長期データが揃うまでは妊孕性への影響が不明であることを患者に説明し,希望があれば治療開始前の妊孕性温存を考慮することが望ましい9)。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network FertiPROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
- ISFP の指針(JARG 誌)
- 1)
- Recommendations for fertility preservation in patients with lymphoma, leukemia, and breast cancer. J Assist Reprod Genet. 2012; 29: 465-8
- 2)
- Recommendations for fertility preservation in patients with lymphomas. J Assist Reprod Genet. 2012; 29: 473-7
- Loren AW. Fertility issues in patients with hematologic malignancies. Hematology Am Soc Hematol Educ Program, 2015. 2015: 138-45
- 中山一隆,上野直人.血液疾患の治療と妊孕性.臨床血液.2008; 49: 182-92
- 品川克至.造血器腫瘍学-基礎と臨床の最新研究動向-造血器腫瘍治療に伴う不妊とその対策.日本臨床.2012; 70(増刊2. 造血器腫瘍学): 767-76
引用文献
- 1)
- de Mouzon J, Goossens V, Bhattacharya S, et al. European IVF-monitoring(EIM)Consortium, for the European Society of Human Reproduction and Embryology(ESHRE). Assisted reproductive technology in Europe, 2006: results generated from European registers by ESHRE. Hum Reprod. 2010; 25: 1851-62 (Ⅳa)
- 2)
- Dolmans MM, Jadoul P, Gilliaux S, et al. A review of 15 years of ovarian tissue bank activities. J Assist Reprod Genet. 2013; 30: 305-14 (Ⅴ)
- 3)
- Jensen AK, Macklon KT, Fedder J, et al. 86 successful births and 9 ongoing pregnancies worldwide in women transplanted with frozen-thawed ovarian tissue: focus on birth and perinatal outcome in 40 of these children. J Assist Reprod Genet. 2016. doi: 10. 1007.[ Epub ahead of print] (Ⅴ)
- 4)
- Rosendahl M, Greve T, Andersen CY. The safety of transplanting cryopreserved ovarian tissue in cancer patients: a review of the literature. J Assist Reprod Genet. 2013; 30: 11-24 (Ⅵ)
- 5)
- Jensen AK, Rechnitzer C, Macklon KT, et al. Cryopreservation of ovarian tissue for fertility preservation in a large cohort of young girls: focus on pubertal development. Hum Reprod. 2017; 32: 154-64 (Ⅳa)
- 6)
- Demeestere I, Brice P, Peccatori FA, et al. No Evidence for the Benefit of Gonadotropin-Releasing Hormone Agonist in Preserving Ovarian Function and Fertility in Lymphoma Survivors Treated With Chemotherapy: Final Long-Term Report of a Prospective Randomized Trial. J Clin Oncol. 2016; 34: 2568-74 (Ⅱ)
- 7)
- van der Kaaij MA, van Echten-Arends J, Heutte N, et al. European Organisation for Research and Treatment of Cancer Lymphoma Group andthe Groupe d’Étude des Lymphomes de l’Adulte. Cryopreservation, semen use and the likelihood of fatherhood in male Hodgkin lymphoma survivors: an EORTC-GELA Lymphoma Group cohort study. Hum Reprod. 2014; 29: 525-33 (Ⅳa)
- 8)
- García A, Herrero MB, Holzer H, et al. Assisted reproductive outcomes of male cancer survivors. J Cancer Surviv. 2015; 9: 208-14 (Ⅳb)
- 9)
- Palani R, Milojkovic D, Apperley JF. Managing pregnancy in chronic myeloid leukaemia. Ann Hematol. 2015; 94 Suppl 2: S167-76 (Ⅴ)
- CQ5
- 挙児希望を有する造血幹細胞移植患者に勧められる妊孕性温存療法は?
- 推奨グレードB
-
- 1.原疾患の治療に影響を及ぼさない範囲で,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.原疾患の治療に影響を及ぼさない範囲で,未受精卵子凍結保存が考慮される。
- 推奨グレードC2
-
- 3.GnRH アゴニストの使用は月経コントロール目的に考慮されるが,妊孕性温存目的での使用は推奨されない。
- 推奨グレードB
-
- 4.男性患者では,可能な限り治療前に精子凍結保存が推奨される。
- 推奨グレードC2
-
- 5.精巣遮蔽は推奨されない。
背景・目的
移植治療により妊孕性が失われる可能性は高い。原疾患による影響や,前治療により移植時に既に妊孕性が失われている場合もあり,また移植治療単独でも高率である。初回寛解導入療法で寛解に至らず移植適応となる急性白血病症例などもあり,治療開始時より妊孕性の温存について検討すべきである。本CQ では,疾患にかかわらず造血幹細胞移植を受ける患者に対して勧められる妊孕性温存療法について検討した。
解説
女性の胚(受精卵)凍結保存,未受精卵子凍結保存,卵巣組織凍結保存,男性の精子凍結保存と精巣組織凍結保存等の妊孕性温存療法についてはCQ3,CQ4 を参照のこと。男性患者の放射線治療で精巣遮蔽が試みられることもある。放射線の精巣遮蔽は妊孕性を保持するかもしれないが,血液悪性疾患のほとんどで精巣に残存病変を有するリスクがあるため,移植治療では適切ではない1)。ここでは女性移植患者に対するGnRH アゴニストによる卵巣保護と卵巣遮蔽について述べる。
1.GnRH アゴニスト
GnRH アゴニストの投与により卵胞発育を抑制することで抗がん薬に対する感受性を低下させ,卵巣機能を保護する試みが行われている。
Cheng らの第Ⅱ相試験では,GnRH アゴニスト(リュープロレリン酢酸塩)を移植前より開始し以後3 カ月ごとに投与したが,卵巣機能不全は84%(44 人中37 人)に生じ,卵巣機能を保護しなかった2)。Phelan らのコホート研究では,GnRH アゴニストを投与した,骨髄破壊的前処置を受けた患者の卵巣機能不全は43%(7 人中3 人)であり3),既報の80〜90%4, 5)より低かった。卵巣機能不全の定義が異なることや追跡期間,GnRH アゴニストの投与量や投与期間等の影響があると考えられる。
現段階では,造血幹細胞患者を対象とした研究ではないものの,リンパ腫患者を対象にしたRCT の結果(CQ4 参照)から,妊孕性温存目的での使用は推奨されないと考えられている。
2.卵巣遮蔽
移植前処置のTBI 時に卵巣を金属片で遮蔽して線量を減らすことで,移植後早期に卵巣機能が高頻度に回復することが示されている。卵巣は移動する臓器であるために完全な遮蔽を行うことは難しいが,CT などの検査で位置を定めて遮蔽することによって,TBI 12Gy を行った場合,卵巣への照射線量は卵巣遮蔽により約2〜3Gy となる。卵巣遮蔽を行った16 人の患者で,卵巣機能の累積回復(FSH の正常化と月経の回復)率は移植後2 年で68.8%であった。年齢と化学療法の既往の影響は有意ではなかった。これまでに2 人の妊娠・健児分娩が確認されている6)。卵巣組織に腫瘍細胞が浸潤している可能性があり7),卵巣およびその周囲の組織への照射線量の低下が原疾患の再発に影響する可能性が危惧される。そのため,非寛解期の急性白血病などに対しては卵巣遮蔽は推奨できない。一方,寛解の急性白血病については,骨髄破壊的前処置であるブスルファンとシクロホスファミドを用いた前処置と,フルダラビンと小線量TBI(2Gy)を用いた前処置で再発率に差がないことが示されており8),再発率が大きく上昇する可能性は低いと考えられる。
また,卵巣遮蔽については少数例の報告に限られており,遮蔽の手法を含めて多数例での検討が必要である。適応すべき症例も非寛解症例を除外するなどの注意が必要であるため,推奨グレードを「C1」とすることによる過剰適応を防ぐために,推奨グレードの記載は控えた。
参考にした二次資料
神田善伸.がんサバイバーの妊孕性-造血器腫瘍患者の妊孕性温存対策.癌と化学療法.2015; 42: 261-6
引用文献
- 1)
- Tichelli A, Rovó. Fertility issues following hematopoietic stem cell transplantation. Expert Rev Hematol. 2013; 6: 375-88 (Ⅵ)
- 2)
- Cheng YC, Takagi M, Milbourne A, et al. Phase II study of gonadotropin-releasing hormone analog for ovarian function preservation in hematopoietic stem cell transplantation patients. Oncologist. 2012; 17: 233-8 (Ⅳa)
- 3)
- Phelan R, Mann E, Napurski C, et al. Ovarian function after hematopoietic cell transplantation: a descriptive study following the use of GnRH agonists for myeloablative conditioning and observation only for reduced-intensity conditioning. Bone Marrow Transplant. 2016; 51: 1369-75 (Ⅳa)
- 4)
- Borgmann-Staudt A, Rendtorff R, Reinmuth S, et al. Fertility after allogeneic haematopoietic stem cell transplantation in childhood and adolescence. Bone Marrow Transplant. 2012; 47: 271-6 (Ⅳb)
- 5)
- Tauchmanova L, Selleri C, Rosa GD, et al. High prevalence of endocrine dysfunction in long-term survivors after allogeneic bone marrow transplantation for hematologic diseases. Cancer. 2002; 95: 1076-84 (Ⅳb)
- 6)
- Kanda Y, Wada H, Yamasaki R, et al. Protection of ovarian function by two distinct methods of ovarian shielding for young female patients who receive total body irradiation. Ann Hematol. 2014; 93: 287-92 (Ⅴ)
- 7)
- Courbiere B, Prebet T, Mozziconacci MJ, et al. Tumor cell contamination in ovarian tissue cryopreserved before gonadotoxic treatment: should we systematically exclude ovarian autograft in a cancer survivor? Bone Marrow Transplant. 2010; 45: 1247-48 (Ⅴ)
- 8)
- Scott BL, Sandmaier BM, Storer B, et al. Myeloablative vs nonmyeloablative allogeneic transplantation for patients with myelodysplastic syndrome or acute myelogenous leukemia with multilineage dysplasia: a retrospective analysis. Leukemia. 2006; 20: 128-35 (Ⅳb)
- CQ6
- 造血器悪性腫瘍患者に対する治療後の妊娠・分娩について,どのような情報を提供すべきか?
- 推奨グレードB
-
- 1.妊娠可能と判断できる時期に一定の基準を設けることは困難であることを説明する。
- 推奨グレードB
-
- 2.造血器悪性腫瘍に対する治療後の妊娠,もしくはパートナーが妊娠した場合,治療に伴う出生児の先天異常のリスクが増加する可能性は明らかではないことを説明する。
- 推奨グレードB
-
- 3.女性で腹部・骨盤部への放射線照射歴がある場合,流産・早産のリスクに配慮して妊娠から分娩まで慎重に管理する必要がある。
背景・目的
近年はがんの治療法の改善に加え生殖医療技術も進歩しており,造血器悪性腫瘍患者でも治療終了後に妊娠・分娩が可能な症例が増加している。しかし疾患により抗がん薬の種類や治療期間が異なり,再発リスクも多様であるため,治療終了後どのくらいで妊娠可能と判断するかは,再発等の予後に与える影響とがん治療による児への影響という両者を考慮する必要がある。本CQ においては,造血器悪性腫瘍患者の治療終了後の妊娠や分娩に関して,どのような情報を提供すべきかを検討した。
解説
治療終了1 年以内に妊娠した症例報告も複数存在するものの,ガイドラインとして妊娠可能と判断できる時期に一定の基準を設けることは困難で,これまでの症例報告やレビューなどを参考に症例ごとに判断せざるを得ない。がん治療の有害事象として児への悪影響が危惧されるが,治療終了後の妊娠・分娩が可能だった場合に胎児に先天異常がみられる頻度は,一般と比較して変わらないとする報告が多い。
急性白血病の長期間サバイバー43 人(男18 人,女25 人)における妊娠の結果では,治療終了から平均49 カ月(−6 カ月〜11 年)で46 人(男児26 人,女児20 人)が生まれ,全員に先天異常は認められていない1)。
ホジキンリンパ腫に関しては,表7-3 のように多くの報告がある。German Hodgkin Study Group によると,HD14 プロトコール2)後には平均39 カ月(12〜83 カ月)後にABVD 療法(ドキソルビシン,ブレオマイシン,ビンブラスチン,ダカルバジン)4 サイクルで15%,BEACOPP 療法(ブレオマイシン,エトポシド,ドキソルビシン,シクロホスファミド,ビンクリスチン,プロカルバジン,プレドニゾロン)+ABVD 療法2 サイクルずつで26%が挙児を得ている。HD15 プロトコール3)では化学療法後4 年で女性患者15%,男性患者12%が挙児を得ている。一方,Danish nationwide cohort study 4)では,妊娠前にホジキンリンパ腫に罹患した女性の診断から妊娠までの中央値は60 カ月(9〜262 カ月)で,コホート集団と比較したprevalence odds ratio は,早産児1.1(95% CI:0.6-2.0),先天異常1.7(95% CI:0.9-3.1),死産2.0(95% CI:0.3-15.4)であった。
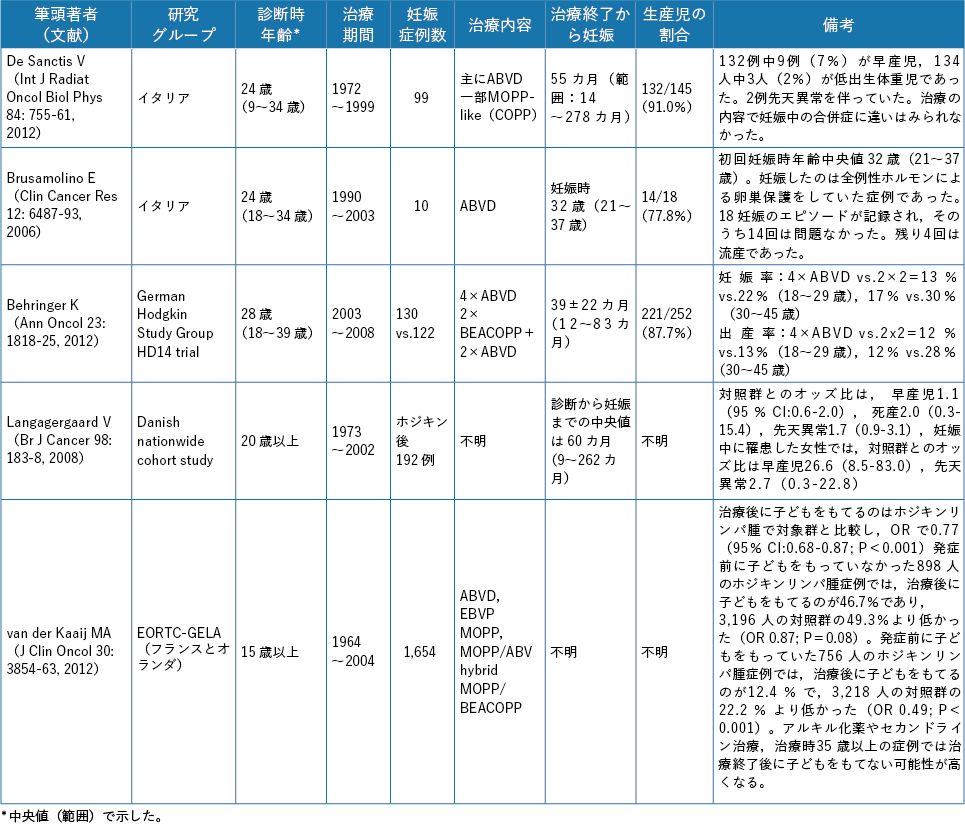
造血幹細胞移植後の妊娠・分娩の報告例も複数存在し,主なものを表7-4 にまとめた。EBMT 5)によると,移植後(期間中央値は女性6 年,男性5 年)に312 妊娠中271 人(87%)の挙児が得られている。一般と比較して先天異常の発症割合は変わりなかったが,低出生体重児および極低出生体重児の頻度と帝王切開率が増加していた。City of Hope Cancer Center ならびにUniversity of Minnesota 6)によると移植後中央値4 年で54 妊娠中46 人(85%)の挙児が得られており,患者同胞と比較して先天異常や低出生体重児の増加は認められなかった。The Center for International Blood and Marrow Transplant Research 7)ではさらに詳細な検討がなされている。女性患者79 妊娠中67 人(85%),男性患者91 妊娠中78 人(86%)で挙児が得られている。これを疾患と前処置別に検討すると,悪性腫瘍で自家移植後挙児までの中央値は女性6 年・男性7 年,悪性腫瘍で骨髄破壊的前処置による同種移植後挙児までの中央値は女性7 年・男性7 年,悪性腫瘍で強度減弱前処置(RIC)による同種移植後挙児までの中央値は女性1 年・男性3.5 年,非悪性腫瘍で同種移植後挙児までの中央値は女性7 年・男性9 年であった。移植後のガイドライン8)では,一般に移植後少なくとも2 年までは妊娠を遅らせることが推奨されているが,これは主に原病再発のリスクのせいである。
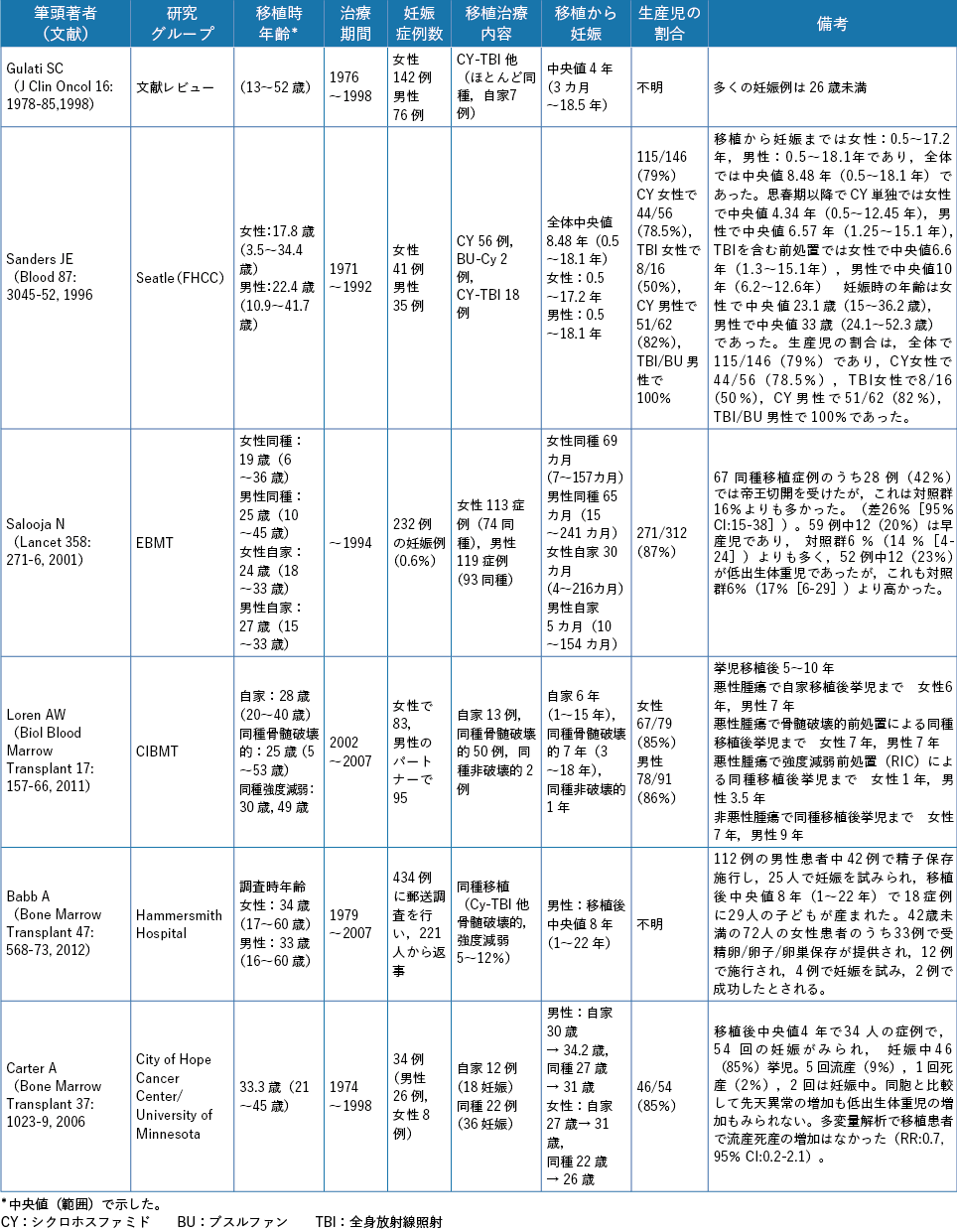
小児がん経験者のデータ9)にはなるが,下垂体や精巣への照射は流産・死産のリスクを増やさないものの(ただし不妊率は高める),10Gy 以上の子宮や卵巣への照射は,流産や死産のリスクを増やすとされている(RR:9.1, 95% CI:3.4-24.6)。特に初潮発来前の女児において1.0-2.49Gy の子宮・卵巣への照射は流産・死産を有意に増加させる(RR:4.7, 95% CI:1.2-19.0)とされ,女性で骨盤に照射する場合は流産・死産に加えて早期閉経にも注意が必要である。
生殖補助医療(assisted reproductive technology:ART)を併用した際の造血器悪性腫瘍を含めたがん患者のみの多数例のデータはあまりないが,Babb らの横断研究10)によれば,112 例の男性患者中42 例で精子凍結保存を施行し,そのうち25 人に妊娠が試みられ,移植後中央値8 年(1〜22 年)で18 例で29 人の生児を得た。42 歳未満の72 人の女性患者のうち33 例で胚(受精卵)凍結,未受精卵子凍結または卵巣組織凍結が提案され,12 例では実際に施行され,4 例で妊娠を試み,2 例で成功したとされる。ART 後の分娩に関しては既に一般症例ではメタ解析の報告11)も存在し,ART 群では自然妊娠群と比較して分娩児の問題が有意に多い(RR:1.32, 95 % CI:1.24-1.42)。単胎児分娩ではRR は1.36(95 %CI:1.30-1.43)であるが,多胎妊娠ではリスクの増加は明らかではなく,多胎妊娠のプール解析では1.11(95% CI:0.98-1.26),双胎に限れば,RR は1.26(95% CI:0.99-1.60)であったと報告されている。以上の一般症例ART 後の周産期リスク増加のデータから推測し,造血器悪性腫瘍患者でもハイリスク妊娠として対応することが望ましいと考えられる。
参考にした二次資料
なし
引用文献
- 1)
- Kawamura S, Suzuki Y, Tamai Y. Pregnancy outcome among long-term survivors with acute leukemia. Int J Hematol. 1995; 62: 157-61 (Ⅴ)
- 2)
- Behringer K, Thielen I, Mueller H, et al. Fertility and gonadal function in female survivors after treatment of early unfavorable Hodgkin lymphoma(HL)within the German Hodgkin Study Group HD14 trial. Ann Oncol. 2012; 23: 1818-25 (Ⅳb)
- 3)
- Behringer K, Mueller H, Goergen H, et al. Gonadal function and fertility in survivors after Hodgkin lymphoma treatment within the German Hodgkin Study Group HD13 to HD15 trials. J Clin Oncol. 2013; 31: 231-9 (Ⅳb)
- 4)
- Langagergaard V, Horvath-Puho E, Norgaard M, et al. Hodgkin’s disease and birth outcome: a Danish nationwide cohort study. Br J Cancer. 2008; 98: 183-8 (Ⅳa)
- 5)
- Salooja N, Szydlo RM, Socie G, et al. Pregnancy outcomes after peripheral blood or bone marrow transplantation: a retrospective survey. Lancet. 2001; 358: 271-6 (Ⅴ)
- 6)
- Carter A, Robison LL, Francisco L, et al. Prevalence of conception and pregnancy outcomes after hematopoietic cell transplantation: report from the Bone Marrow Transplant Survivor Study. Bone Marrow Transplant. 2006; 37: 1023-9 (Ⅴ)
- 7)
- Loren AW, Chow E, Jacobsohn DA, et al. Pregnancy after hematopoietic cell transplantation: a report from the late effects working committee of the Center for International Blood and Marrow Transplant Research(CIBMTR). Biol Blood Marrow Transplant. 2011; 17: 157-66 (Ⅳa)
- 8)
- Joshi S, Savani BN, Chow EJ, et al. Clinical guide to fertility preservation in hematopoietic cell transplant recipients. Bone Marrow Transplant. 2014; 49: 477-84 (Ⅴ)
- 9)
- Signorello LB, Mulvihill JJ, blue DM, et al. Stillbirth and neonatal death in relation to radiation exposure before conception: a retrospective cohort study. The Lancet. 2010; 376: 624-30 (Ⅳa)
- 10)
- Babb A, Farah N, Lyons C, et al. Uptake and outcome of assisted reproductive techniques in long-term survivors of SCT. Bone Marrow Transplant. 2012; 47: 568-73 (Ⅳb)
- 11)
- Hansen M, Kurinczuk JJ, Milne E, et al. Assisted reproductive technology and birth defects: a systematic review and meta-analysis. Hum Reprod Update. 2013; 19: 330-53 (Ⅰ)
骨軟部
- 総説
骨軟部組織は間葉系由来であり,悪性腫瘍の多くは肉腫である。骨軟部肉腫は小児期,思春期・若年(adolescent and young adult:AYA)世代(15〜39 歳)に好発するため,妊孕性温存の対象となるものが多い(CQ1〜CQ3)。肉腫は身体のいかなる部位からも発生するが,妊娠・分娩に影響する骨盤部発生の症例も多い(CQ4)。骨軟部肉腫の治療の基本は外科的切除であるが,補助療法として化学療法や放射線治療も行われる(CQ1〜CQ3)。集学的治療によって骨軟部肉腫の予後は大幅に改善し,長期サバイバーが増加している。骨軟部肉腫の治療にあたっては,これらサバイバーの妊孕性温存の機会が奪われないよう留意することが重要である(CQ1〜CQ4)。
1.疫学
発生頻度を正確に記述した疫学的な資料はほとんどないが,国内における骨原発肉腫の発生頻度は人口10 万人あたり0.4 人,軟部肉腫の発生頻度は人口10 万人あたり2.0 人と推測される1, 2)。また,国内全がん死亡数における骨原発肉腫の占める割合は0.2%,軟部肉腫の占める割合は0.7%とされており,両者を合計しても1%に満たない。
一方で,全小児がんにおける肉腫の占める割合は約15%といわれており,骨軟部肉腫は小児期,AYA世代に多い。したがって,妊孕性温存の対象となる症例が多いのが特徴である(CQ1〜CQ3)。
2.病態
骨軟部組織は間葉系由来であり,悪性腫瘍の多くは肉腫である。骨軟部腫瘍は骨腫瘍と軟部腫瘍に大別され,悪性骨腫瘍には骨肉腫,軟骨肉腫,ユーイング肉腫,脊索腫などが含まれ,悪性軟部腫瘍には脂肪肉腫,悪性線維性組織球腫(近年では未分化多形肉腫や粘液線維肉腫に分類される),平滑筋肉腫,滑膜肉腫,悪性末梢神経鞘腫瘍,骨外性ユーイング肉腫,横紋筋肉腫などが含まれる。多彩な組織型の腫瘍が含まれており,これが骨軟部腫瘍の診断・治療を困難にしている。
小児期,AYA 世代に好発する悪性骨腫瘍としては骨肉腫,ユーイング肉腫などがあり,悪性軟部腫瘍としては横紋筋肉腫,骨外性ユーイング肉腫,滑膜肉腫,類上皮肉腫,胞巣状軟部肉腫,明細胞肉腫などがある。これらの患者で妊孕性温存の適応となることが多い(CQ1〜CQ3)。
骨軟部肉腫では染色体の相互転座がみられることが多く,この相互転座によって特徴的な融合遺伝子を生じる。融合遺伝子には,ユーイング肉腫のEWS/FLI-1 や滑膜肉腫のSYT/SSX1 などがある。確定診断には遺伝子診断が重要となる。
肉腫は身体のいかなる部位からも発生する。特に四肢・体幹に発生することが多く,妊娠・分娩に影響する骨盤部発生の症例も多い(CQ4)。骨肉腫の8%が骨盤骨発生であり3),ユーイング肉腫の26%が骨盤骨発生である4)。
骨軟部肉腫の遠隔転移は血行性の肺転移であり,リンパ節転移はほとんどない。ただし,類上皮肉腫や横紋筋肉腫や明細胞肉腫ではリンパ節転移が多い。
骨軟部肉腫が頻発する遺伝性腫瘍症候群としては,リ・フラウメニ症候群(多くの場合,TP53 遺伝子の生殖細胞系変異または遺伝性変異によって引き起こされる)が知られている。肉腫を発生するその他の遺伝性症候群として,ウェルナー症候群,フォンレックリングハウゼン病などが知られている。


3.治療
3-1.治療戦略
良性骨軟部腫瘍に対しては主に単純切除が行われる。骨軟部肉腫に対する治療は組織型によって異なるが,基本は外科的完全切除である。さらに,骨軟部肉腫では補助療法として化学療法や放射線治療が行われることが多いため,妊孕性温存の対象となる症例も多い(CQ1〜CQ3)。骨肉腫やユーイング肉腫などの高悪性度の骨軟部肉腫に対しては手術の前後に抗がん薬治療が行われる。進行例では緩和的な化学療法や放射線治療が行われる。
3-2.手術療法
原則として,良性骨軟部腫瘍に対しては腫瘍内切除(掻爬)や腫瘍辺縁切除が行われ,悪性腫瘍に対しては腫瘍広範切除が行われる。四肢発生の骨軟部肉腫に対して以前は切断術が行われていたが,最近ではほとんどの症例で患肢温存術が行われる。骨盤部発生の症例も多く,骨盤部発生の女性患者では手術が妊娠・分娩に影響する(CQ4)。
3-3.化学療法
高悪性度の骨軟部肉腫に対しては大量の抗がん薬治療が行われ,妊孕性に影響する。したがって,妊孕性温存の対象となる症例が多い(CQ1〜CQ3)。骨肉腫に対してはメトトレキサート+ドキソルビシン+シスプラチン(MAP),イホスファミドなどが用いられ,ユーイング肉腫に対してはビンクリスチン+シクロホスファミド+ドキソルビシン(VDC),イホスファミド+エトポシド(IE)などが用いられる。横紋筋肉腫に対してはビンクリスチン+シクロホスファミド+アクチノマイシンD(VAC)などが用いられる。未分化多形肉腫,滑膜肉腫,悪性末梢神経鞘腫瘍,粘液型脂肪肉腫などの軟部肉腫に対してもドキソルビシン+イホスファミド(AI)などが用いられることが多い。
2012 年よりパゾパニブ(分子標的治療薬),2015 年よりトラベクテジン,2016 年よりエリブリンなどの新規抗がん薬が軟部肉腫に使用できるようになった。それらの妊孕性への影響については不明である。
*CQ 番号をクリックすると解説画面へ移動します。
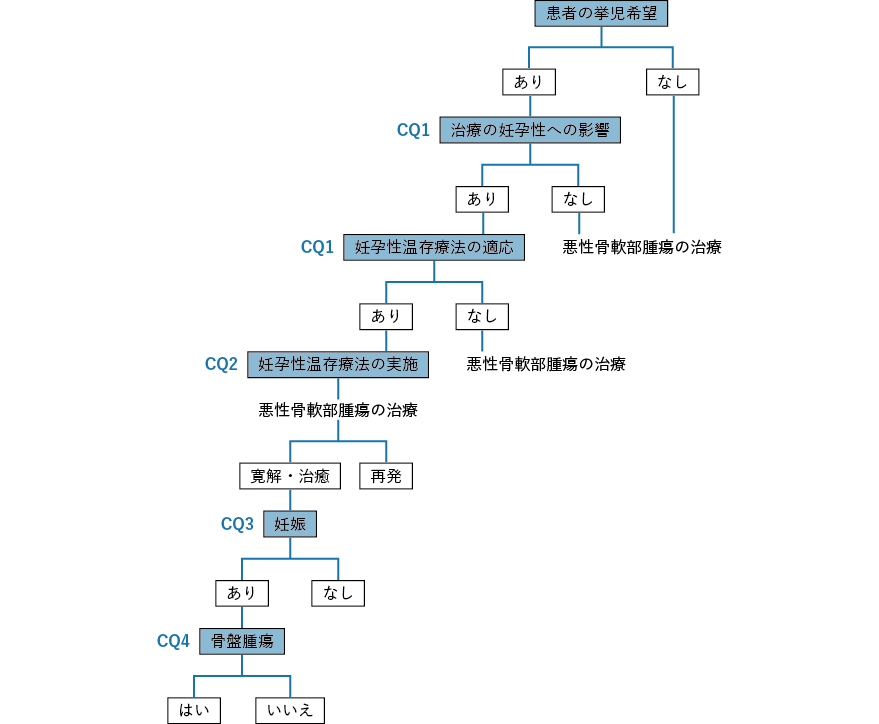
3-4.放射線治療
ユーイング肉腫や横紋筋肉腫を除くと骨軟部肉腫の放射線感受性は一般に低い。外科手術の補助療法として使用され,放射線治療のみでは原発腫瘍の根治は通常は望めない。切除不能例に対して重粒子線治療が行われることがある。重粒子線治療の妊孕性への影響については不明である。
4.予後
4-1.骨原発肉腫の予後
骨肉腫の予後因子として,腫瘍の部位,大きさ,転移病変の有無が報告されている5, 6)。本邦における初診時に転移のない骨肉腫529 例の検討では,年齢,部位,組織学的効果が予後因子となり,5 年累積生存率は82%と報告されている7)。ユーイング肉腫の予後因子としては,腫瘍の部位,大きさ,年齢,性別,転移の有無が報告されている6)。全国骨腫瘍登録一覧表によると,本邦におけるユーイング肉腫50 例の5年累積生存率は47%と報告されている1)。
4-2.軟部肉腫の予後
組織型によって様々であるが,予後因子として,年齢,腫瘍の大きさ,切除縁などが報告されている6)。軟部肉腫の生存率を正確に記述した資料はほとんどないが,全国軟部腫瘍登録一覧表によると,本邦における5 年累積生存率は全軟部肉腫2,142 例で80%と報告されている2)。組織型別では,悪性線維性組織球腫358 例で76%,脂肪肉腫(高分化型を含む)641 例で90%,滑膜肉腫120 例で73%と報告されている2)。
5.小児期,思春期の患者への倫理的配慮
骨軟部腫瘍は小児期,思春期に多く,成人とは異なる倫理的配慮が必要となる。小児期,思春期の患者に対する倫理的配慮については,「小児」の総説の「5.小児特有の倫理的配慮」の項を参照のこと。
その概略は,16 歳以上の患者で,十分な判断能力を有する場合,親だけではなく患者自身からもインフォームドコンセントを得ることが望ましい。16 歳未満の患者では親からのインフォームドコンセントだけでなく,本人にも年齢相応の説明を行い,アセントを得ることが望ましい。
引用文献
- 1)
- 日本整形外科学会骨軟部腫瘍委員会/国立がん研究センター 編.平成25 年度全国骨腫瘍登録一覧表.2013
- 2)
- 日本整形外科学会骨軟部腫瘍委員会/国立がん研究センター 編.平成25 年度全国軟部腫瘍登録一覧表.2013
- 3)
- Donati D, Giacomini S, Gozzi E, et al. Osteosarcoma of the pelvis. Eur J Surg Oncol. 2004; 30: 332-40
- 4)
- Paulussen M, Craft AW, Lewis I, et al. Results of the EICESS-92 Study: two randomized trials of Ewing’s sarcoma treatment–cyclophosphamide compared with ifosfamide in standard-risk patients and assessment of benefit of etoposide added to standard treatment in high-risk patients. J Clin Oncol. 2008; 26: 4385-93
- 5)
- Pakos EE, Nearchou AD, Grimer RJ, et al. Prognostic factors and outcomes for osteosarcoma: an international collaboration. Eur J Cancer. 2009; 45: 2367-75
- 6)
- PDQ Cancer Information Summaries. http://www.cancer.gov/publications/pdq/information-summaries
- 7)
- Ogura K, Hiraga H, Ishii T, et al. Chapter 4 Outcome of treatment for osteosarcoma of the extremities over the last 20 years: Report from 11 referral centers in Japan. In: Ueda T, Kawai A, Eds. Osteosarcoma: A multidisciplinary approach to treatment, Springer, Tokyo, pp45-57, 2016
- CQ1
- どのような悪性骨軟部腫瘍患者が妊孕性温存療法の適応となるか?
- 推奨グレードB
- 化学療法が必要となる患者や,骨盤や後腹膜に発生した腫瘍など不妊のリスクが高いと予想される悪性骨軟部腫瘍患者が,治療内容や生命予後を考慮した上で,妊孕性温存療法の対象となる。
背景・目的
集学的治療によって悪性骨軟部腫瘍患者の治療成績が向上し,治療後の妊孕性温存に関する期待が高まっている。本CQ では,妊孕性温存療法の適応となる悪性骨軟部腫瘍の症例について検討した。
解説
本CQ では,整形外科領域の悪性骨軟部腫瘍を主な対象として検討したため,子宮原発の平滑筋肉腫には言及しない。また,整形外科領域の中間悪性骨軟部腫瘍には若年者(本CQ では40 歳未満)の女性に好発し,しばしば治療と妊娠・分娩が問題となるデスモイド型線維腫症や骨巨細胞腫などがあるが,本ガイドラインの主旨と異なるため,本CQ の内容から省いた。
これまで,悪性骨軟部腫瘍患者における治療後の性腺機能や妊孕性温存療法に関する包括的な報告は極めて少なく1, 2),各疾患における報告も極めて限られたものであり3, 4),広く悪性骨軟部腫瘍の多様性を網羅するものでない。したがって本CQ では,特に過去の論文や国内の悪性骨軟部腫瘍のデータベースをもとに,妊孕性温存療法の適応となりうる症例について整理することに努めた。
近年,妊孕性温存療法の適応以前に対象患者に対して生殖医療を専門とする医師によるコンサルテーション(あるいはカウンセリング)を行うことが,妊孕性温存療法の適応の有無,あるいは成否にかかわらず患者の受容やquality of life(QOL)を高めるため,妊孕性温存療法に関するコンサルテーションを積極的に推奨すべきという報告が多い5-9)。この考え方に沿い,本CQ では,①妊孕性温存に関するコンサルテーションを要する悪性骨軟部腫瘍,②妊孕性温存が可能となる対象患者,の2 項目に大きく分けて整理した。
1.妊孕性温存に関するコンサルテーションを要する悪性骨軟部腫瘍
1-1.悪性骨軟部腫瘍の多様性
骨軟部腫瘍とは間葉系細胞由来の新生物の総称で,2013 年のWHO(World Health Organization)分類では骨腫瘍で12 カテゴリー49 種類,軟部腫瘍で12 カテゴリー113 種類,計24 カテゴリー162 種類の病理組織分類があり,良性,中間悪性から悪性まで非常に多彩である10)。悪性骨軟部腫瘍は非常に稀な疾患ではある11)が,他の悪性腫瘍と比較して若年層に多く分布し,約3/4 が高悪性度であるのが特徴である12, 13)。それぞれ好発年齢,発生部位,化学療法感受性,放射線感受性が異なるため,各病理診断によって治療法が大きく異なる14)。以下,主に本邦の骨軟部腫瘍データベースを用いて妊孕性温存に関するコンサルテーションを要する悪性骨軟部腫瘍について検討する。
1-2.悪性骨軟部腫瘍の好発年齢
日本整形外科学会骨軟部腫瘍委員会監修の全国骨腫瘍登録15)によると,2006 年から2013 年に全国で診断,治療された原発性悪性骨腫瘍4,250 例中,小児期(0〜14 歳)発症が503 例(11.8%),思春期・若年成人,いわゆるAYA 世代(本CQ では15〜39 歳)発症が1,108 例(26.1%)と,合わせて悪性骨腫瘍を発症する症例の約4 割が40 歳未満であることがわかる。また,同監修の全国軟部腫瘍登録16)によると,2006 年から2013 年に全国で診断,治療された原発性悪性軟部腫瘍9,486 例中小児期(0〜14 歳)発症が205 例(2.2%),いわゆるAYA 世代(本CQ では15〜39 歳)発症が1,491 例(15.7%)と,合わせて悪性軟部腫瘍を発症する症例の約2 割が40 歳未満であることがわかる。以上より,悪性骨軟部腫瘍は希少がんではあるものの,治療後の妊孕性温存を希望しうる若年発症(小児,およびいわゆるAYA 世代)の患者が一定の割合で存在することがわかる。
1-3.若年発症の悪性骨軟部腫瘍に対する抗がん薬投与の適応
上記全国骨腫瘍登録15)によると,2006 年から2013 年に全国で診断,治療された若年発症(本CQ では40 歳未満)の原発性悪性骨腫瘍の上位2 疾患は,骨肉腫,ユーイング肉腫であり,その2 疾患で若年発症原発性悪性骨腫瘍の約3/4 を占める。骨肉腫に対しては,ドキソルビシン+シスプラチン+メトトレキサート,イホスファミドを組み合わせたMAP-I 療法17, 18),ユーイング肉腫に対しては,ビンクリスチン+シクロホスファミド+ドキソルビシン(VDC),イホスファミド+エトポシド(IE)を組み合わせたVDC-IE 療法の有効性を示した報告19, 20)が多く,いずれの疾患も化学療法を中心とした集学的治療が標準的治療となっている。
一方,上記全国軟部腫瘍登録16)によると,2006 年から2013 年に全国で診断,治療された若年発症(小児,およびいわゆるAYA 世代)の原発性悪性軟部腫瘍では,脂肪肉腫,滑膜肉腫に横紋筋肉腫,骨外性ユーイング肉腫,悪性末梢神経鞘腫瘍が続き,これら5 疾患で若年発症(40 歳未満)原発性悪性軟部腫瘍の約2/3 を占める。この中で,小円形細胞肉腫に分類される横紋筋肉腫,および骨外性ユーイング肉腫は上記のごとく化学療法を中心とした集学的治療が標準的な治療となる疾患21, 22)である。非小円形細胞肉腫に分類される脂肪肉腫,滑膜肉腫,悪性末梢神経鞘腫瘍においても,悪性度の高い腫瘍に対して手術の補助療法としてドキソルビシンやイホスファミドなどの殺細胞薬を用いた化学療法の有効性を示す報告が多い23-26)。
薬剤別にみると,悪性軟部腫瘍,骨肉腫,ユーイング肉腫に対して高頻度で投与される高用量のアルキル化薬(シクロホスファミド,イホスファミド)の使用は,女性の無月経,男性の遷延性無精子症の高リスク群に分類される27, 28)。また,骨肉腫の治療で用いられる高用量(累積投与400mg/m2 以上)のシスプラチンも,男性の遷延性無精子症の高リスク因子であることが知られている27, 28)。ただし,各薬剤の妊孕性に対する影響が全ての薬剤に対し,個別に,かつ年齢別に解析されているわけではないため,今後の報告にも注視すべきである。
以上より,若年発症の悪性骨軟部腫瘍症例の大多数で妊孕性に影響を与える殺細胞薬を用いた化学療法が必要であり,そのような症例には治療開始前に生殖医療を専門とする医師によるコンサルテーションが推奨される。
1-4.妊孕性に影響を与えうる骨盤・後腹膜発生の悪性骨軟部腫瘍
上記全国骨腫瘍登録15)によると,2006 年から2013 年に全国で診断,治療された原発性悪性骨腫瘍4,250 例の中で,骨盤骨(腸骨,恥骨,坐骨),および仙骨に発生したものは830 例(19.5%)存在した。上位から,脊索腫,軟骨肉腫,骨肉腫,ユーイング肉腫であり,それら上位4 疾患で骨盤骨(腸骨,恥骨,坐骨),および仙骨に発生した原発性悪性骨腫瘍の約3/4 を占める。脊索腫や軟骨肉腫は好発年齢が高いことが報告されている26-31)が,過去の報告や全国骨腫瘍登録15)にも若年発症(40 歳未満)の症例も散見するため,年齢に応じて妊孕性温存が問題となりうる。脊索腫,軟骨肉腫は有効な薬剤がなく,外科的切除,あるいは放射線照射が治療の中心となる29-35)。骨肉腫やユーイング肉腫は上記のごとく,化学療法,手術,さらに症例に応じては放射線照射を加えた集学的治療が必要であり,治療開始前に妊孕性温存に関する検討を行うことが推奨される。
また,上記全国軟部腫瘍登録によると,2006 年から2013 年に全国で診断,治療された原発性悪性軟部腫瘍9,486 例の中で,後腹膜に発生したものは469 例(4.9%)であり,内訳では脂肪肉腫が半数以上(55.2%)を占めている。後腹膜腔は広いため,病変が必ずしも生殖器官に隣接しないが,解剖学的理由から根治性の高い手術を行うことがしばしば困難であり,再発のリスクが高いため36, 37),年齢が若く,妊孕性温存を希望する場合は治療開始前に妊孕性温存に関する検討を行うことが推奨される。骨盤・後腹膜悪性骨軟部腫瘍の治療後の妊孕性に関する詳細はCQ4 に委ねる。
2.妊孕性温存が可能となる対象患者
実際の妊孕性温存療法の適応に関しては,病理診断などの疾患背景よりも,妊孕性温存療法の技術的な側面から性別,年齢などの患者背景によって決定する。挙児希望を有する悪性骨軟部腫瘍患者に勧められる妊孕性温存療法の詳細はCQ2 に委ねるが,以下,その対象に関して簡単に述べる。
2-1.既往疾患としての不妊症
悪性骨軟部腫瘍に対する治療開始前の段階で性腺機能の評価が必要である。その段階で,染色体異常や無精子症などが発覚した場合は,妊孕性温存療法の対象からの除外も考慮しなければならない。
2-2.女児・女性
初経開始前の患者に対しては,試験的な卵巣組織凍結が考慮される。初経開始後の患者が妊孕性温存療法の適応になることが多いが,妊孕性温存療法に必要な期間,原病に対する治療を待機できるか等も適応を判断する上で重要となる。化学療法開始前までに2 週間以上の猶予がある場合,胚(受精卵)凍結,未受精卵子凍結が推奨され,時間的猶予がない場合には,試験的な方法として卵巣組織凍結が考慮される。
2-3.男児・男性
男性の妊孕性温存療法は精子凍結が一般的であるため,思春期以降の患者が妊孕性温存療法の適応となる。男児に対する有効な妊孕性温存療法の手段は現時点で確立していないため,今後の課題となっている。
2-4.放射線照射に対する性腺保護
骨盤腫瘍や後腹膜腫瘍に対する放射線照射では,子宮や卵巣が照射野に入りうる。そのような症例では,卵巣位置移動術や子宮・卵巣遮蔽が技術的に可能か,治療開始前に十分に検討されるべきである。
参考にした二次資料
ASCO ガイドライン
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
引用文献
- 1)
- Hoshi M, Takami M, Ieguchi M, et al. Fertility following treatment of high-grade malignant bone and soft tissue tumors in young adults. Mol Clin Oncol. 2015; 3: 367-74 (Ⅴ)
- 2)
- Hoshi M, Oebisu N, Takada J, et al. Pre-chemotherapy preservation of fertility in male patients with high-grade malignant bone and soft tissue tumors. Mol Clin Oncol. 2014; 2: 1111-4 (Ⅴ)
- 3)
- Yonemoto T, Ishii T, Takeuchi Y, et al. Recently intensified chemotherapy for high-grade osteosarcoma may affect fertility in long-term male survivors. Anticancer Res. 2009; 29: 763-7 (Ⅴ)
- 4)
- Yonemoto T, Tatezaki S, Ishii T, et al. Marriage and fertility in long-term survivors of high grade osteosarcoma. Am J Clin Oncol. 2003; 26: 513-6 (Ⅴ)
- 5)
- Letourneau JM, Ebbel EE, Katz PP, et al. Pretreatment fertility counseling and fertility preservation improve quality of life in reproductive age women with cancer. Cancer. 2012; 118: 1710-7 (Ⅴ)
- 6)
- Goodman LR, Balthazar U, Kim J, et al. Trends of socioeconomic disparities in referral patterns for fertility preservation consultation. Hum Reprod. 2012; 27: 2076-81 (Ⅴ)
- 7)
- Bastings L, Baysal O, Beerendonk CC, et al. Referral for fertility preservation counselling in female cancer patients. Hum Reprod. 2014; 29: 2228-37 (Ⅴ)
- 8)
- Deshpande NA, Braun IM, Meyer FL. Impact of fertility preservation counseling and treatment on psychological outcomes among women with cancer: A systematic review. Cancer. 2015; 121: 3938-47 (レビュー)
- 9)
- Loren AW, Mangu PB, Beck LN, et al. ; American Society of Clinical Oncology. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 10)
- Fletcher CD, Hogendoorn P, Mertens F, et al. WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. IARC Press, Lyon, 2013 (その他)
- 11)
- NCI SEER Cancer statistics review, 1975-2013. http://seer.cancer.gov/csr/1975_2013/ (その他)
- 12)
- Gustafson P. Soft tissue sarcoma. Epidemiology and prognosis in 508 patients. Acta Orthop Scand Suppl. 1994; 259: 1-31 (Ⅳa)
- 13)
- Gatta G, van der Zwan JM, Casali PG, et al. ; RARECARE working group. Rare cancers are not so rare: the rare cancer burden in Europe. Eur J Cancer. 2011; 47: 2493-511 (Ⅳa)
- 14)
- Eriksson M. Histology-driven chemotherapy of soft-tissue sarcoma. Ann Oncol. 2010; 21 Suppl 7: vii270-6(その他)
- 15)
- 日本整形外科学会骨軟部腫瘍委員会/国立がん研究センター 編.平成25 年度全国骨腫瘍登録一覧表.2013 (その他)
- 16)
- 日本整形外科学会骨軟部腫瘍委員会/国立がん研究センター 編.平成25 年度全国軟部腫瘍登録一覧表.2013 (その他)
- 17)
- Bramwell VH, Burgers M, Sneath R, et al. A comparison of two short intensive adjuvant chemotherapy regimens in operable osteosarcoma of limbs in children and young adults: the first study of the European Osteosarcoma Intergroup. J Clin Oncol. 1992; 10: 1579-91 (Ⅱ)
- 18)
- Meyers PA, Schwartz CL, Krailo M, et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J Clin Oncol. 2005; 23: 2004-11 (Ⅱ)
- 19)
- Grier HE, Krailo MD, Tarbell NJ, et al. Addition of ifosfamide and etoposide to standard chemotherapy for Ewing’s sarcoma and primitive neuroectodermal tumor of bone. N Engl J Med. 2003; 348: 694-701 (Ⅱ)
- 20)
- Granowetter L, Womer R, Devidas M, et al. Dose-intensified compared with standard chemotherapy for nonmetastatic Ewing sarcoma family of tumors: a Children’s Oncology Group Study. J Clin Oncol. 2009; 27: 2536-41(Ⅱ)
- 21)
- Oberlin O, Rey A, Sanchez de Toledo J, et al. Randomized comparison of intensified six-drug versus standard three-drug chemotherapy for high-risk nonmetastatic rhabdomyosarcoma and other chemotherapy-sensitive childhood soft tissue sarcomas: long-term results from the International Society of Pediatric Oncology MMT95 study. J Clin Oncol. 2012; 30: 2457-65 (Ⅱ)
- 22)
- Weigel BJ, Lyden E, Anderson JR, et al. Intensive Multiagent Therapy, Including Dose-Compressed Cycles of Ifosfamide/ Etoposide and Vincristine/Doxorubicin/Cyclophosphamide, Irinotecan, and Radiation, in Patients With High-Risk Rhabdomyosarcoma: A Report From the Children’s Oncology Group. J Clin Oncol. 2016; 34: 117-22 (Ⅲ)
- 23)
- Sarcoma Meta-analysis Collaboration. Adjuvant chemotherapy for localised resectable soft-tissue sarcoma of adults: meta-analysis of individual data. Lancet. 1997; 350: 1647-54 (Ⅰ)
- 24)
- Benjamin RS. Evidence for using adjuvant chemotherapy as standard treatment of soft tissue sarcoma. Semin Radiat Oncol. 1999; 9: 349-51 (Ⅰ)
- 25)
- Frustaci S, Gherlinzoni F, De Paoli A, et al. Adjuvant chemotherapy for adult soft tissue sarcomas of the extremities and girdles: results of the Italian randomized cooperative trial. J Clin Oncol. 2001; 19: 1238-47 (Ⅱ)
- 26)
- Tanaka K, Mizusawa J, Fukuda H, et al. Perioperative chemotherapy with ifosfamide and doxorubicin for highgrade soft tissue sarcomas in the extremities(JCOG0304). Jpn J Clin Oncol. 2015; 45: 555-61 (Ⅱ)
- 27)
- Lee SJ, Schover LR, Partridge AH, et al. ; American Society of Clinical Oncology. American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J Clin Oncol. 2006; 24: 2917-31(ガイドライン)
- 28)
- Levine J, Canada A, Stern CJ. Fertility preservation in adolescents and young adults with cancer. J Clin Oncol. 2010; 28: 4831-41 (ガイドライン)
- 29)
- Imai R, Kamada T, Tsuji H, et al. ; Working Group for Bone, Soft Tissue Sarcomas. Carbon ion radiotherapy for unresectable sacral chordomas. Clin Cancer Res. 2004; 10: 5741-6 (Ⅴ)
- 30)
- Stacchiotti S, Casali PG, Lo Vullo S, et al. Chordoma of the mobile spine and sacrum: a retrospective analysis of a series of patients surgically treated at two referral centers. Ann Surg Oncol. 2010; 17: 211-9 (Ⅴ)
- 31)
- Imai R, Kamada T, Araki N; Working Group for Bone and Soft Tissue Sarcomas. Carbon Ion Radiation Therapy for Unresectable Sacral Chordoma: An Analysis of 188 Cases. Int J Radiat Oncol Biol Phys. 2016; 95: 322-7 (Ⅴ)
- 32)
- Radaelli S, Stacchiotti S, Ruggieri P, et al. Sacral Chordoma: Long-term Outcome of a Large Series of Patients Surgically Treated at Two Reference Centers. Spine(Phila Pa 1976). 2016; 41: 1049-57 (Ⅴ)
- 33)
- Sheth DS, Yasko AW, Johnson ME, et al. Chondrosarcoma of the pelvis. Prognostic factors for 67 patients treated with definitive surgery. Cancer. 1996; 78: 745-50 (Ⅴ)
- 34)
- Pring ME, Weber KL, Unni KK, et al. Chondrosarcoma of the pelvis. A review of sixty-four cases. J Bone Joint Surg Am. 2001; 83-A: 1630-42 (Ⅴ)
- 35)
- Outani H, Hamada K, Imura Y, et al. Comparison of clinical and functional outcome between surgical treatment and carbon ion radiotherapy for pelvic chondrosarcoma. Int J Clin Oncol. 2016; 21: 186-93 (Ⅳb)
- 36)
- Lahat G, Anaya DA, Wang X, et al. Resectable well-differentiated versus dedifferentiated liposarcomas: two different diseases possibly requiring different treatment approaches. Ann Surg Oncol. 2008; 15: 1585-93 (Ⅴ)
- 37)
- Mussi C, Collini P, Miceli R, et al. The prognostic impact of dedifferentiation in retroperitoneal liposarcoma: a series of surgically treated patients at a single institution. Cancer. 2008; 113: 1657-65 (Ⅴ)
- CQ2
- 悪性骨軟部腫瘍患者の妊孕性温存療法にはどのような方法があるか?
- 推奨グレードB
-
- 1.化学療法開始前までに2 週間以上の猶予がある場合,パートナーがいる女性患者では,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.パートナーがいない思春期以降の女性患者では,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 3.パートナーの有無にかかわらず,卵巣組織凍結保存は研究段階であるものの,胚(受精卵)または未受精卵子凍結保存までの時間的猶予がない場合や思春期前など排卵誘発が困難な場合,施行可能な施設において考慮される。
- 推奨グレードB
-
- 4.女性患者では思春期前後を問わず,骨盤内への放射線治療に対しては,照射野外への卵巣位置移動術が推奨される。
- 推奨グレードC2
-
- 5.妊孕性温存目的でのgonadotropin releasing hormone(GnRH)アゴニストの使用は推奨されない。
- 推奨グレードB
-
- 6.思春期以降の男児の場合は,精子凍結保存が推奨される。
- 推奨グレードなし
-
- 7.思春期前の男児では,現時点で適用しうる妊孕性温存療法はない。
背景・目的
近年の悪性骨軟部腫瘍に対する集学的治療の発展により,小児,思春期・若年患者における治療成績には改善がみられる一方,性腺機能への影響が危惧される。治療後に挙児希望を有する悪性骨軟部患者に対して勧められる妊孕性温存療法について検討した。
解説
骨軟部腫瘍患者の妊孕性温存に関するエビデンスは極めて少ない。したがって,推奨作成にあたっては,他臓器腫瘍領域のエビデンスおよび非がん患者に対する生殖医療におけるエビデンスを参考にしながら,骨軟部腫瘍治療の特徴に沿う形となるよう留意しまとめた。
骨軟部腫瘍治療において使用される抗がん薬のうち,アルキル化薬(シクロホスファミド,イホスファミドなど),シスプラチンは特に性腺毒性が懸念される。また適応症例数は少ないが,骨盤放射線照射も性腺毒性を有する1)。
1.女性について
1-1.化学療法を施行する場合
1-1-1.初経開始後
化学療法開始前まで2 週間以上の猶予がある場合に採卵を計画し,胚(受精卵)あるいは未受精卵子の凍結を行う。パートナーがいる場合には,胚(受精卵)凍結が既に確立した方法である。パートナーがいない場合などは未受精卵子の凍結を行う。パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。未受精卵子凍結は2012 年,米国生殖医学会(American Society for Reproductive Medicine:ASRM)により,もはや実験的な技術ではないと位置付けられている2)。いずれの場合にも調節卵巣刺激(controlled ovarian stimulation:COS)を行うことが一般的であるが,採卵までの期間を可及的に短縮するために,ランダムスタートCOS(月経周期と無関係にCOS を開始する)が考慮される。一般的な卵胞期初期から開始するCOS に比し,採取卵子に遜色がなかったことが不妊症患者3),がん患者4)で報告されている。なお,悪性骨軟部腫瘍は性ホルモン非依存性であるため,COS に際し卵胞発育に伴う血中エストロゲン濃度の上昇に対する特別な配慮は必要としない。
化学療法開始までに時間的猶予がない場合には卵巣組織凍結が考慮されるが,未だ試験的な方法としての位置付けである5)。卵巣組織凍結において最も問題となるのが,凍結組織移植時の悪性細胞の再移入(minimal residual disease:MRD)の可能性である。骨軟部腫瘍のうちユーイング肉腫に関してのみ,これまで凍結卵巣組織移植の報告が2 例あり,どちらにおいても腫瘍の再発は報告されていない6, 7)。しかし,組織凍結を目的として採取したユーイング肉腫患者8 名の卵巣組織を検索したところ,1 例において,組織学的検討では明らかでなかったがRT-PCR(reverse transcription polymerase chain reaction)法にて転移細胞が検出されたとする報告がある8)。また別の報告では,組織凍結を目的として採取した骨軟部腫瘍患者16 名(ユーイング肉腫9 名,骨肉腫4 名,滑膜肉腫2 名,軟骨肉腫1 名)の卵巣組織の組織学的検討,免疫不全マウスへの移植による検討において,転移細胞の存在は認められなかった9)。骨軟部腫瘍のMRD リスクに関して低リスクとする考え方もあれば10),ユーイング肉腫は中間リスク,骨肉腫と横紋筋肉腫に関しては低リスク,とする考え方もある11)。骨軟部腫瘍の卵巣転移の頻度は低いが,いずれの骨軟部腫瘍においても報告は認められる6)。したがって,骨軟部腫瘍患者のMRD リスクは高くはないが,凍結卵巣組織移植を施行する場合には,組織学的検索を含めた十分な検索が必要と考えられる。
また,初経開始後の女性における抗がん薬に対する卵巣保護の選択肢として,GnRH アゴニスト療法が挙げられる。その有用性に関しては未だ一定の見解はないが,GnRH アゴニストの使用がリンパ腫患者の卵巣機能保護に役に立たなかったという最近のランダム化比較試験(randomized controlled trial:RCT)の結果12)をふまえ,むしろ否定的とする考えが今後は主流となると考えられる。
1-1-2.初経開始前
初経開始前の女児に対しては,上述の未受精卵子凍結,GnRH アゴニスト療法は適応とならない。唯一の選択肢は卵巣組織凍結となるが,前述のように現時点では試験的方法としての位置付けとなる。
1-2.放射線治療を施行する場合
骨盤放射線照射を行う場合には,卵巣位置移動術が考慮される13)。なお,骨盤照射の影響は卵巣のみならず子宮にも及ぶことが知られており,照射後の患者では早産,子宮内胎児発育遅延のリスクが高まることが報告されている14)。子宮を含めた生殖器の遮蔽も理論上考慮されてよい方法と考えられるが,技術的な側面より適用は限定的である15)。本邦からの報告で,16 歳初発の仙骨原発ユーイング肉腫患者に対し,手術療法,手術時の子宮・卵巣遮蔽を行った放射線治療,術後化学療法(GnRH アゴニスト療法併用)を施行し,27 歳時に自然妊娠,予定帝王切開にて正期産に至った症例がある16)。
2.男性について
2-1.思春期後
精子形成開始後の男性に関しては,治療開始前の精子凍結が望ましい。病巣の部位などにより射精障害を認める場合には,精巣内精子採取術(testicular sperm extraction:TESE)も考慮する。
2-2.思春期前
精子形成開始前の男児に関しては,精巣組織凍結が欧米の施設では試験的に開始されている17)。ただし現時点では,ヒトにおいては凍結精巣組織から精子を得る技術は確立していない。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- FertiPROTEKT の指針
Fertility preservation in women–a practical guide to preservation techniques and therapeutic strategies in breast cancer, Hodgkin’s lymphoma and borderline ovarian tumours by the fertility preservation network Ferti-PROTEKT. Arch Gynecol Obstet. 2011; 284: 427-35
引用文献
- 1)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10 (ガイドライン)
- 2)
- The Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. Mature oocyte cryopreservation: a guideline. Fertil Steril. 2013; 99: 37-43 (ガイドライン)
- 3)
- Boots CE, Meister M, Cooper AR, et al. Ovarian stimulation in the luteal phase: systematic review and meta-analysis. J Assist Reprod Genet. 2016; 33: 971-80 (Ⅰ)
- 4)
- Cakmak H, Katz A, Cedars MI, et al. Effective method for emergency fertility preservation: random-start controlled ovarian stimulation. Fertil Steril. 2013; 100: 1673-80 (Ⅳa)
- 5)
- The Practice Committee of the American Society for Reproductive Medicine. Ovarian tissue cryopreservation: a committee opinion. Fertil Steril. 2014; 101: 1237-43 (ガイドライン)
- 6)
- Bastings L, Beerendonk CC, Westphal JR, et al. Autotransplantation of cryopreserved ovarian tissue in cancer survivors and the risk of reintroducing malignancy: a systematic review. Hum Reprod Update. 2013; 19: 483-506(レビュー)
- 7)
- Sørensen SD, Greve T, Wielenga VT, et al. Safety considerations for transplanting cryopreserved ovarian tissue to restore fertility in female patients who have recovered from Ewing’s sarcoma. Future Oncol. 2014; 10: 277-83(Ⅴ)
- 8)
- Abir R, Feinmesser M, Yaniv I, et al. Occasional involvement of the ovary in Ewing sarcoma. Hum Reprod. 2010; 25: 1708-12 (Ⅴ)
- 9)
- Greve T, Wielenga VT, Grauslund M, et al. Ovarian tissue cryopreserved for fertility preservation from patients with Ewing or other sarcomas appear to have no tumour cell contamination. Eur J Cancer. 2013; 49: 1932-8(Ⅴ)
- 10)
- Rosendahl M, Greve T, Andersen CY. The safety of transplanting cryopreserved ovarian tissue in cancer patients: a review of the literature. J Assist Reprod Genet. 2013; 30: 11-24 (レビュー)
- 11)
- Dolmans MM, Luyckx V, Donnez J, et al. Risk of transferring malignant cells with transplanted frozen-thawed ovarian tissue. Fertil Steril. 2013; 99: 1514-22 (Ⅴ)
- 12)
- Demeestere I, Brice P, Peccatori FA, et al. No Evidence for the Benefit of Gonadotropin-Releasing Hormone Agonist in Preserving Ovarian Function and Fertility in Lymphoma Survivors Treated With Chemotherapy: Final Long-Term Report of a Prospective Randomized Trial. J Clin Oncol. 2016; 34: 2568-74 (Ⅱ)
- 13)
- Irtan S, Orbach D, Helfre S, et al. Ovarian transposition in prepubescent and adolescent girls with cancer. Lancet Oncol. 2013; 14: e601-8 (Ⅴ)
- 14)
- blue DM, Sklar CA, Boice JD Jr, et al. Ovarian failure and reproductive outcomes after childhood cancer treatment: results from the Childhood Cancer Survivor Study. J Clin Oncol. 2009; 27: 2374-81 (Ⅳa)
- 15)
- Jakes AD, Marec-Berard P, Phillips RS, et al. Critical Review of Clinical Practice Guidelines for Fertility Preservation in Teenagers and Young Adults with Cancer. J Adolesc Young Adult Oncol. 2014; 3: 144-52 (ガイドライン)
- 16)
- Kakogawa J, Nako T, Kawamura K, et al. Successful Pregnancy After Sacrectomy Combined With Chemotherapy and Radiation for Ewing Sarcoma: Case Report and Literature Review. 2015; 28: e79-81 (Ⅴ)
- 17)
- Picton HM, Wyns C, Anderson RA, et al. ESHRE Task Force On Fertility Preservation In Severe Diseases. A European perspective on testicular tissue cryopreservation for fertility preservation in prepubertal and adolescent boys. Hum Reprod. 2015; 30: 2463-75 (Ⅳb)
- CQ3
- 悪性骨軟部腫瘍患者が挙児を希望した場合,治療終了後いつから挙児または妊娠可能となるか?
- 推奨グレードC1
-
- 1.催奇形性を有する抗がん薬については,抗がん薬や代謝産物が体内から検出されなくなる,またはそれに相当する期間が経過するまでの避妊が考慮される。
- 推奨グレードB
-
- 2.男性患者の場合,抗がん薬治療や全身放射線治療前に凍結保存した精子があれば,患者の希望する時期に顕微授精を行うことが可能である。
- 推奨グレードC1
-
- 3.治療終了後の最初の2 年間は再発・転移のリスクが高いことを十分に考慮する。
背景・目的
高悪性度骨軟部腫瘍の患者が化学療法終了後に妊娠が成立し分娩となった時期を検索し,妊娠可能な時期について検討する。
解説
1.治療後の妊孕性回復までの観察期間
1-1.妊娠・分娩について
高悪性度骨軟部腫瘍患者の化学療法後の5 年以上の観察期間で,特に女性では,妊娠や分娩への影響はわずかで,胎児の先天異常に関しても,ほぼ異常のないことが報告されている1-3)。しかし,近年の本邦における報告では,高悪性度骨軟部腫瘍に対する高用量の化学療法を受けた男性患者では妊孕性が低下する4)ことがわかっている。
1-2.精巣・卵巣機能について
男性では多剤併用化学療法開始により,精子産生能は速やかに低下し,治療後2 年5, 6)から5 年7)で回復するとされていた。近年,他のがん腫同様,高悪性度骨軟部腫瘍に対して化学療法に使用される薬剤の種類,その累積投与量の影響により無精子症になることが明らかになりつつある。シスプラチンの累積投与量が400mg/m2 を超えた症例6)や,特にアルキル化薬であるシクロホスファミドの累積投与量が7.5g/m2 以上7, 8),イホスファミドの累積投与量が60g/m2 以上9),または42g/m2 以上10)の症例では,永続的に無精子症になるとされている11)。女性の卵巣機能の障害に関しては,時間経過とともに月経周期も回復する5, 12)一方で,アルキル化薬の投与症例では,直接的な卵巣障害作用のために,患者は治療中に月経不順や無月経となり,年齢が高ければ,治療後に恒久的な無月経に至り,そのまま閉経になるとし,年齢と薬剤の関連性が指摘されている9, 13, 14)。このことから,男性ばかりではなく,女性についても化学療法前の妊孕性温存が考慮されるべきである。また,造血幹細胞移植,骨盤への放射線治療は,化学療法と比較して早期に卵巣機能不全に至るリスクが高い15)とされている。
2.治療後の精子・卵巣機能が安全と考えられる期間
高悪性度骨軟部腫瘍治療後の女性患者が妊娠を希望した際に考慮する要因としては,①治療の終了時期,②患者の年齢,③患者の卵巣機能が挙げられる16)。化学療法後の期間に関しては,一般的に,原始卵胞は薬剤の影響を受けにくいが,卵子は薬剤の曝露により影響を受け催奇形性を有することが推測されるため,原始卵胞が排卵に至るまでの期間を勘案して,化学療法終了から一定の間隔をあけることが望ましいと考えられる。患者が男性の場合は,精子形成過程において精原幹細胞が化学療法中も体細胞分裂をしているため,そこに薬剤によるDNA 障害が入る可能性がある。また,そのDNA 障害が修復されるのかどうかについてもまだ一定の見解は得られていない。
3.妊娠を開始,継続するにあたり参考にすべき期間
高悪性度骨軟部腫瘍では治療終了後の最初2 年以内の再発率や転移率が高く17),治療後の再発,転移の追跡調査として,この期間は3〜6 回の局所と肺の画像検査が推奨されている18, 19)ことから,胎児への放射線被曝を最大限軽減するように努める必要がある。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
引用文献
- 1)
- Yonemoto T, Tatezaki S, Ishii T, et al. Marriage and fertility in long-term survivors of high grade osteosarcoma. Am J Clin Oncol. 2003; 26: 513-6 (Ⅳb)
- 2)
- Hosalkar HS, Henderson KM, Weiss A, et al. Chemotherapy for bone sarcoma does not affect fertility rates or childbirth. Clin Orthop Relat Res. 2004; 428: 256-60 (Ⅴ)
- 3)
- Longhi A, Porcu E, Petracchi S, et al. Reproductive functions in female patients treated with adjuvant and neoadjuvant chemotherapy for localized osteosarcoma of the extremity. Cancer. 2000; 89: 1961-5 (Ⅴ)
- 4)
- Yonemoto T, Ishii T, Takeuchi Y, et al. Recently intensified chemotherapy for high-grade osteosarcoma may affect fertility in long-term male survivors. Anticancer Res. 2009; 29: 763-7 (Ⅳb)
- 5)
- Shamberger RC, Rosenberg SA, Seipp CA, et al. Effects of high-dose methotrexate and vincristine on ovarian and testicular functions in patients undergoing postoperative adjuvant treatment of osteosarcoma. Cancer Treat Rep. 1981; 65: 739-46 (Ⅴ)
- 6)
- Levine J, Canada A, Stern CJ. Fertility preservation in adolescents and young adults with cancer. J Clin Oncol. 2010; 28: 4831-41 (ガイドライン)
- 7)
- Meistrich ML, Wilson G, Brown BW, et al. Impact of cyclophosphamide on long-term reduction in sperm count in men treated with combination chemotherapy for Ewing and soft tissue sarcomas. Cancer. 1992; 70: 2703-12(Ⅴ)
- 8)
- Kenney LB, Laufer MR, Grant FD, et al. High risk of infertility and long term gonadal damage in males treated with high dose cyclophosphamide for sarcoma during childhood. Cancer. 2001; 91: 613-21 (Ⅴ)
- 9)
- Williams D, Crofton PM, Levitt G. Does ifosfamide affect gonadal function? Pediatr Blood Cancer. 2008; 50: 347-51 (Ⅴ)
- 10)
- Longhi A, Macchiagodena M, Vitali G, et al. Fertility in male patients treated with neoadjuvant chemotherapy for osteosarcoma. J Pediatr Hematol Oncol. 2003; 25: 292-6 (Ⅴ)
- 11)
- Yonemoto T, Takahashi M, Maru M, et al. Marriage and fertility in long-term survivors of childhood, adolescent and young adult (AYA)high-grade sarcoma. Int J Clin Oncol. 2016; 21: 801-7 (Ⅳb)
- 12)
- Wikström AM, Hovi L, Dunkel L, et al. Restoration of ovarian function after chemotherapy for osteosarcoma. Arch Dis Child. 2003; 88: 428-31 (Ⅴ)
- 13)
- Shamberger RC, Sherins RJ, Ziegler JL, et al. Effects of postoperative adjuvant chemotherapy and radiotherapy on ovarian function in women undergoing treatment for soft tissue sarcoma. J Natl Cancer Inst. 1981; 67: 1213-8 (Ⅴ)
- 14)
- Longhi A, Pignotti E, Versari M, et al. Effect of oral contraceptive on ovarian function in young females undergoing neoadjuvant chemotherapy treatment for osteosarcoma. Oncol Rep. 2003; 10: 151-5 (Ⅴ)
- 15)
- Raciborska A, Bilska K, Filipp E, et al. Ovarian function in female survivors after multimodal Ewing sarcoma therapy. Pediatr Blood Cancer. 2015; 62: 341-5 (Ⅳb)
- 16)
- Peccatori FA, Azim HA Jr, Orecchia R, et al. ; ESMO Guidelines Working Group. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013; 24: 160-70(ガイドライン)
- 17)
- Sawamura C, Matsumoto S, Shimoji T, et al. How long should we follow patients with soft tissue sarcomas? Clin Orthop Relat Res. 2014; 472: 842-8 (Ⅴ)
- 18)
- ESMO/European Sarcoma Network Working Group. Bone sarcomas: ESMO Clinical Practice Guidelines for diag nosis, treatment and follow-up. Ann Oncol. 2014; 25: 113-23 (ガイドライン)
- 19)
- ESMO/European Sarcoma Network Working Group. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014; 25: 102-12 (ガイドライン)
- CQ4
- 骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩は可能か?
- 推奨グレードC1
- 推奨様々なリスクはあるが,骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩(経腟分娩)は可能である。
背景・目的
集学的治療によって骨軟部腫瘍患者の治療成績が向上し,骨盤悪性骨軟部腫瘍の治療後の若年女性がんサバイバーの妊娠・分娩の機会が増えている。そこで,骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩の可否について検討した。
解説
1.骨盤悪性骨軟部腫瘍に対する治療
まず,骨盤悪性骨軟部腫瘍に対する治療の概略について解説する。治療は,手術療法,化学療法,放射線治療からなる。今回は治療のガイドラインではないので,骨盤悪性骨軟部腫瘍の治療に関する文献は掲載しない。
1-1.手術療法
解剖学的理由により,骨盤悪性骨軟部腫瘍は巨大になってから発見されることが多い。したがって,その手術は骨軟部腫瘍の中でも最も困難な手術であり合併症も多い。手術法には骨盤半截術や仙骨切除術などが含まれる。
1-1-1.骨盤半截術
通常の骨盤半截術(hemipelvectomy)と患肢温存的骨盤半截術(internal hemipelvectomy)がある。腫瘍の存在部位によって骨盤切除の範囲は様々である。切除範囲の分類としてはISOLS(International Society of Limb Salvage)分類が有名である。骨盤半截術に伴う合併症として,血腫形成,皮弁の血流障害,皮膚障害,感染,運動障害,深部静脈血栓,拘縮,進行性の脊柱変形などの可能性がある。
1-1-2.仙骨切除術
仙骨部分切除術(partial sacrectomy)と仙骨全切除術(total sacrectomy)がある。第1 仙椎の椎体の1/2 以上を切除しない限り,骨盤輪の安定性は保たれるとされている。仙骨全切除術では骨盤輪の不安定性を生じるため,骨盤輪の強固な再建が必要となる。仙骨の切除術レベルによって様々な神経症状を来す。合併症として,運動障害,知覚障害,皮膚障害,褥瘡,感染,深部静脈血栓,拘縮,痙縮,神経因性膀胱,人工肛門の造設などの可能性がある。
1-2.化学療法
骨肉腫に対して,メトトレキサート,ドキソルビシン,シスプラチンなどが用いられる。ユーイング肉腫に対して,ビンクリスチン,ドキソルビシン,シクロホスファミド,イホスファミド,エトポシドなどが用いられる。軟部肉腫に対して,イホスファミド,ドキソルビシンなどが用いられる。低悪性度の肉腫では通常は化学療法を行うことはない。
1-3.放射線治療
通常の放射線治療は悪性骨軟部腫瘍には無効なことが多いが,ユーイング肉腫に対しては有効であり使用されることがある。ユーイング肉腫に対しては通常は根治線量として50Gy 以上の照射が行われる。近年,手術不能な骨盤悪性骨軟部腫瘍に対して重粒子線治療が用いられている。重粒子線治療の長期経過例はなく,効果や合併症についてはまだ十分にわかっていない。
2.骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩
化学療法後の妊娠・分娩については総論を参照のこと。ここでは手術療法や放射線治療後の妊娠・分娩について解説する。
2-1.手術療法に関連する妊娠・分娩のリスク
術式や骨盤半截術の切除レベルによって,妊娠・分娩リスクは大きく異なる。症例ごとに,産婦人科医,小児科医および整形外科医による妊娠・分娩の可否についての十分な検討が必要である。また,患者と医療者の十分な議論も必要である1)。
骨盤輪の破綻による不安定性を生じる場合は,胎児の体位異常を起こすことがある1)。また,Browne らは,骨盤半截術により骨盤不安定性や筋肉ヘルニアや破水遅延のリスクが高いと報告している1)。片山らは,骨盤半截術後の子宮脱のリスクを報告している2)。一方,Bergh らは,骨盤の支持性のかなりの欠損にもかかわらず,骨盤半截術後の妊娠と分娩の経過は驚くほど順調と報告している3)。
2-2.放射線治療に関連する妊娠・分娩のリスク
放射線治療と妊孕性についての詳細は総論を参照のこと。以下に簡単に解説する。
腹部への照射線量が40Gy を超えると卵巣と子宮は妊孕性が喪失すると報告されている。腹部への放射線治療(20〜30Gy)後に女性患者の97%に卵巣機能不全が起こることが報告されている。一方で,がん治療によって卵巣機能不全になっても自然妊娠する可能性があるとの報告もある4)。
Browne らは,腹部および骨盤部への放射線照射に関連する妊娠・分娩のリスクについて文献レビューを行っている1)。リスクには以下のようなものが報告されている。死産(stillbirth)(死産のリスクは増加しないとの報告もある),胎盤接着障害(placental attachment disorders),胎児の成長障害(impaired fetal growth),胎児の体位異常(fetal malposition),早産(preterm labour),未熟児(prematurity),低体重児(low birth weight),新生児死亡(neonatal death),妊娠高血圧(hypertensive disorders in pregnancy),流産(miscarriage)(流産のリスクは増加しないとの報告もある),切迫早産(threatened labour),先天異常(congenital malformations)(先天異常のリスクは増加しないとの報告もある)。これらのリスクに対する十分な準備が必要である。
経験的に,初経後に放射線治療を受けた女性たちでは合併症が少ないようである1)。
2-3.妊孕性温存のオプション
化学療法や放射線治療による不妊のリスクのために,近年では骨盤悪性骨軟部腫瘍の治療前に妊孕性温存療法が行われることがある。妊孕性温存療法には,①胚(受精卵)凍結,②未受精卵子凍結,③卵巣組織凍結の3 つの選択肢がある。また,骨盤部に放射線照射を施行する場合,④卵巣位置移動術という選択肢もある5)。それぞれの特徴については総論を参照のこと。これらは本CQ の「骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩」とは別の問題でありここでは議論しない。しかし,がん治療を開始する前に,こうしたオプションがあることを知っておく必要がある。そして,それらのオプションが利用可能かを,がんの治療前に検討する必要がある。
2-4.分娩方法の選択(経腟分娩vs. 帝王切開)
分娩の方法には経腟分娩と帝王切開がある。Chihara らは,骨盤半截術による「骨盤のゆがみ(pelvicdistortion)」がひどい場合は帝王切開による出産が必要と報告している6, 7)。手術創の瘢痕化が強い場合も帝王切開による出産が必要とされている8)。Kakogawa らは,放射線治療による骨盤底損傷の可能性があり帝王切開が必要だった症例を報告している9)。一方で,Browne らは,骨盤半截術後に経腟分娩で出産した症例を報告した1)。骨盤骨腫瘍は経腟分娩を困難にするが,骨盤骨腫瘍の切除が行われた場合には骨性の制約が減少し,むしろ経腟分娩は容易となる。また,Browne らは,骨盤半截術後の経腟分娩は支持されるべきで,むしろ帝王切開術に関連するリスク(感染,出血,骨盤器官の損傷,将来の胎盤異常など)を考慮すると,経腟分娩が提唱されるべきであると報告している1)。
2-5.妊娠・分娩の成功例の報告
1964 年以降,骨盤半截術後の妊娠・分娩の報告が散見される8, 10-12)。骨盤半截術後の妊娠・分娩の成功例は2000 年以降では4 例の報告がある。通常の骨盤半截術後に妊娠・分娩に成功した3 例1, 2, 13),および患肢温存的骨盤半截術後に妊娠・分娩に成功した1 例6, 7)が報告されている。
一方,仙骨切除術後の妊娠・分娩の成功例は2000 年以降2 例の報告がある。Kakogawa らは,仙骨部分切除術(S1/2 レベル)後の妊娠・分娩の成功例を報告している9)。Barson らは,仙骨全切除術後の妊娠・分娩の成功例を報告している14)。
Rodriguez-Wallberg らは,骨盤照射後に卵巣移植を繰り返し行い妊娠・分娩に成功したユーイング肉腫の一例を報告している15)。国内では,笠原らが骨盤照射後に妊娠・分娩に成功した横紋筋肉腫の一例を報告している16)。
3.まとめ
このように様々なリスクが報告されているが,骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩の成功例の報告も多くみられる。これらのリスクを理解し考慮した上で,医療者と患者が十分に議論して妊娠・分娩を決める必要がある1)。患者が妊娠・分娩を選択した場合には,医療者はリスクに対する対策に最大限の努力をするべきである。
骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩に関しては,エビデンスレベルの低い症例報告や症例集積研究が少数あるのみであり,明確な結論を得ることはできない。しかし,妊娠・分娩の成功例が多く報告されていることから,「様々なリスクはあるものの,骨盤悪性骨軟部腫瘍の治療後の妊娠・分娩(経腟分娩)は可能である」と考える。
参考にした二次資料
ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
引用文献
- 1)
- Browne JL, Oudijk MA, Holtslag HR, et al. Vaginal delivery after hemipelvectomy and pelvic radiotherapy for chondrosarcoma. BMJ Case Rep. 2014; pii: bcr2014205785 (Ⅳb)
- 2)
- 片山佳代,武井美城,葉山智工,他.骨肉腫に対する骨盤半截術施行後妊娠の1 例.日本産科婦人科学会関東連合地方部会会報.2007; 44: 31-5 (Ⅴ)
- 3)
- Bergh PA, Bonamo J, Breen JL. Pregnancy after hemipelvectomy: a case report and review of the literature. Int J Gynaecol Obstet. 1988; 27: 277-83 (Ⅴ)
- 4)
- Bath LE, Tydeman G, Critchley HO, et al. Spontaneous conception in a young woman who had ovarian cortical tissue cryopreserved before chemotherapy and radiotherapy for a Ewing’s sarcoma of the pelvis: case report. Hum Reprod. 2004; 19: 2569-72 (Ⅴ)
- 5)
- Irtan S, Orbach D, Helfre S, et al. Ovarian transposition in prepubescent and adolescent girls with cancer. Lancet Oncol. 2013; 14: e601-8 (Ⅴ)
- 6)
- Chihara IG, Osada H, Iitsuka Y, et al. Pregnancy after limb-sparing hemipelvectomy for Ewing’s sarcoma. A case report and review of the literature. Gynecol Obstet Invest. 2003; 56: 218-20 (Ⅴ)
- 7)
- 後藤 泉,飯塚美徳,加来建志,他.ユーイング肉腫による骨盤半截術後に妊娠・分娩に至った一例.日本産科婦人科学会関東連合地方部会会報.2001; 38: 239 (Ⅴ)
- 8)
- Cregan JC, Burslem RW. Pregnancy and successful caesarean section after hemipelvectomy for malignant disease. Br Med J. 1964; 1: 1614 (Ⅴ)
- 9)
- Kakogawa J, Nako T, Kawamura K, et al. Successful Pregnancy After Sacrectomy Combined With Chemotherapy and Radiation for Ewing Sarcoma: Case Report and Literature Review. J Pediatr Adolesc Gynecol. 2015; 28: e79-81 (Ⅴ)
- 10)
- Brockunier A. Vaginal delivery following hemipelvectomy for malignant neoplasm of the bone and soft parts. A report of 3 deliveries in 2 patients. Obstet Gynecol. 1964; 23: 67-71 (Ⅴ)
- 11)
- Nuss RC, Lee JH. Pregnancy following hemipelvectomy. Report of a case. Obstet Gynecol. 1967; 29: 789-91 (Ⅴ)
- 12)
- Holzaepfel JH. Pregnancy and delivery post radical hemipelvectomy. Obstet Gynecol. 1973; 42: 455-8 (Ⅴ)
- 13)
- Heetkamp A, Feijen HW, Papatsonis DN. Spontaneous delivery after hemipelvectomy because of chondrosarcoma: a case report and review of the literature. Am J Perinatol. 2008; 25: 255-8 (Ⅴ)
- 14)
- Barsan VV, Briceño V, Gandhi M, et al. Long-term follow-up and pregnancy after complete sacrectomy with lumbopelvic reconstruction: case report and literature review. BMC Pregnancy Childbirth. 2016; 16: 1 (Ⅴ)
- 15)
- Rodriguez-Wallberg KA, Karlström PO, Rezapour M, et al. Full-term newborn after repeated ovarian tissue transplants in a patient treated for Ewing sarcoma by sterilizing pelvic irradiation and chemotherapy. Acta Obstet Gynecol Scand. 2015; 94: 324-8 (Ⅴ)
- 16)
- 笠原勝幸,笠井宗一郎,岩崎廉平,他.悪性腫瘍に対する化学療法治療後の妊娠・出産について.中部日本整形外科災害外科学会雑誌.2001; 44: 1107-8 (Ⅴ)
脳
- 総説
当該脳腫瘍の特徴,推奨治療,予後等より分類した妊孕性温存の要点
- (1)化学療法,放射線照射が妊孕性温存に影響する小児脳腫瘍:髄芽腫,松果体芽腫,上衣腫
- (2)腫瘍自体の視床下部・下垂体系への障害,化学療法,放射線治療が妊孕性温存に影響する小児脳腫瘍:中枢神経系胚細胞腫瘍,視路・視床下部毛様性星細胞腫,その他の星細胞腫
- (3)腫瘍自体の視床下部・下垂体系への障害,放射線治療が妊孕性温存に影響する小児脳腫瘍:頭蓋咽頭腫
- (4)予後に鑑みて妊孕性温存について慎重な対応が必要な小児脳腫瘍:びまん性浸潤性橋神経膠腫,視床星細胞腫,胎児性腫瘍の一部(多相性ロゼットをもつ胎児性腫瘍,豊富な神経線維と真性ロゼットをもつ胎児性腫瘍,非定型奇形腫様/ラブドイド腫瘍,脈絡叢乳頭がん)
- (5)Adolescent and young adult(AYA)世代(15〜39 歳)脳腫瘍患者は診断時にパートナーを有する可能性が高い点が小児の場合と異なる。神経膠腫の割合が高くなり,テモゾロミドはその治療に頻用される。放射線治療やテモゾロミド治療前に妊孕性温存を勘案する必要がある。
小児・AYA 世代の脳腫瘍患者の診断時 ⇒ 総論,CQ1 参照
小児・AYA 世代の脳腫瘍患者の治療計画時 ⇒ CQ2 参照
小児・AYA 世代の脳腫瘍患者の治療が終了後,妊娠・挙児希望時 ⇒ CQ3 参照
はじめに
原発性脳腫瘍は人口10 万あたり年間14〜20 人に発生する稀な疾患である1, 2)。2016 年に出版されたWHO(World Health Organization)脳腫瘍病理分類によれば,全ての原発性脳腫瘍は150 種類以上のentity に亜分類される3)。
病理分類と発生年齢,発生部位を俯瞰できる統計は多くはなく,これらの情報が十分に整っており,かつ本邦の臨床現場に外挿可能な疫学データは,日本脳神経外科学会による脳腫瘍全国集計調査報告(Report of Brain Tumor Registry of Japan(2014), 13th edition)がその代表である4)。これは2001 年から2004 年に日本の主要な脳神経外科施設で治療された脳腫瘍を悉皆的に登録したもので,全13,431 例中,発症時年齢が15 歳以下の小児脳腫瘍は829 例が登録されている。そのうち,術後に化学療法や放射線治療の対象となるものは,毛様性星細胞腫を含む神経膠腫が252 例,中枢神経系胚細胞腫瘍178 例,髄芽腫123 例,頭蓋咽頭腫104 例,上衣腫81 例の順であった。これらの腫瘍に髄芽腫以外の胎児性脳腫瘍(後述)を含めると小児脳腫瘍の約90%以上を占めることになる。
ここでは,これら代表的小児脳腫瘍ならびに15 歳以上40 歳未満のAYA 世代の原発性脳腫瘍について,妊孕性温存の観点から推奨治療ならびに予後を概括することとする。
なお,実際の治療アルゴリズムや化学療法の性腺障害の危険性については本ガイドラインの小児の項を参照されたい(小児CQ2,表6-1,表6-2)。
1.髄芽腫(medulloblastoma)
小児脳腫瘍の代表的存在であるが,発症割合は人口100 万人あたり5 人前後と希少疾患の代表でもある5)。6 歳前後を発症のピークとし,15 歳以下に好発する4)。WHO gradeⅣであり,病理型はclassic type, desmoplastic/nodular type, medulloblastoma with extensive nodularity, large cell/anaplastic type の4 型があり,desmoplastic/nodular type, medulloblastoma with extensive nodularity は比較的予後良好,large cell/anaplastic type は予後不良とされる6)。腫瘍摘出術の後,3 つの要素(年齢・残存腫瘍の多寡・播種病変の有無)により,average risk 群とpoor risk 群に分類し,治療を勘案する。診断時年齢3 歳以上,画像上の最大残存病変1.5cm2 以下,播種病変なしの3 条件を全て満たすものをaverage risk 群,それ以外をpoor risk 群とする。Poor risk 群はさらに3 歳未満群と3 歳以上群に分類される7-10)。
Average risk 群は放射線治療(後頭蓋窩32.4Gy+全脳・全脊髄23.4Gy)と化学療法(白金製剤とアルキル化薬がkey drug)が推奨治療である。2000 年以降の報告では5 年無病生存割合は80%以上であり,著明に転帰は改善している7, 8)。
3 歳未満のpoor risk 群は化学療法(白金製剤とアルキル化薬を中心に場合によってメトトレキサート大量療法の併用)や骨髄救援療法を併用したアルキル化薬による大量化学療法を行い,中枢神経系への放射線照射を回避・延期する治療が選択されている11)。Desmoplastic type の病理型では5 年無病生存割合が60%と転帰は比較的良好であるが,それ以外の病理型では5 年無病生存割合は50%以下である12)。
3 歳以上のpoor risk 群は残存腫瘍が大きいもの,または播種病変が存在する場合であり,average risk 群と同様の化学療法と放射線治療(後頭蓋窩19.8Gy+全脳・全脊髄36.0Gy)に加えてboost 照射を施行する7, 9)。
上記化学療法において,使用するアルキル化薬はシクロホスファミド,イホスファミド,プロカルバジン,lomustine(本邦未承認)等であり,白金製剤の併用もあり,患児の妊孕性に大きく影響する。また,放射線治療を行う場合は視床下部・下垂体系への影響,さらに,女性においては,全脳全脊髄照射を施行する場合に卵巣への被曝を勘案しなくてはならない。このような場合には,強度変調放射線治療(intensity modulated radiation therapy:IMRT)を用いて被曝を最小限にする努力が必要である13)。また,2016 年から小児脳腫瘍に保険適用となった陽子線治療は視床下部・下垂体系や卵巣への被曝線量をさらに低減できる治療として期待されている14)。
なお,髄芽腫以外の胎児性脳腫瘍として松果体芽腫(pineoblastoma),多相性ロゼットをもつ胎児性腫瘍(embryonal tumor with multilayered rosettes:ETMR),豊富な神経線維と真性ロゼットをもつ胎児性腫瘍(embryonal tumor with abundant neuropil and true rosettes:ETANTR),非定型奇形腫様/ラブドイド腫瘍(atypical teratoid/rhabdoid tumor:AT/RT),脈絡叢乳頭がん(choroid plexus carcinoma)等が挙げられるが,これらの腫瘍は発生頻度が極めて稀であり,標準治療は確立されていない4, 15, 16)。松果体芽腫は髄芽腫に準じた,それ以外の腫瘍はさらに強度を高めた治療が行われることが多く,長期生存が期待できる場合は妊孕性温存を考慮する必要がある。
2.びまん性浸潤性橋神経膠腫(diffuse intrinsic potine glioma:DIPG)
橋を含む脳幹に発生する神経膠腫は病態が多様であり,一括して論じることはできないが,その1 群として,橋に主座をもち,びまん性発育を示す,小児に好発する腫瘍群をびまん性浸潤性橋神経膠腫(DIPG)と呼称する17)。症状の進行が急激であり,中枢神経系における生命活動にとっての重要部分である橋に病変が存在するため,組織確認が困難である。多くはMRI 等での画像診断の後,放射線治療が行われる。化学療法の予後への貢献は明らかではない。最近の臨床研究の結果をまとめた報告でも生存期間中央値は12 カ月に達していない18, 19)。
患児における妊孕性温存については,予後とのバランスを考え遂行しなければならない。
3.毛様性星細胞腫(pilocytic astrocytoma)
小児に好発するWHO gradeⅠの脳腫瘍であり,好発部位は小脳,大脳半球,視路・視床下部である。小脳,大脳半球の毛様性星細胞腫は手術摘出が第一選択となるため,妊孕性温存が問題となるのは視路・視床下部病変である。
視路・視床下部の毛様性星細胞腫は視神経グリオーマ(optic glioma)とも呼称され,小児脳腫瘍の3〜5%を占める4)。多くは視交叉から視索・視床下部に発生し,全摘出は極めて困難である。画像所見や生検により診断し,カルボプラチン・シスプラチンの白金製剤をkey drug とした化学療法を繰り返し施行することが推奨治療とされる20, 21)。本化学療法は著明な縮小効果は期待できないが,腫瘍増大の阻止,場合によっては緩徐な腫瘍縮小が期待できる。放射線照射は化学療法無効例に施行され,その場合は定位的放射線治療を第一選択とする報告も散見される22)。腫瘍による視床下部・下垂体機能障害や化学療法による性腺機能低下が問題となる。治療前,治療中,治療後の間脳下垂体・性腺機能を適宜モニターし,適切な介入選択が必要である。
4.上衣腫(ependymoma)
小児と成人の二峰性ピークを有する腫瘍であり,小児と成人の比率は同程度である。小児上衣腫は小児脳腫瘍の5%を占める4)。可及的摘出と残存腫瘍に対する放射線治療が推奨治療である23, 24)。放射線治療は3 次元原体照射やIMRT を用いた残存腫瘍や腫瘍床への限局した照射野で施行されており25),全脳照射や全脳・全脊髄照射は通常は行わない。化学療法は放射線治療の回避・延期を目的に小児例を中心に行われている。特に乳幼児の後頭蓋窩上衣腫でみられる下位脳神経の神経根を巻き込んだ症例では全摘出が困難であり,化学療法が頻用される26)。使用薬剤はアルキル化薬を含む多剤併用療法である。
妊孕性温存を考慮すべき症例は,化学療法を施行した小児例や照射野に視床下部・下垂体系が含まれる症例である。
5.その他の小児神経膠腫(other pediatric astrocytoma)
小児に好発する視床神経膠腫はDIPG と同様の生物学的背景をもち,転帰は不良である27)。
その他の神経膠腫は疫学的にも生物学的にも不明な点が多く,確立された治療法は存在しない28)。放射線照射野に視床下部・下垂体系が含まれる症例,アルキル化薬や白金製剤を繰り返し使用する症例で長期間の腫瘍制御が見込まれる場合には,妊孕性温存を考慮する必要がある。
6.中枢神経系胚細胞腫瘍(central nervous system germ cell tumor)
小児期からAYA 世代に好発する腫瘍である4)。日本を含めた東南アジア地域では小児脳腫瘍の15%程度を占めるが29, 30),欧米ではその頻度は数%であり2),患児の多くはアジア系住民である。好発部位は松果体部,神経下垂体部,基底核部であり,これらの部位の複数箇所に同時期に腫瘍が認められることも稀ではない4)。病理診断や画像と腫瘍マーカー〔血清や髄液中のα-fetoprotein 値やhuman chorionic gonadotropin(hCG)値〕の組み合わせから,ジャーミノーマ群と非ジャーミノーマ群に分類され,治療が行われる31, 32)。中枢神経系以外の胚細胞性腫瘍は化学療法単独での治療が標準治療であるが,中枢神経系胚細胞腫瘍では化学療法と放射線治療の併用療法が推奨されている33, 34)。ジャーミノーマ群では白金製剤とエトポシドの化学療法と全脳室照射24Gy が推奨治療である。非ジャーミノーマ群では白金製剤とエトポシドならびにアルキル化薬の3 剤療法と全脳照射(場合によっては全脳・全脊髄照射)が行われ,場合によっては末梢血幹細胞移植や骨髄移植を併用した大量化学療法が施行される。ジャーミノーマ群の10 年生存割合は90%程度,非ジャーミノーマ群の10 年生存割合は50〜60%である32)。
妊孕性温存の観点からは以下の3 点が重要である。
(1)神経下垂体部病変による視床下部・下垂体系の機能低下ならびに性腺機能低下
(2)化学療法剤による性腺機能低下
(3)放射線照射による視床下部・下垂体系の機能低下ならびに性腺機能低下
*CQ 番号をクリックすると解説画面へ移動します。
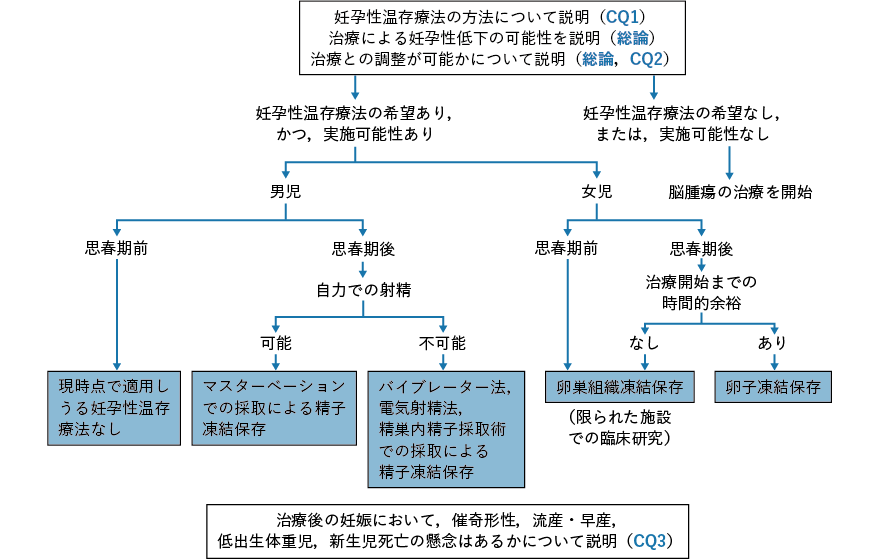
7.頭蓋咽頭腫(craniopharyngioma)
小児期,成人期を通じて発生するが,小児期(5〜9 歳)と30〜40 代に二峰性の発生ピークをもつ4)。下垂体部のトルコ鞍内・鞍上部に発生点を有し,発症時視床下部・下垂体機能不全を有している35)。推奨治療は可及的全摘術+放射線治療,あるいは肉眼的全摘術であり,推奨される化学療法は存在しない36, 37)。手術前後の視床下部・下垂体機能ならびに性腺機能評価が妊孕性温存の観点から大変重要である。
8.AYA 世代の原発性脳腫瘍
AYA 世代脳腫瘍と小児脳腫瘍の大きな違いは,診断時,既にパートナーを有している割合が高くなることである。妊孕性温存の観点からは,AYA 世代の患者は小児世代と異なる社会的環境に生活していると言える。日本脳神経外科学会による脳腫瘍全国集計調査報告によれば4),AYA 世代で頻度の高い原発性脳腫瘍は,下垂体腺腫1,195 例,神経膠腫1,040 例〔毛様性星細胞腫125 例,WHO gradeⅡ385 例,WHO gradeⅢ314 例,WHO gradeⅣ(膠芽腫)216 例〕,髄膜腫852 例,神経鞘腫393 例,ラトケ囊胞152 例,頭蓋咽頭腫91 例,血管芽腫81 例,中枢神経系胚細胞腫瘍77 例,髄芽腫および胎児性腫瘍36 例,悪性リンパ腫21 例となっている。このうち下垂体腺腫,髄膜腫,神経鞘腫,ラトケ囊胞,血管芽腫は手術療法が大きな比重を占める腫瘍群であり,病変が視床下部・下垂体部に存在する場合は,術前・術後の視床下部・下垂体機能を含む内分泌機能評価に基づいた妊孕性温存への配慮と説明が必要である。
AYA 世代脳腫瘍で小児脳腫瘍と大きく異なるのが,神経膠腫の占める割合が高まる点である。特にWHO gradeⅡ以上の神経膠腫は治療における放射線治療・化学療法が重要となる。放射線照射野に視床下部・下垂体系が含まれる症例や,化学療法において頻用されるアルキル化薬であるテモゾロミド使用例における妊孕性への影響に配慮が必要である。米国臨床腫瘍学会(American Society of Clinical Oncology:ASCO)の妊孕性温存に関するガイドラインでは38),テモゾロミドを含む化学療法レジメンと全脳照射の組み合わせは男女ともに性腺毒性に関して高リスク群に分類されているため,症例ごとに期待される予後と照らし合わせながら,治療前に妊孕性温存療法の説明とその施行が強く望まれる。
引用文献
- 1)
- Kuratsu J, Takeshima H, Ushio Y. Trends in the incidence of primary intracranial tumors in Kumamoto, Japan. Int J Clin Oncol. 2001; 6: 183-91
- 2)
- Ostrom QT, Gittleman H, Farah P, et al. CBTRUS statistical report: Primary brain and central nervous system tumors diagnosed in the United States in 2006-2010. Neuro Oncol. 2013; 15 Suppl 2: ii1-56
- 3)
- Louis DN, Ohgaki H, Wiestler OD, et al.(eds). WHO Classification of Tumours of the Central Nervous System. IARC Press, Lyon, 2016
- 4)
- Committee of Brain Tumor Regstry of Japan. Report of Brain Tumor Registry of Japan(2001-2004), 13th edition Neurol Med Chir(Tokyo). 2014; 54 Suppl 1
- 5)
- Curran EK, Le GM, Sainani KL, et al. Do children and adults differ in survival from medulloblastoma? A study from the SEER registry. J Neurooncol. 2009; 95: 81-5
- 6)
- Louis DN, Ohgaki H, Wiestler OD, et al.(eds). Pathology & Genetics of Tumours of the Central Nervous System. IARC Press, Lyon, 2007
- 7)
- Packer RJ, Gajjar A, Vezina G, et al. Phase III study of craniospinal radiation therapy followed by adjuvant chemotherapy for newly diagnosed average-risk medulloblastoma. J Clin Oncol. 2006; 24: 4202-8
- 8)
- Gajjar A, Chintagumpala M, Ashley D, et al. Risk-adapted craniospinal radiotherapy followed by high-dose chemotherapy and stem-cell rescue in children with newly diagnosed medulloblastoma (St Jude Medulloblastoma-96): long-term results from a prospective, multicentre trial. Lancet Oncol. 2006; 7: 813-20
- 9)
- Zeltzer PM, Boyett JM, Finlay JL, et al. Metastasis stage, adjuvant treatment, and residual tumor are prognostic factors for medulloblastoma in children: conclusions from the Children’s Cancer Group 921 randomized phase III study. J Clin Oncol. 1999; 17: 832-45
- 10)
- Johnston DL, Keene D, Bartels U, et al. Medulloblastoma in children under the age of three years: a retrospective Canadian review. J Neurooncol. 2009; 94: 51-6
- 11)
- Rutkowski S, Bode U, Deinlein F, et al. Treatment of early childhood medulloblastoma by postoperative chemotherapy alone. N Engl J Med. 2005; 352: 978-86
- 12)
- Rutkowski S, von Hoff K, Emser A, et al. Survival and prognostic factors of early childhood medulloblastoma: an international meta-analysis. J Clin Oncol. 2010; 28: 4961-8
- 13)
- Pichandi A, Ganesh KM, Jerrin A, et al. Cranio Spinal Irradiation of Medulloblastoma Using High Precision Techniques-A Dosimetric Comparison. Technol Cancer Res Treat. 2015; 14: 491-6
- 14)
- Yock TI, Yeap BY, Ebb DH, et al. Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma: a phase 2 single-arm study. Lancet Oncol. 2016: 17: 287-98
- 15)
- Chintagumpala M, Hassall T, Palmer S, et al. A pilot study of risk-adapted radiotherapy and chemotherapy in patients with supratentorial PNET. Neuro Oncol. 2009; 11: 33-40
- 16)
- Adamek D, Sofowora KD, Cwiklinska M, et al. Embryonal tumor with abundant neuropil and true rosettes: an autopsy case-based update and review of the literature. Childs Nerv Syst. 2013; 29: 849-54
- 17)
- Massimino M, Spreafico F, Biassoni V, et al. Diffuse pontine gliomas in children: changing strategies, changing results? A mono-institutional 20-year experience. J Neurooncol. 2008; 8: 355-61
- 18)
- Wagner S, Warmuth-Metz M, Emser A, et al. Treatment options in childhood pontine gliomas. J Neurooncol. 2006; 79: 281-7
- 19)
- Warren K, Bent R, Wolters PL, et al. A phase 2 study of pegylated interferonα-2b(PEG-Intron ®)in children with diffuse intrinsic pontine glioma. Cancer. 2012; 118: 3607-13
- 20)
- Sawamura Y, Kamoshima Y, Kato T, et al. Chemotherapy with cisplatin and vincristine for optic pathway/hypothalamic astrocytoma in young children. Jpn J Clin Oncol. 2009; 39: 277-83
- 21)
- Packer RJ, Ater J, Allen J, et al. Carboplatin and vincristine chemotherapy for children with newly diagnosed progressive low-grade gliomas. J Neurosurg. 1997; 86: 747-54
- 22)
- Combs SE, Schulz-Ertner D, Moschos D, et al. Fractionated stereotactic radiotherapy of optic pathway gliomas: tolerance and long-term outcome. Int J Radiat Oncol Biol Phys. 2005; 62: 814-9
- 23)
- Tihan T, Zhou T, Holmes E, et al. The prognostic value of histological grading of posterior fossa ependymomas in children: a Children’s Oncology Group study and a review of prognostic factors. Mod Pathol. 2008; 21: 165-77
- 24)
- Korshunov A, Golanov A, Sycheva R, et al. The histologic grade is a main prognostic factor for patients with intracranial ependymomas treated in the microneurosurgical era: an analysis of 258 patients. Cancer. 2004; 100: 1230-7
- 25)
- Merchant TE, Li C, Xiong X, et al. Conformal radiotherapy after surgery for paediatric ependymoma: a prospective study. Lancet Oncol. 2009; 10: 258-66
- 26)
- Korshunov A, Witt H, Hielscher T, et al. Molecular staging of intracranial ependymoma in children and adults. J Clin Oncol. 2010; 28: 3182-90
- 27)
- Schwartzentruber J, Korshunov A, Liu XY, et al. Driver mutations in histone H3. 3 and chromatin remodelling genes in paediatric glioblastoma. Nature. 2012; 482: 226-31
- 28)
- Diaz AK, Baker SJ. The genetic signatures of pediatric high-grade glioma: no longer a one-act play. Semin Radiat Oncol. 2014; 24: 240-7
- 29)
- Cho KT, Wang KC, Kim SK, et al. Pediatric brain tumors: statistics of SNUH, Korea(1959-2000). Childs Nerv Syst. 2002; 18: 30-7
- 30)
- Wong TT, Ho DM, Chang KP, et al. Primary pediatric brain tumors: statistics of Taipei VGH, Taiwan(1975-2004). Cancer. 2005; 104: 2156-67
- 31)
- Calaminus G, Kortmann R, Worch J, et al. SIOP CNS GCT 96: final report of outcome of a prospective, multinational nonrandomized trial for children and adults with intracranial germinoma, comparing craniospinal irradiation alone with chemotherapy followed by focal primary site irradiation for patients with localized disease. Neuro Oncol. 2013; 15: 788-96
- 32)
- Matsutani M; Japanese Pediatric Brain Tumor Study Group. Combined chemotherapy and radiation therapy for CNS germ cell tumors -the Japanese experience. J Neurooncol. 2001; 54: 311-6
- 33)
- Balmaceda C, Heller G, Rosenblum M, et al. Chemotherapy without irradiation -a novel approach for newly diagnosed CNS germ cell tumors: results of an international cooperative trial. The First International Central Nervous System Germ Cell Tumor Study. J Clin Oncol. 1996; 14: 2908-15
- 34)
- Kellie SJ, Boyce H, Dunkel IJ, et al. Primary chemotherapy for intracranial nongerminomatous germ cell tumors: results of the second international CNS germ cell study group protocol. J Clin Oncol. 2004; 22: 846-53
- 35)
- Weiner HL, Wisoff JH, Rosenberg ME, et al. Craniopharyngiomas: a clinicopathological analysis of factors predictive of recurrence and functional outcome. Neurosurgery. 1994; 35: 1001-10
- 36)
- Duff J, Meyer FB, Ilstrup DM, et al. Long-term outcomes for surgically resected craniopharyngiomas. Neurosurgery. 2000; 46: 291-302
- 37)
- Tomita T, Bowman RM. Craniopharyngiomas in children: surgical experience at Children’s Memorial Hospital. Childs Nerv Syst. 2005; 21: 729-46
- 38)
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10
- CQ1
- 脳腫瘍患者の妊孕性温存療法にはどのような方法があるか?
- 推奨グレードB
-
- 1.病変の波及ならびに治療(手術,放射線治療,化学療法等)による視床下部・下垂体部のみの機能低下による不妊リスクが高いと予測される場合,治療前の十分な説明と治療後の卵巣機能のモニター,適切なエストロゲン・プロゲスチン補充療法が推奨される。
- 推奨グレードB
-
- 2.パートナーがいる女性患者では,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 3.パートナーがいない思春期以降の女性患者では,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 4.パートナーの有無にかかわらず,卵巣組織凍結保存は研究段階であるものの,胚(受精卵)または未受精卵子凍結保存までの時間的猶予がない場合や思春期前など排卵誘発が困難な場合,施行可能な施設において考慮される。
- 推奨グレードC2
-
- 5.妊孕性温存目的でのgonadotropin releasing hormone(GnRH)アゴニストの使用は推奨されない。
- 推奨グレードB
-
- 6.思春期以降の男性患者の場合は,精子凍結保存が推奨される。
- 推奨グレードなし
-
- 7.思春期前の男児では,現時点で適用しうる妊孕性温存療法はない。
背景・目的
脳腫瘍は他の腫瘍に比べ小児・AYA 世代に発症することが多い。また,手術,放射線治療,化学療法によって視床下部・下垂体機能,性腺機能が障害を受けることは,治療後の性機能や妊孕性の低下の原因となる。とりわけ若年者においては,このことは深刻であり,原疾患の完治後長期間を経過したのちに問題が顕在化する可能性もある。そこで,治療前の生殖機能に与える影響の十分な評価とその対策を検討することが重要となる。
本CQ では,①手術,頭部への放射線照射などにより視床下部・下垂体機能低下による生殖機能障害が予測される場合,②化学療法,脊髄への放射線照射などにより性腺機能障害を引き起こす場合に分けて,脳腫瘍患者に対する妊孕性温存療法の検討を行った。
解説
1.手術,頭部への放射線照射などにより視床下部・下垂体機能低下による生殖機能障害が予測される場合
ASCO のガイドライン2013 では,40Gy の頭部放射線照射で治療後の無月経が発症すると記載されている。また,日本小児内分泌学会の小児がん経験者(childhood cancer survivors:CCS)のための医師向けフォローアップガイド(ver1.1)では,30Gy 以上の頭部放射線照射でゴナドトロピン分泌能の障害から性腺機能低下症を来す危険性の上昇の可能性が指摘されている。また,頭部への18Gy 以上の中等量の照射では一過性のゴナドトロピン分泌過剰から思春期早発症を発症し,その後に性腺機能低下を招く可能性が指摘されている。また,視床下部・下垂体に対する外科的治療も中枢性性腺機能低下症の原因となる可能性がある。これら中枢性性腺機能低下症においては,精巣や卵巣機能そのものが障害を受けるわけではないため,事前の配偶子や胚(受精卵)凍結等の妊孕性温存療法は不要であるものの,二次性に精巣や卵巣の機能停止状態を発症するため,思春期以降のホルモン(テストステロン・エストロゲンおよびプロゲスチン)補充療法や,将来の妊娠を目指す時点での早期から排卵誘発等の不妊治療の必要性まで含めた情報提供が重要となる。
2.化学療法,脊髄への放射線照射などにより性腺機能障害を引き起こす場合
脳腫瘍に限らず一般的ながん治療において,ASCO のガイドライン2013 では,思春期前の女児に対する10〜15Gy の骨盤放射線照射,30 代女性に対する5g/m2 のシクロホスファミド投与で中等度の卵巣毒性を伴うと記載されている。このリスクは,治療後の無月経発症リスクを示しており,卵巣予備能への影響と中長期的な早発卵巣不全発症リスクを示すものではないため注意が必要である。患者の年齢や出産歴,希望などを考慮し,卵巣機能障害発症リスクを伴う治療を行う場合には事前の妊孕性温存の適応となる。パートナーの有無,治療開始までの時間的猶予によって,胚(受精卵)凍結,未受精卵子凍結,卵巣組織凍結などが選択される。パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。また,GnRH アゴニスト製剤による卵巣休眠療法に関しては,非侵襲的な方法による卵巣毒性そのものを緩和する方法であり,多くの前方視的研究が実施されているものの,現時点では妊孕性温存の観点からは,その効果判定に否定的な見解が主流となりつつある1-3)。
男性患者の場合には,視床下部・下垂体機能低下による生殖機能障害に対しては内分泌補充療法が実施される。一方,化学療法により性腺機能障害を引き起こすリスクが高い場合には,治療前の精子凍結保存が推奨される。
参考にした二次資料
- Loren AW, Mangu PB, Beck LN, et al. Fertility preservation for patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol. 2013; 31: 2500-10
- 日本小児内分泌学会 CCS 委員会.小児がん経験者(CCS)のための医師向けフォローアップガイド(ver1.2)2016.
http://jspe.umin.jp/medical/gui.html (accessed October 14, 2016)
引用文献
- 1)
- Blumenfeld Z, Evron A. Endocrine prevention of chemotherapy-induced ovarian failure. Curr Opin Obstet Gynecol. 2016; 28: 223-9 (レビュー)
- 2)
- Demeestere I, Brice P, Peccatori FA, et al. No evidence for the benefit of gonadotropin-releasing hormone agonist in preserving ovarian function and fertility in lymphoma survivors treated with chemotherapy: final longterm report of a prospective randomized trial. J Clin Oncol. 2016; 34: 2568-74 (Ⅱ)
- 3)
- Lambertini M, Boni L, Michelotti A, et al. Ovarian suppression with triptorelin during adjuvant breast cancer chemotherapy and long-term ovarian function, pregnancies, and disease-free survival. JAMA.2015; 314: 2632-40(Ⅱ)
- CQ2
- 脳腫瘍患者が治療開始に先立ち妊孕性温存を希望した場合,妊孕性温存療法に伴う治療開始遅延は容認されるか?
- 推奨グレードC1
- 原疾患の治療のタイミングと患者の状態を考慮に入れた上で,可能な限り早期にがん治療を開始することが望ましい。
背景・目的
治療が終了して寛解状態となり,妊娠・分娩を希望する患者が増えている。また治療開始に先立ち,妊孕性温存を希望する患者も増えつつある。一方で,脳腫瘍は150 種類の腫瘍型が存在し,治療法,治療期間,治療が妊孕性温存に影響する度合いは様々である1)。そこで,脳腫瘍患者が治療開始に先立って妊孕性温存を希望した場合,妊孕性温存に伴う治療開始の遅延がどこまで許容されるかに関して検討した。
解説
脳腫瘍には予後のまったく異なる多彩な性質の腫瘍が含まれ,それぞれの腫瘍の性質に応じて,外科的治療,放射線治療,化学療法が行われる。妊娠に影響しうる放射線治療や化学療法開始前には妊孕性温存療法の検討が求められるが,緊急での髄液環流ルート変更(第3 脳室開窓術,脳室ドレナージ術,脳室腹腔短絡術)や腫瘍摘出術などの外科的治療が必要な場合があり,さらに神経症状や内分泌症状,ドレナージなどの管理をしながら,早急にがんの治療開始を求められる場合など,妊孕性温存のための時間的・状態的余裕がないことが少なくない。現在のところ脳腫瘍患者について,がん治療開始遅延の容認される期間および妊娠許可に関する明確なエビデンスはない2)。
脳腫瘍の発生部位や,手術・化学療法の内容や放射線治療の部位・範囲によっては,視床下部・下垂体および性腺が障害されて性ホルモンの産生が低下,卵子および精子の数が減少する場合がある3-5)。
一方でその腫瘍の種類に応じて,治療は生検を先行させ,化学放射線治療を行い,残存腫瘍があれば二次的に残存腫瘍を摘出するもの,全摘術を計画し,残存腫瘍に対して,あるいは補助化学療法目的で化学放射線治療を行うものも存在する。また,標準治療に末梢血幹細胞移植を用いた大量化学療法を用いるものさえある。一方,予後の観点から見れば生存中央値が12 カ月に満たないびまん性浸潤性橋神経膠腫(DIPG)から,5 年生存割合が80%に達する髄芽腫や,さらに治癒率の高いジャーミノーマも存在する6)。
よって,治療開始前に当該患児(患者)における妊孕性温存療法がどの程度の時間を必要とし,治療遂行計画のどの段階で妊孕性温存療法を施行するかを必ず提案しなければならない腫瘍から,予後不良の腫瘍のため妊孕性温存療法の遂行が治療計画の延期により生命予後をさらに短くする,またはパートナーを得たり妊娠可能な年齢まで生存する可能性が極めて低いなど,妊孕性温存療法を断念せざるを得ない場合まで,極めて多彩な術前状況が考えられる6)。
このため当該腫瘍の治療をできるだけ優先しながら,妊孕性温存療法を多職種によるチームで作成する治療計画を当該治療施設で最大限に計画立案する体制を整えなければならない。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Children’s Oncology Group. Long-Term Follow-Up Guidelines for Survivors of Childhood, Adolescent, and Young Adult Cancers, Version 4.0. Available at.
http://survivorshipguidelines.org/(accessed August 07, 2016) - 日本小児内分泌学会CCS 委員会. 小児がん経験者(CCS)のための医師向けフォローアップガイド(ver1.1)2011. Available at.
http://jspe.umin.jp/medical/gui.html(accessed August 07, 2016) - 関口将軌,三善陽子,左合治彦.小児がん既往妊娠.周産期医学.2016; 46: 1263-7
引用文献
- 1)
- Louis DN, Ohgaki H, Wiestler OD, et al. (eds). WHO Classification of Tumours of the Central Nervous System. IARC Press, Lyon, 2016 (その他)
- 2)
- Hyman JH, Tulandi T. Fertility preservation options after gonadotoxic chemotherapy. Clin Med Insights Reprod Health. 2013; 7: 61-9 (Ⅵ)
- 3)
- De Mas P, Daudin M, Vincent MC, et al. Increased aneuploidy in spermatozoa from testicular tumour patients after chemotherapy with cisplatin, etoposide and bleomycin. Hum Reprod. 2001; 16: 1204-8 (Ⅵ)
- 4)
- Meirow D, Lewis H, Nugent D, et al. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Hum Reprod. 1999; 14: 1903-7(Ⅵ)
- 5)
- Littley MD, Shalet SM, Beardwell CG, et al. Radiation-induced hypopituitarism is dose-dependent. Clin Endocrinol Oxf. 1989; 31: 363-73 (Ⅵ)
- 6)
- 松谷雅生.脳腫瘍治療学.金芳堂,京都,2016 (Ⅴ)
- CQ3
- 脳腫瘍患者が挙児を希望した場合,治療終了後いつから挙児または妊娠可能となるか?
- 推奨グレードC1
-
- 1.催奇形性を有する抗がん薬については,抗がん薬や代謝産物が体内から検出されなくなる,またはそれに相当する期間が経過するまでの避妊が考慮される。
- 推奨グレードC1
-
- 2.妊娠の許可にあたっては,関連する診療科による総合的判断が考慮される。
背景・目的
近年脳腫瘍の治療成績向上に伴い,治療後に妊娠・挙児を希望する若年がん患者が増えている。寛解状態を長期間維持して医師から妊娠許可が得られた患者のみならず,挙児を希望中に脳腫瘍と診断されて,がんの治療との兼ね合いに悩む場合もある。脳腫瘍患者は原病および治療により視床下部・下垂体機能異常や神経認知機能異常・てんかんなどを合併する可能性があるため,妊娠・分娩を希望する患者には慎重に対応する必要がある。そこで,脳腫瘍患者が挙児を希望した場合,治療終了後いつから挙児または妊娠可能となるか検討した。
解説
小児脳腫瘍は,希少疾患である上,比較的まとまった臨床研究がなされ長期生存が得られるようになったのが1990 年代以後であるため,世界的に前方視的治療研究をベースにした妊娠・分娩の報告はまだない。そのため性腺機能障害の報告や小児がん経験者の大規模コホート研究であるChildhood Cancer Survivor Study (CCSS) などの妊娠・分娩報告の参照にとどまっている1-6)。小児とAYA 世代に認められるジャーミノーマは,アルキル化薬を使用しなければ治療による性腺への影響は高くなく,発生部位による内分泌異常への対応が中心となる。AYA 世代で頻度の高い下垂体腺腫,髄膜腫,神経鞘腫は,手術療法が治療の中心であり,病変部位に基づく内分泌機能への配慮は必要だが,性腺を直接障害することはない。同様に頻度の高い神経膠腫は,妊孕性に影響するアルキル化薬であるテモゾロミドの使用や高線量の放射線治療を行うことが多いが,治療成績が不良であるため妊孕性に関する報告はほとんどない。したがって,推奨作成にあたっては,他の腫瘍および非がん患者に対するエビデンスを参考にしながら,脳腫瘍患者の特徴に沿う形となるよう留意した。
脳腫瘍の発生部位,化学療法の内容,放射線治療の部位や範囲によっては,視床下部・下垂体および性腺が障害されて性ホルモン産生が低下し,卵子および精子の数が減少する場合がある。女性も男性も,がんの治療中および治療後の一定期間は避妊するべきであると考えられる。女性では一般に原始卵胞が発育して排卵に至るまで約6 カ月間を必要とする。原始卵胞数は加齢とともに減少するが,化学療法や放射線治療により急激に減少する7, 8)。治療により発育卵胞とその発育を支持する周囲結合組織や血管が障害される9, 10)。
脳腫瘍患者の妊娠許可の時期は疾患により判断が異なる。例えば乳幼児期から学童期に好発する髄芽腫は,5 年後の再発率は低く11),妊娠可能時期に腫瘍自体が問題になることは少ない。ジャーミノーマは思春期から若年成人に好発するが,治療期間も短く,高い治癒率が期待できる。小児低悪性度神経膠腫は,成人の低悪性度神経膠腫と異なり悪性転化は稀で,化学療法を要する非全摘例も思春期を越えると腫瘍制御が安定することが多い。成人型の神経膠腫は生存曲線における明確なプラトーが認められず,高悪性度神経膠腫の2 年生存割合は極めて不良で神経症状も厳しい。担がん状態では妊娠中に腫瘍が増悪する場合もあるため12),がんの治療前に受精卵あるいは未受精卵子を凍結保存してある場合も,腫瘍医,脳神経外科医,産婦人科医により妊娠継続が可能な母体であるか総合的に検討してから妊娠を許可すべきである。
脳腫瘍患者では,脳腫瘍自体もしくは治療によって視床下部-下垂体-性腺系が障害される場合があるほか,神経認知機能異常・てんかんなどを合併する可能性があり,妊娠・分娩を希望する患者には慎重に対応する必要がある。頭部への放射線照射による下垂体機能低下症の頻度は,照射線量により異なり,治療後時間経過とともに明らかとなる13, 14)。髄芽腫治療後の女性では,原発性性腺機能不全とホルモン補充療法の頻度は,全脳・全脊髄照射(craniospinal irradiation:CSI)36Gy の方が24Gy より高く,大量化学療法を含む治療が最も頻度が高いとの報告がある15)。シクロホスファミドとシスプラチンを中心とした幹細胞救済併用の強化化学療法と放射線治療を行う,小児髄芽腫での代表的レジメンの一つであるSJMB96 で治療された胎児性脳腫瘍〔髄芽腫,primitive neuroectodermal tumors (PNET),AT/RT〕では,思春期早発・遅発が約1/4 に認められ,8 割に原発性卵巣機能不全を生じたが,半数近くが回復した16)。3 次元原体照射が用いられたSJMB96 では,視床下部・下垂体の線量は,CSI 24Gy と局所照射を行う標準リスク群では40Gy,CSI 39.6Gy と局所照射を行う高リスク群では50Gy に相当し,卵巣線量は5〜6Gyに相当する16)。陽子線が用いられる場合,CSI での卵巣線量は無視できる。また,テント下腫瘍の場合,CSI 線量は変わらなくても,陽子線での局所照射は照射野が限定されるため,視床下部・下垂体線量は多少低くなる17)。女性では視床下部・下垂体30Gy 以上,卵巣5Gy 以上で妊娠・分娩数低下と報告されることが多いが,視床下部・下垂体22〜27Gy でも妊孕性低下が報告されている18)。1〜9Gy の卵巣照射では思春期前後で影響が異なる可能性がある4)。
卵巣機能低下症を来した女性患者では,一般に女性ホルモン補充としてカウフマン治療を行うが,挙児を希望する場合は症例に適した卵巣刺激法を選択する。脊髄照射で卵巣が照射野に含まれた場合の卵巣機能不全とは別に,子宮が照射野に含まれた場合の子宮筋の線維化による伸展障害,子宮容量の減少,血管障害,内膜障害などによる流産・早産の可能性19),白金製剤による腎障害や,主にAT/RT で使用されるアントラサイクリン系薬剤による心不全20)などのリスクがある。脳腫瘍治療後の女性が妊娠した場合には,妊娠から分娩に至るまでリスクに応じたフォローアップが必要である。脳室腹腔短絡術を施行した場合には妊娠許可について慎重な検討が必要と考えられるが,妊娠した場合はシャント圧の厳密な管理が必要であり,また,脳室心房短絡術などの再建術も考慮する必要が生じる。
ゴナドトロピン分泌が低下した男性患者ではhCG (human chorionic gonadotropin) 治療が行われるが,挙児を希望する場合はhCG/rFSH (recombinant follicle stimulating hormone) 治療を選択する。がん治療による精子数の減少は治療強度により異なり,一過性で治療後に回復する場合があるため,精液検査は繰り返し行う必要がある。男性患者の場合,精子形成回復期における精子異数性の発現は抗がん薬に起因する可能性があり,適切な期間の避妊の必要性について説明を行う21)。がん治療による細胞障害は精子形成過程の各段階により異なる22)。活発に再生・増殖している精原細胞が最も強く障害され,精原細胞のプールが枯渇すると無精子症となる。放射線治療の影響は非分裂細胞である精子への分化過程では少ない。精子形成はおよそ70 日を要するため,照射直後は精巣内に遺残した精子細胞の分化により妊孕性が維持される。化学療法直後に妊娠した場合は遺伝カウンセリングについて検討する。がんの治療前の凍結保存精子があれば,夫婦が希望した時期に不妊治療を行うことが可能である。神経系の障害により勃起・射精障害を来した患者や,性ホルモン補充療法を行ったにもかかわらず無精子症の状態が改善しない患者では,精巣内精子採取術(testicular sperm extraction:TESE)や顕微授精(intracytoplasmic sperm injection:ICSI)の適応となる。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- Children’s Oncology Group. Long-Term Follow-Up Guidelines for Survivors of Childhood, Adolescent, and Young Adult Cancers, Version 4.0. Available at: http://www.survivorshipguidelines.org(accessed August 07, 2016)
- 日本小児内分泌学会CCS 委員会.小児がん経験者(CCS)のための医師向けフォローアップガイド(ver1.2)2016. Available at: http://jspe.umin.jp/medical/gui.htm(l accessed October 14, 2016)
- 関口将軌,三善陽子,左合治彦.小児がん既往妊娠.周産期医学.2016; 46: 1263-7
引用文献
- 1)
- Eric J Chow, Kayla L Stratton, Wendy M Leisenring, et al. Pregnancy after chemotherapy in male and female survivors of childhood cancer treated between 1970 and 1999: a report from the Childhood Cancer Survivor Study cohort. Lancet Oncol. 2016; 17: 567-76 (Ⅳa)
- 2)
- Hudson MM, Ness KK, Gurney JG, et al. Clinical ascertainment of health outcomes among adults treated for childhood cancer. JAMA. 2013; 309: 2371-81 (Ⅳa)
- 3)
- blue DM, Kawashima T, Stovall M, et al. Fertility of female survivors of childhood cancer: a report from the childhood cancer survivor study. J Clin Oncol. 2009; 27: 2677-85 (Ⅳa)
- 4)
- blue D, Sklar C, Boice J, et al. Ovarian Failure and Reproductive Outcomes After Childhood Cancer Treatment: Results From the Childhood Cancer Survivor Study. J Clin Oncol. 2009; 27: 2374-81 (Ⅳa)
- 5)
- Gunnes MW, Lie RT, Bjørge T, et al. Reproduction and marriage among male survivors of cancer in childhood, adolescence and young adulthood: a national cohort study. Br J Cancer. 2016; 114: 348-56 (Ⅳa)
- 6)
- Kenney LB, Cohen LE, Shnorhavorian M, et al. Male reproductive health after childhood, adolescent, and young adult cancers: a report from the Children’s Oncology Group. J Clin Oncol. 2012; 30: 3408-16 (Ⅵ)
- 7)
- Wallace WH, Thomson AB, Kelsey TW. The radiosensitivity of the human oocyte. Hum Reprod. 2003; 18: 117-21 (Ⅵ)
- 8)
- Meirow D, Lewis H, Nugent D, et al. Subclinical depletion of primordial follicular reserve in mice treated with cyclophosphamide: clinical importance and proposed accurate investigative tool. Hum Reprod. 1999; 14: 1903-7(Ⅵ)
- 9)
- Morgan S, Anderson RA, Gourley C, et al. How do chemotherapeutic agents damage the ovary? Hum Reprod Update. 2012; 18: 525-35 (Ⅵ)
- 10)
- Meirow D, Biederman H, Anderson RA, et al. Toxicity of chemotherapy and radiation on female reproduction. Clin Obstet Gynecol. 2010; 53: 727-39 (Ⅵ)
- 11)
- Roger J. Packer, Tianni Zhou, Emi Holmes, et al. Survival and secondary tumors in children with medulloblastoma receiving radiotherapy and adjuvant chemotherapy: results of Children’s Oncology Group trial A9961. Neuro Oncol. 2013; 15: 97-103 (Ⅳa)
- 12)
- Shlomit Yust-Katz, John F. de Groot, Diane Liu, et al. Pregnancy and glial brain tumors. Neuro Oncol. 2014; 16: 1289-94 (Ⅴ)
- 13)
- Littley MD, Shalet SM, Beardwell CG, et al. Radiation-induced hypopituitarism is dose-dependent. Clin Endocrinol Oxf. 1989; 31: 363-73 (Ⅵ)
- 14)
- Chemaitilly W, Li Z, Huang S, et al. Anterior hypopituitarism in adult survivors of childhood cancers treated with cranial radiotherapy: a report from the St Jude Lifetime Cohort study. J Clin Oncol. 2015; 33: 492-500 (Ⅳb)
- 15)
- Sadana Balachandar, Ira J. Dunkel, Yasmin Khakoo, et al. Ovarian function in survivors of childhood medulloblastoma: impact of reduced dose craniospinal irradiation and high-dose chemotherapy with autologous stem cell rescue. Pediatr Blood Cancer. 2015; 62: 317-21 (Ⅴ)
- 16)
- DeWire M, blue D, Sklar C, et al. Pubertal development and primary ovarian insufficiency in female survivors of embryonal brain tumors following risk-adapted craniospinal irradiation and adjuvant chemotherapy. Pediatr Blood Cancer. 2015; 62: 329-34 (Ⅳa)
- 17)
- Yock T, Yeap B, Ebb D, et al. Long-term toxic effects of proton radiotherapy for paediatric medulloblastoma: a phase 2 single-arm study. Lancet Oncol. 2016; 17: 287-98 (Ⅳa)
- 18)
- Daniel M. blue, Vikki G. Nolan, Toana Kawashima, et al. Decreased fertility among female childhood cancer survivors who received 22 to 27Gy hypothalamic/pituitary irradiation. A report from the childhood cancer survivor study. Fertil Steril. 2011; 95: 1922-7 (Ⅳa)
- 19)
- Signorello LB, Mulvihill JJ, blue DM, et al. Stillbirth and neonatal death in relation to radiation exposure before conception: a retrospective cohort study. Lancet. 2010; 376: 624-30 (Ⅳa)
- 20)
- Armenian AH, Hudson MM, Mulder RL, et al. Recommendations for cardiomyopathy surveillance for survivors of childhood cancer: a report from the International Late Effects of Childhood Cancer Guideline Harmonization Group. Lancet Oncol. 2015; 16: e123-36 (Ⅵ)
- 21)
- De Mas P, Daudin M, Vincent MC, et al. Increased aneuploidy in spermatozoa from testicular tumour patients after chemotherapy with cisplatin, etoposide and bleomycin. Hum Reprod. 2001; 16: 1204-8 (Ⅴ)
- 22)
- Meistrich ML. Effects of chemotherapy and radiotherapy on spermatogenesis in humans. Fertil Steril. 2013; 100: 1180-6 (Ⅵ)
消化器
- 総説
消化器領域のがんには,食道,胃,大腸,肝,胆道,膵の5 臓器が含まれる。いずれも高齢者に多く,若年発症においては遺伝性疾患の関連も少なくない(CQ2)。消化器がんの多くは早期発見できれば内視鏡治療や外科的切除によって治癒が得られるが,進行例においては骨盤内の手術手技や周術期補助化学(放射線)療法による妊孕性への影響に注意を要する(CQ1, CQ2)。また,卵巣などに転移浸潤を認める場合や,切除不能および再発例では,妊孕性温存については予後を考慮して慎重に検討すべきである(CQ1,CQ2)。一般的に消化器がんで頻用される抗がん薬には高リスクは少ないが,いずれも催奇性があることに注意を要する。妊孕性に関する消化器領域のエビデンスは少なく,がんに特別な妊孕性温存方法(CQ3)や妊娠可能となる時期(CQ4)は,他臓器のがんと同様である。
1.疫学
一般に,消化器領域のがんの発生は高齢者に多く,妊孕性温存が問題となる40 歳以下の発症頻度は1%程度またはそれ以下であるが(表10-1),部位別にみると,いくつかの特徴がある。本邦の食道がんの90%以上は扁平上皮がんで,飲酒・喫煙がリスク因子である。年代別では,40 代後半から増え始め,高齢になるにつれて増加する。胃がんはヘリコバクターピロリ菌が原因の一つとされ,1960 年代から減少傾向にあるが,発生頻度は第2 位である。多くは40 代以降に発生するが,スキルス胃がんの発生は20 代の女性にも小さなピークがあることが注目される。大腸がんは近年増加傾向にあり,2012 年の罹患数では第1 位である。若年発症の大腸がんには家族性大腸腺腫症やリンチ症候群などの遺伝性悪性疾患がある(CQ2)。肝細胞がんの発生には,肝炎ウイルスの持続感染が関与するが,1935 年前後の出生者をピークとして,最近では若年性の発症は少ない。膵がんも60 代から増加し,40 歳未満での発症は稀である。胆道がんの中で胆囊がんの発症率は女性が男性の1.5 倍であるが,近年減少傾向にあり,若年での発症は稀である。
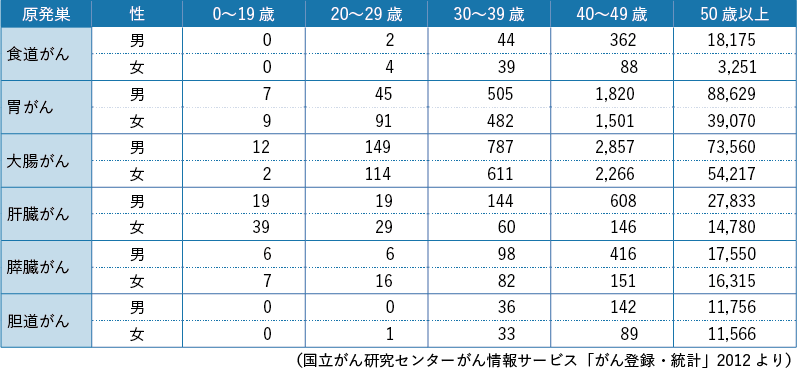
2.病態
2-1.食道がん
粘膜内にとどまる場合には早期がんと定義され,リンパ節転移や遠隔転移の頻度が低く,内視鏡的切除術にて治癒が期待できるが,粘膜下層より深くなるとリンパ節転移が高頻度に認められる。さらに進行すると,肝,肺,骨などの遠隔転移を伴う。また,食道は気管,肺,心臓,大動脈に隣接しているため,これらに浸潤した(T4)場合には,遠隔転移がなくても呼吸困難や出血などにより致死的となりうる。
2-2.胃がん
粘膜下層までの浸潤の場合には早期がん,筋層以上の浸潤を認める場合は進行がんとして分類される。早期がんは,内視鏡的切除術や外科的切除術により90%以上の治癒率が得られるが,進行するに伴い,リンパ節や肝転移などの遠隔転移の頻度が増えるだけでなく,特にスキルス胃がんでは腹膜転移を伴うことが多い。腹膜転移が高度になると,消化管通過障害や腹水,水腎症,閉塞性黄疸などの原因となる。
2-3.大腸がん
胃がんと同様に,粘膜下層までの浸潤の場合には早期がん,筋層以上の浸潤を認める場合は進行がんとして分類される。早期がんは,内視鏡的切除術や外科的切除術により90%以上の治癒率が得られるが,進行すると消化管閉塞などの症状を伴い,肝や肺などの遠隔転移を伴う。また,直腸がんでは前立腺,膀胱,仙骨などの隣接臓器に浸潤し,疼痛や排便・排尿困難などの症状を伴う。
2-4.肝がん
原発性肝がんは,肝細胞がんと胆管細胞がんに分類されるが,本章では胆管細胞がんは胆道がんに含める。肝細胞がんは,慢性肝炎および肝硬変を伴っており,がんの進行度だけでなく,肝予備能によって予後が異なる。症状としては,黄疸や倦怠感などの肝機能低下によるものと,腹水や静脈瘤などの肝硬変や門脈浸潤による門脈圧亢進に伴うものと,腹満感や腫瘍の破裂などの腫瘍自体によるものがある。
2-5.膵がん
早期発見が難しく,遠隔転移しやすいため,最も予後の悪いがんの一つである。膵頭部が原発の場合には,閉塞性黄疸で発見されることも少なくない。膵臓の背側にある上腸間膜動脈などの血管に浸潤すると切除不能(局所進行)とされる。肝転移などの遠隔転移が多いが,胃がんと同様に腹膜転移を伴うことも多い。
2-6.胆道がん
胆道がんは,肝内胆管がん,肝外胆管がん,胆囊がん,十二指腸乳頭部がんを含む。早期発見は難しく,黄疸で発症することが多い。進行すると,遠隔転移を伴うが,局所での進行による胆管閉塞に伴い胆管炎を併発する。
3.治療の概要
3-1.食道がん
粘膜内にとどまるEP, LPM 病変では,リンパ節転移は極めて稀で,内視鏡的切除術の適応となる1)。粘膜下層まで浸潤したT1b については,外科的切除単独が標準治療であるが,5-FU とシスプラチン(FP)併用の化学放射線療法でも4 年生存割合81%と,良好な治療成績が報告されている2)。また,Stage Ⅱ/Ⅲ(T4 を除く)食道がんに対しては,FP を用いた術前補助化学療法を行うことが標準治療であり,5 年生存割合は55%と報告されているが3),FP 併用の化学放射線(FP-RT)療法も根治を目指すことのできる治療選択肢の一つである(5 年生存割合37%)4)。また,遠隔転移がなくても気管や大動脈浸潤により切除不能な局所進行例に対してFP-RT によって20%程度の治癒が得られる5)。遠隔転移を伴うStage Ⅳまたは術後再発症例に対して,一次化学療法としてFP 療法が標準治療とみなされており6),二次化学療法ではパクリタキセル7)が広く用いられているが,化学療法のみでは生存期間中央値は1 年未満であり,根治を得ることは極めて難しい。
3-2.胃がん
粘膜内にとどまるT1a までの病変でリンパ節転移の可能性が極めて低く,腫瘍が一括切除できる大きさと部位にある場合には,内視鏡的切除術の適応となる8)。内視鏡的切除術の適応とならないStage ⅠからStage Ⅲまでは胃切除術と進行度に応じて2 群までのリンパ節郭清を行うが9),病理学的にStage ⅡまたはⅢであることが確認された場合には,外科的切除単独の5 年生存割合は60〜65%であるのに対して,術後補助化学療法として,S-1 単独療法10)を1 年間またはカペシタビンとオキサリプラチン併用(CapeOX)療法11)を6 カ月行うことにより70〜75%に向上する。切除不能・再発胃がんに対しては,一次化学療法としてS-1 やカペシタビンなどのフッ化ピリミジンとシスプラチンやオキサリプラチン併用療法(HER2 陽性の場合には,トラスツズマブ併用)12, 13)が標準治療とされており,二次化学療法としてはパクリタキセルと血管新生阻害薬であるラムシルマブの併用14)が推奨されている。三次化学療法の延命効果は比較試験で検証されていないが,イリノテカンが用いられている15)。ただし,化学療法のみでは,生存期間中央値は13〜14 カ月であり,根治を得ることは極めて難しい。
3-3.大腸がん
大腸がんには,直腸がんと結腸がんが含まれる。いずれも,腺腫,cTis(M)癌およびcT1(SM)軽度浸潤病変の場合には,内視鏡的切除術の良い適応となる16)。また,Stage Ⅰ〜Ⅲは外科的に切除されるが,high risk Stage ⅡおよびStage Ⅲ症例に対しては,術後補助化学療法として,フッ化ピリミジン単独17)またはオキサリプラチンとの併用療法18)を6 カ月行う。本邦ではStage Ⅲに対してフッ化ピリミジン単独による術後補助化学療法によって,約75%の無病生存率が得られる17)。ただし,若年者に多いリンチ症候群などにみられるmicrosatellite instability high の症例は,比較的予後が良好であり,術後補助化学療法の意義については見解が分かれている。肝や肺などに転移があっても,外科的に切除された場合には40%程度の5 年生存率が得られるが,Stage Ⅳ症例に対する術後補助化学療法の意義は確立されていない19)。切除不能症例に対しては,フッ化ピリミジン,オキサリプラチン,イリノテカンなどの殺細胞性の抗がん薬と,血管新生阻害薬であるベバシズマブ20)およびRAS 遺伝子野生型に対しては抗ヒト上皮成長因子受容体(epidermal growth factor receptor:EGFR)抗体薬であるセツキシマブ21),パニツムマブ22)が併用される。また,レゴラフェニブ23)やトリフルリジン・チピラシル24)がsalvage line の治療として用いられている。切除不能症例は基本的に化学療法のみでは,生存期間中央値は約30 カ月であり,根治を得ることは極めて難しいが,化学療法が著効して切除可能にconversion した場合には40%程度の5 年生存率が得られる25)。欧米では,局所再発防止や肛門機能温存を目指して,直腸がんに対して術前にフッ化ピリミジンを用いた化学放射線療法が広く行われているが,本邦では側方リンパ節郭清を伴う外科的切除術を行うことが標準治療とされている。これに伴い,神経叢を切除または損傷すると性機能が低下する26)。
3-4.肝がん
B 型肝炎,C 型肝炎および肝硬変をベースに発症することが多く,多発であることが少なくない。病期だけでなくChild-Pugh 分類などで評価される肝機能が治療法選択に大きく影響する(図10-1)。外科的切除術または焼灼療法前後の補助化学療法の意義は確立していない。切除不能であっても肝に限局する場合には,塞栓療法が行われる。遠隔転移がある場合や塞栓療法を含めた局所療法が不可能となった場合には,全身化学療法が行われる。血管新生阻害薬であるソラフェニブ27)が標準治療とされているが,生存期間中央値は10 カ月程度である。
3-5.膵がん
早期発見が難しく,また,T1 であっても遠隔転移の頻度が高い。切除可能な症例に対しては,外科的切除が基本であるが,5 年生存率10〜20%と,極めて予後不良である。最近,術後補助化学療法としてS-1 単独療法を6 カ月行うことにより,40%の5 年生存率が報告されている28)。遠隔転移がなくても,上腸間膜動脈などの重要な血管に浸潤する場合には,局所進行膵がんとして切除不能とされ,化学放射線療法を行うこともあるが,放射線治療の意義は確定していない。切除不能・再発例に対して,従来はゲムシタビン単剤29)または抗EGFR 阻害薬であるエルロチニブ30)の併用療法が用いられていたが,最近は5-FU,オキサリプラチン,イリノテカンの3 剤を併用したFOLFIRINOX 療法31)またはゲムシタビンとnab-パクリタキセルの2 剤併用療法32)が標準治療とされている。化学療法のみでの生存期間中央値は11 カ月程度であり,根治を得ることは極めて難しい。
3-6.胆道系がん
肝内胆管がん,肝外胆管がん,胆囊がん,Vater 乳頭部がんが含まれる。本邦の取扱い規約では,肝内胆管がんは肝臓がんに分類されるが,本書では胆道系がんに含める。健診などで発見される胆囊がんを除いて,早期発見は困難である。切除可能な場合には外科的切除術が基本であるが,術前後の補助化学療法は確立していない。5 年生存割合は,胆管がん26%,胆囊がん42%,Vater 乳頭部がん51%と報告されている。切除不能・再発例に対しては,一次化学療法としてゲムシタビンとシスプラチンの併用療法33)が標準治療とされており,二次化学療法の意義は確立されていないが,本邦ではS-134)が用いられることが多い。化学療法のみでは,生存期間中央値は約11 カ月であり,根治を得ることは極めて難しい。
4.予後


引用文献
- 1)
- 日本食道学会 編.食道癌診断・治療ガイドライン2012 年4 月版.金原出版,東京,2012
- 2)
- Kato H, Sato A, Fukuda H, et al. A phase II trial of chemoradiotherapy for stage I esophageal squamous cell carcinoma: Japan Clinical Oncology Group Study (JCOG9708). Jpn J Clin Oncol. 2009; 39: 638-43
- 3)
- Ando N, Kato H, Igaki H, et al. A randomized trial comparing postoperative adjuvant chemotherapy with cisplatin and 5-fluorouracil versus preoperative chemotherapy for localized advanced squamous cell carcinoma of the thoracic esophagus (JCOG9907). Ann Surg Oncol. 2012; 19: 68-74
- 4)
- Kato K, Muro K, Minashi K, et al. Phase II study of chemoradiotherapy with 5-fluorouracil and cisplatin for Stage II-III esophageal squamous cell carcinoma: JCOG trial (JCOG 9906). Int J Radiat Oncol Biol Phys. 2011; 81: 684-90
- 5)
- Shinoda M, Ando N, Kato K, et al. Randomized study of low-dose versus standard-dose chemoradiotherapy for unresectable esophageal squamous cell carcinoma (JCOG0303). Cancer Sci. 2015; 106: 407-12
- 6)
- Iizuka T, Kakegawa T, Ide H, et al. Phase II evaluation of cisplatin and 5-fluorouracil in advanced squamous cell carcinoma of the esophagus: a Japanese Esophageal Oncology Group Trial. Jpn J Clin Oncol. 1992; 22: 172-6
- 7)
- Kato K, Tahara M, Hironaka S, et al. A phase II study of paclitaxel by weekly 1-h infusion for advanced or recurrent esophageal cancer in patients who had previously received platinum-based chemotherapy. Cancer Chemother Pharmacol. 2011; 67: 1265-72
- 8)
- Ono H, Kondo H, Gotoda T, et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut. 2001; 48: 225-9
- 9)
- Sasako M, Sano T, Yamamoto S, et al. D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N Engl J Med. 2008; 359: 453-62
- 10)
- Sakuramoto S, Sasako M, Yamaguchi T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. 2007; 357: 1810-20
- 11)
- Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet. 2012; 379: 315-21
- 12)
- Koizumi W, Narahara H, Hara T, et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial): a phase III trial. Lancet Oncol. 2008; 9: 215-21
- 13)
- Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010; 376: 687-97
- 14)
- Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014; 15: 1224-35
- 15)
- Kang JH, Lee SI, Lim DH, et al. Salvage chemotherapy for pretreated gastric cancer: a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone. J Clin Oncol. 2012; 30: 1513-8
- 16)
- 田中信治,樫田博史,斎藤 豊,他.大腸ESD/EMR ガイドライン.日本消化器内視鏡学会雑誌.2014; 56: 1598-1617
- 17)
- Shimada Y, Hamaguchi T, Mizusawa J, et al. Randomised phase III trial of adjuvant chemotherapy with oral uracil and tegafur plus leucovorin versus intravenous fluorouracil and levofolinate in patients with stage III colorectal cancer who have undergone Japanese D2/D3 lymph node dissection: final results of JCOG0205. Eur J Cancer. 2014; 50: 2231-40
- 18)
- André T, Boni C, Mounedji-Boudiaf L, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med. 2004; 350: 2343-51
- 19)
- Mitry E, Fields AL, Bleiberg H, et al. Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol. 2008; 26: 4906-11
- 20)
- Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol. 2008; 26: 2013-9
- 21)
- Van Cutsem E, Köhne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009; 360: 1408-17
- 22)
- Douillard JY, Siena S, Cassidy J, et al. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4)versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol. 2010; 28: 4697-705
- 23)
- Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013; 381: 303-12
- 24)
- Mayer RJ, Van Cutsem E, Falcone A, et al. Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med. 2015; 372: 1909-19
- 25)
- Lam VW, Spiro C, Laurence JM, et al. A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases. Ann Surg Oncol. 2012; 19: 1292-301
- 26)
- Traa MJ, De Vries J, Roukema JA, et al. Sexual (dys)function and the quality of sexual life in patients with col orectal cancer: a systematic review. Ann Oncol. 2012; 23: 19-27
- 27)
- Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008; 359: 378-90
- 28)
- Uesaka K, Boku N, Fukutomi A, et al. Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer: a phase 3, open-label, randomised, non-inferiority trial(JASPAC 01). Lancet. 2016; 388: 248-57
- 29)
- Burris HA 3rd, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997; 15: 2403-13
- 30)
- Moore MJ, Goldstein D, Hamm J, et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol. 2007; 25: 1960-6
- 31)
- Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med. 2011; 364: 1817-25
- 32)
- Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013; 369: 1691-703
- 33)
- Valle J, Wasan H, Palmer DH, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med. 2010; 362: 1273-81
- 34)
- Sasaki T, Isayama H, Nakai Y, et al. Multicenter phase II study of S-1 monotherapy as second-line chemotherapy for advanced biliary tract cancer refractory to gemcitabine. Invest New Drugs. 2012; 30: 708-13
- CQ1
- どのような消化器がん患者が妊孕性温存療法の適応となるか?
- 推奨グレードC1
- 不妊のリスクが高いことが予想される治療を受ける場合,治療内容や生命予後等を考慮した上で,妊孕性温存療法が考慮される。
背景・目的
消化器がんは高齢者の罹患が多いこと,難治性のがんも多いことから,妊孕性温存についての議論はあまり行われてこなかったが,近年,集学的治療や診断方法の進歩に伴い治療成績が向上し,妊孕性温存の重要性が注目されるようになっている。一方,消化器がん患者における妊孕性温存のデメリットについては明らかにされておらず,妊孕性温存の時期や手法についても定まっていない。消化器がんでは直腸がんに対する化学放射線療法が女性の高リスク,標準的な化学療法は主に中間リスクまたは低リスクに該当すると考えられるが(表10-3),米国臨床腫瘍学会(American Society of Clinical Oncology:ASCO)のガイドラインにおいて不妊となる可能性に関する情報を治療前に提供することが推奨されており,消化器がん治療における妊孕性低下のリスクについて,報告の多い大腸がんを中心に,妊孕性温存のデメリットを含めて広く検討した。
解説
直腸がんに対する手術の影響について,術後の性機能低下に関するレビューでは,男性5〜88%で術後性機能低下が認められ,主に勃起障害,射精障害が手術後に増加する。年齢,術式,神経温存の有無,放射線の併用の有無等が影響することが報告されており1),可能な場合は神経温存手術を考慮する。女性患者では,腹膜反転部より上部の結腸がん手術による妊孕性低下リスクは限定的と考えられるが2),潰瘍性大腸炎,家族性大腸腺腫症に対する回腸パウチ−肛門吻合を伴う全結腸切除術のメタアナリシスによると,妊孕性障害のリスクは3.91 倍にのぼると報告されている3)。その原因として術後の骨盤内の癒着による影響があると考察されていることから,直腸がんに対する手術では妊孕性の低下の可能性を考慮すべきである。
化学療法による影響について,50 歳以下のStage ⅡまたはⅢの結腸がん術後に対し,オキサリプラチン,5-FU/ロイコボリン(FOLFOX)療法による術後補助化学療法を実施した73 例のケースシリーズでは,評価可能な49 例中20 例(41%)で化学療法中に無月経を認め,うち8 例(16%)では化学療法終了1 年後にも無月経が持続していたと報告されている4)。また,Stage ⅡまたはⅢの結腸・直腸がん患者の検討では,術後補助化学療法(FOLFOX,XELOX,カペシタビン)を実施した結腸がん72 例中7 例(9.7%)で化学療法中に無月経を認め,うち3 例(4%)で化学療法終了1 年後にも無月経が持続していたと報告されている5)。術後補助化学放射線療法(カペシタビン±オキサリプラチン,放射線45〜55Gy)では,51 例中48 例(94.1%)で化学療法中に月経が休止し,その全例で治療後においても月経の再開を認めていない5)。その他,消化器がんに使用される抗がん薬の影響として,シスプラチンは中間リスク,5-FU は低リスクとされている(ASCO ガイドライン)が,結腸直腸がんの患者において,5-FU/ロイコボリンによる化学療法終了後に閉経状態となり,胚(受精卵)凍結保存により挙児が可能であった症例が報告されている6)。
放射線治療については,上記の直腸がんに対する術後補助化学放射線療法における妊孕性への影響に関する報告の他,直腸がんに対する放射線照射後の性ホルモンの低下が報告されている7)。また,消化器がんの検討ではないものの,Chiarelli らは女性の妊孕性低下が骨盤内への照射量20〜34.99Gy は22%,35Gy 以上は32%と報告し8),Lushbaugh らは妊孕性低下の線量として40 歳未満では20Gy,40 歳以上では6Gy と報告しており9),生殖臓器への照射線量や年齢を考慮して妊孕性低下の可能性を評価する必要があると考えられる。
一方,若年消化器がん患者を対象に妊孕性温存のデメリットについて検討した研究はない。また,生殖医療を施行した症例報告でも消化器がん患者は少なく2, 10),生殖医療が消化器がんの治療成績に与える影響は明らかでない。しかし,一般的に術後補助化学療法の開始が遅れると効果が低下するとの報告があるため,妊孕性温存のための生殖医療によってがん治療開始が遅れることにより,がん治療の効果が低下する可能性を考慮しなければならない11)。また,がん治療の効果を低下させることなく,がん治療開始をどの程度遅らせることができるかについては,前方視的研究が行われておらず,明らかにされていない。さらに,腹膜播種患者で卵巣温存を行った症例では,卵巣再発を来す可能性があり,注意を要する11)。
妊娠可能年齢の消化器がん患者に対しては,上述した妊孕性低下のリスクをふまえた上で,がんの進行度・再発リスクや予後,予想される治療スケジュールとその変更の可否,本人の希望や社会的背景(子どもの有無,パートナーの有無等),妊孕性温存を実施することによるデメリットを総合的に勘案し,妊孕性温存療法の適応について検討すべきである。特に不妊のリスクが高いことが予想される治療を受ける場合は,妊孕性温存の適応を早急に検討し,必要に応じて生殖医療を専門とする医師へ紹介することが勧められる。
妊孕性温存に関する情報提供に関して,出産可能年齢の大腸がん女性患者における治療前のカウンセリングの受診は,消化器がん108 例を含む918 例の検討では全体で61%と報告されているが12),国内では若年消化器がん患者に対する妊孕性温存に関してほとんど報告されておらず,出産可能年齢の消化器がん患者に対する情報提供体制の充実が必要であると考えられる。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- ESMO ガイドライン
- 1)
- Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013; 24(spp 6): vi160-70
- NCCN ガイドライン
Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines - 国立がん研究センターがん対策情報センター.がん情報サービス.がん登録・統計.http://ganjoho.jp/reg_stat/index.html
- 乳癌患者における妊孕性保持支援のための治療選択および患者支援プログラム・関係ガイドラインの開発班,日本がん・生殖医療研究会 編.乳がん患者の妊娠出産と生殖医療に関する診療の手引き2014 年版.金原出版,東京,2014
引用文献
- 1)
- Traa MJ, De Vries J, Roukema JA, et al. Sexual(dys)function and the quality of sexual life in patients with colorectal cancer: a systematic review. Ann Oncol. 2012; 23: 19-27 (レビュー)
- 2)
- Spanos CP, Mamopoulos A, Tsapas A, et al. Female fertility and colorectal cancer. Int J Colorectal Dis. 2008; 23: 735-43 (レビュー)
- 3)
- Rajaratnam SG, Eglinton TW, Hider P, et al. Impact of ileal puch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis. 2011; 26: 1365-74 (Ⅰ)
- 4)
- Cercek A, Siegel CL, Cpanu M, et al. Incidence of Chemotherapy-induced amenorrhea in premenopausal women treated with adjuvant FOLFOX for colorectal cancer. Clin Colorectal Cancer. 2013; 12: 163-7 (Ⅴ)
- 5)
- Wan J, Gai Y, Li G, et al. Incidence of chemotherapy- and chemoradiotherapy-induced amenorrhea in premenopausal women with stage II/III colorectal cancer. Clin Colorectal Cancer. 2015; 14: 31-4 (Ⅴ)
- 6)
- Azem F, Amit Ami, Merimsky O, et al. Successful transfer of frozen-thawed embryos obtained after subtotal coloctomy for colorectal cancer and before fluorouracil-based chemotherapy. Gynecol oncol. 2004; 93: 263-5 (Ⅴ)
- 7)
- Dueland S, Guren MG, Olsen DR, et al. Radiation therapy induced changes in male sex hormone level2s in rectal cancer patients. Radiother Oncol. 2003; 68: 249-53 (Ⅴ)
- 8)
- Chiarelli AM, Marrett LD, Darlington G. Early menopause and infertility in females after treatment for childhood cancer diagnosed in 1964-1988 in Ontario, Canada. Am J Epidemiol. 1999; 150: 245-54 (Ⅳa)
- 9)
- Lushbaugh CC, Casarett GW. The effects of gonadal irradiation in clinical radiation therapy: a review. Cancer. 1976; 37: 1111-20 (Ⅰ)
- 10)
- Elizur SE, Tulandi T, Meterissian S, et al. Fertility Preservation for Young Women with Rectal Cancer- A Combined Approach from One Referral Center. J Gastrointest Surg. 2010: 14; 1476 (Ⅴ)
- 11)
- Elias D, Duchalais E, Dartigues P, et al. A new policy regarding ovarian resection in young women treated for peritoneal carcinomatosis. Ann Surg Oncol. 2013; 20; 1837-42 (Ⅴ)
- 12)
- Letourneau JM, Smith JF, Ebbel EE, et al. Racial, socioeconomic, and demographic disparities in access to fertility preservation in young women diagnosed with cancer. Cancer. 2012; 118: 4579-88 (Ⅴ)
- CQ2
- 消化器がん患者の妊孕性温存に際し,どのような説明をすべきか?
- 推奨グレードB
-
- 1.遺伝性腫瘍と診断された場合,遺伝カウンセリングとともに同時・異時多発しうる生殖器領域がんへの対応と妊孕性について説明する。
- 推奨グレードC1
-
- 2.根治可能な場合,手術合併症,周術期補助放射線治療,周術期補助化学療法のそれぞれによる妊孕性障害の可能性について説明する。
- 推奨グレードC1
-
- 3.進行がんが直接浸潤・転移し侵された生殖器領域臓器に対する治療は,原疾患の経過・予後と妊孕性温存の双方の観点をふまえて説明する。
背景・目的
消化器がんの診療において妊孕性温存の説明が必要な病態および治療について検索を行った。
解説
消化器がん診療では,以下の病態とそれに対する治療によって妊孕性に障害を来す可能性が考えられる。
- 遺伝性腫瘍で,消化器がんのほかに生じる生殖器領域がんに関連して,発症した際の治療や予防的な手術に伴うもの
- 消化器がん原発巣等への根治的治療(手術,周術期補助放射線治療,周術期補助化学療法)に伴うもの
- 進行がんの生殖器領域臓器への浸潤・転移・再発,およびそれらに対する治療に伴うもの
1.遺伝性腫瘍に伴うもの
若年者における消化器がん診療では遺伝性腫瘍に留意が必要である。消化器がんと生殖器領域のがんの双方を発症しうる遺伝性腫瘍については以下が知られている。
- リンチ症候群:大腸がん,子宮体がん,胃がん,卵巣がん,肝胆道がん,尿路上皮がん,小腸がん,中枢神経腫瘍,皮脂腺腫瘍,膵がん,(乳がん)
- ポイツ-ジェガーズ症候群(Peutz-Jeghers syndrome):乳がん,大腸がん,胃がん,小腸がん,膵がん,卵巣腫瘍(性索腫瘍),子宮体部・頸部(minimal deviation adenocarcinoma:MDA),精巣(セルトリ細胞腫),肺がん
- 遺伝性乳癌卵巣癌(hereditary breast ovarian cancer:HBOC)症候群:乳がん,卵巣がん,前立腺がん,膵がん,悪性黒色腫
- 遺伝性びまん性胃がん(hereditary diffuse gastric cancer:HDGC):胃がん,乳がん(小葉がん)
- リ・フラウメニ症候群(Li-Fraumeni syndrome:LFS):軟部肉腫,骨肉腫,乳がん,急性白血病,大腸がん,副腎がん,脳腫瘍など
- カウデン病Cowden disease/PTEN hamartoma tumor syndrome(PHTS):乳がん,甲状腺がん,子宮体がん,脳腫瘍,大腸がん,腎細胞がん,悪性黒色腫
これらの遺伝性腫瘍に伴って生殖器領域のがんが発生した場合,その病態および治療により妊孕性障害を来す可能性が考慮される。詳細は当該領域がんについての項目を参照のこと。
遺伝性腫瘍の診断と病態の説明は遺伝カウンセリングに該当する内容であり,他項・他書に譲る。しかし,妊孕性は,医学的・身体機能的な側面だけでなく心理・社会的な側面が大きく影響するため,遺伝性腫瘍に対する遺伝カウンセリングの問題とは不可分である。また,これらの遺伝性腫瘍患者に対する女性生殖器の予防的切除については十分な遺伝カウンセリングとともに適応を検討すべきである。Stupart らはリンチ症候群患者における妊孕性を調査し,大腸がん既往のある女性患者で出生割合が対照群より有意に少ないことを報告している1)。この報告では,男性患者では出生割合の低下はみられなかったこと,女性でも20〜24 歳では年齢別出生割合が有意に低かったものの,25 歳以上では同等であったことから心理・社会的背景因子の影響があったものと考察されている。また,リンチ症候群では直腸がんの発生は結腸がんに比して少ないため,後述の治療因子(骨盤内操作を含む手術,放射線治療)が妊孕性に影響したかどうかについては検出力不足であるとされている。
2.消化器がんに対する根治的治療に伴うもの
消化器がん原発巣の治療に伴う副次的な妊孕性障害としては,手術,周術期放射線治療,周術期化学療法に伴うものがそれぞれ報告されている。
2-1.手術療法について
手術に伴う妊孕性障害については,腹膜反転部以下の骨盤操作を含む直腸切除術において,骨盤神経叢損傷に伴う性機能障害(男性の勃起・射精障害),卵管癒着に伴う女性妊孕性障害が報告されている。
性機能障害のリスクについて,男性患者の5〜88%において骨盤神経叢障害に伴う勃起・射精障害が報告されている2)。一方,女性の性機能障害については十分知られていないが,Hor らは潰瘍性大腸炎,リンチ症候群,家族性大腸腺腫症に対して回腸パウチ−肛門吻合を伴う全結腸切除術(ileal pouch-anal anastomosis:IPAA)を受けた女性127 人に対して電話によるアンケート調査を実施し,性機能への影響が一部の患者に認められたものの,手術適応を考慮するにあたっての影響は大きくないと結論している3)。
妊孕性障害については,女性の潰瘍性大腸炎および家族性大腸腺腫症患者を対象としたIPAA 施行によりリスクが上昇することが報告されている4)。骨盤内癒着による卵管癒着が原因と考えられているが,これに対して腹腔鏡下手術によりリスクが低下する可能性も報告されている3, 5)。一方,結腸・直腸がん患者を対象とした手術のうち結腸切除では明らかな妊孕性障害を生じないとされ6),結腸・直腸がん以外の消化器がん手術による妊孕性障害の報告はないものの,骨盤操作を含まない腹部手術が妊孕性に与える影響は少ないと考えられる。
2-2.周術期補助放射線治療について
周術期補助放射線治療では,性腺の被曝による妊孕性障害が男女とも明らかであるため,性腺の遮蔽が必要である。日本では直腸がんに対する骨盤領域の周術期放射線治療は一般的ではないが,実施を考慮する場合には卵巣位置移動術・遮蔽あるいは胚(受精卵)凍結,未受精卵子凍結,また卵巣組織凍結などが考慮されるべきである。また,子宮の被曝による子宮容積の減少あるいは血流障害により,妊娠しても流産や低体重出生,早産のリスクが高まることが知られている。
2-3.周術期補助化学療法について
周術期補助化学療法としては,食道がん・胃がん・直腸結腸がん・膵がんに対してフッ化ピリミジン系薬剤(5-FU,S1,カペシタビン),白金製剤(シスプラチン,オキサリプラチン),ゲムシタビンが用いられる。フッ化ピリミジン系薬剤およびゲムシタビンの妊孕性障害は低いと考えられる。シスプラチンは,女性において中等度の卵巣機能不全のリスクがあり,男性では一過性の無精子症を来すリスクがあると考えられている。オキサリプラチンの妊孕性障害のリスクは未確立であるが,Stage ⅡまたはⅢ直腸・結腸がんの術後補助療法としてFOLFOX 療法,XELOX 療法,カペシタビン療法を実施したケースシリーズにおいて一定割合での化学療法中無月経(9.7〜41%),化学療法終了後1 年時点での遷延性無月経(4〜16%)が認められたと報告されている7, 8)(CQ1 参照)。
3.進行がんおよびその治療による妊孕性障害
生殖器領域臓器そのものが消化器がんによって侵される病態としては,原発巣からの浸潤を来した局所進行がんと,転移・再発がんが考えられる。直腸・結腸がんの局所進行あるいは転移・再発に関しては,病巣を完全切除されれば治癒ないし長期生存が得られる可能性があることが知られている。その他の消化器がんでも転移・腹膜播種によって卵巣・子宮などが侵されるが,このような進行した病態では治癒はほとんど期待できず,その後の妊娠・分娩を期待可能な臨床経過が得られない。以上をふまえ,原疾患の根治性・予後と妊孕性温存の双方の観点を十分に考慮して治療法を選択する必要がある。侵された生殖臓器を合併切除する場合の妊孕性障害への対策については,当該領域がんの項に譲る。
参考にした二次資料
- NCCN Guidelines Genetic/Familial High-Risk Assessment: Breast and Ovarian Version 2.2016. On-line accessed Jul 2016.
- NCCN Guidelines Genetic/Familial High-Risk Assessment: Colorectal Version 1.2016. On-line accessed Jul 2016.
引用文献
- 1)
- Stupart D, Win AK, Winship IM, et al. Fertility after young-onset colorectal cancer: a study of subjects with Lynch syndrome. Colorectal Dis. 2015; 17: 787-93 (Ⅳb)
- 2)
- Traa MJ, De Vries J, Roukema JA and Den Oudsten BL. Sexual(dys)function and the quality of sexual life in patients with colorectal cancer: a systematic review. Ann Oncol. 2012; 23: 19-27 (レビュー)
- 3)
- Hor T, Lefevre JH, Shields C, et al. Female sexual function and fertility after ileal pouch-anal anastomosis. Int J Colorectal Dis. 2016; 31: 593-601 (Ⅳb)
- 4)
- Rajaratnam SG, Eglinton TW, Hider P, et al. Impact of ileal puch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis. 2011; 26: 1365-74 (Ⅰ)
- 5)
- Bartels SA, D’Hoore A, Cuesta MA, et al. Significantly increased pregnancy rates after laparoscopic restorative proctocolectomy: a cross-sectional study. Ann Surg. 2012; 256: 1045-8 (Ⅳb)
- 6)
- Spanos CP, Mamopoilos A, Tsapas A, et al. Female fertility and colorectal cancer. Int J Colorectal Dis. 2008; 23: 735-43 (レビュー)
- 7)
- Cercek A, Siegel CL, Cpanu M, et al. Incidence of Chemotherapy-induced amenorrhea in premenopausal women treated with adjuvant FOLFOX for colorectal cancer. Clin Colorectal Cancer. 2013; 12: 163-7 (Ⅴ)
- 8)
- Wan J, Gai Y, Li G, et al. Incidence of chemotherapy- and chemoradiotherapy-induced amenorrhea in premenopausal women with stage II/III colorectal cancer. Clin Colorectal Cancer. 2015; 14: 31-4 (Ⅴ)
- CQ3
- 消化器がん患者の妊孕性温存療法にはどのような方法があるか?
- 推奨グレードB
-
- 1.パートナーがいる女性患者では,胚(受精卵)凍結保存が推奨される。
- 推奨グレードC1
-
- 2.パートナーがいない思春期以降の女性患者では,未受精卵子凍結保存が考慮される。
- 推奨グレードC1
-
- 3.パートナーの有無にかかわらず,卵巣組織凍結保存は研究段階であるものの,胚(受精卵)または未受精卵子凍結保存までの時間的猶予がない場合や思春期前など排卵誘発が困難な場合,施行可能な施設において考慮される。
- 推奨グレードC1
-
- 4.女性患者では,直腸がんに対する放射線治療に対しては,照射野外への卵巣位置移動術が考慮される。
- 推奨グレードB
-
- 5.男性がん患者では,精子凍結保存が推奨される。
- 推奨グレードB
-
- 6.勃起射精障害が起こる可能性が高い手術の場合には,神経温存手術が推奨される。
背景・目的
がん患者に対する妊孕性温存療法として,その推奨レベルは異なるものの,様々な手法が考えられる。具体的な手技・手法については総論に譲るが,本CQ では,消化器がん患者独特の手技・手法があるかどうかを問うものである。
解説
抽出されたもののほとんどは症例報告であり,若年者においては化学療法や放射線治療の有害事象による卵巣機能低下,無月経,閉経,不妊症について何らかの方策を考えるべきとされるものの1-9),確実に推奨される方法は他の疾患に準ずると考えられる。消化器がん特有のものとして,直腸がんに対する放射線治療の際の卵巣位置移動術の報告が散見される10-12)。その他,化学療法前の体外受精による胚(受精卵)凍結13)や未受精卵子凍結,または,卵巣組織凍結14),男性における生殖機能温存の報告もあった15)。パートナーがいる場合は胚(受精卵)凍結が原則であるが,諸事情により採精できないなどのケースがあるので,既婚者においても未受精卵子凍結の選択肢は考慮しうる。卵巣組織凍結保存は研究段階であるものの,採卵の時間的猶予がない場合に施行可能な施設においては選択肢となるが,消化器がんによる卵巣転移の報告もあることから16, 17),凍結後の卵巣組織移植においては慎重な対応が必要である。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- NCCN ガイドライン
Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines. JNCCN. 2014; 12: 21-32
引用文献
- 1)
- Strong M, Peche W, Scaife C. Incidence of fertility counseling of women of child-bearing age before treatment for colorectal cancer. Am J Surg. 2007; 194: 765-7 (Ⅴ)
- 2)
- Frise S, Kreiger N, Gallinger S, et al. Menstrual and reproductive risk factors and risk for gastric adenocarcinoma in women: findings from the canadian national enhanced cancer surveillance system. Ann Epidemiol. 2006; 16: 908-16 (Ⅴ)
- 3)
- Cercek A, Siegel CL, Capanu M, et al. Incidence of chemotherapy-induced amenorrhea in premenopausal women treated with adjuvant FOLFOX for colorectal cancer. Clin Colorectal Cancer. 2013; 12: 163-7 (Ⅴ)
- 4)
- Kumar A, Merali A, Pond GR, et al. Fertility risk discussions in young patients diagnosed with colorectal cancer. Curr Oncol. 2012; 19: 155-9 (Ⅴ)
- 5)
- Letourneau JM, Smith JF, Ebbel EE, et al. Racial, socioeconomic, and demographic disparities in access to fertility preservation in young women diagnosed with cancer. Cancer. 2012; 118: 4579-88 (Ⅴ)
- 6)
- Lucenteforte E, Zucchetto A, Bosetti C, et al. Reproductive and hormonal factors and pancreatic cancer risk in women. Pancreas. 2011; 40: 460-3 (Ⅴ)
- 7)
- Nieuwenhuis MH, Douma KF, Bleiker EM, et al. Female fertility after colorectal surgery for familial adenomatous polyposis: a nationwide cross-sectional study. Ann Surg. 2010; 252: 341-4 (Ⅳb)
- 8)
- Elizur SE, Tulandi T, Meterissian S, et al. Fertility preservation for young women with rectal cancer–a combined approach from one referral center. J Gastrointest Surg. 2009; 13: 1111-5 (Ⅴ)
- 9)
- Wan J, Gai Y, Li G, et al. Incidence of chemotherapy- and chemoradiotherapy-induced amenorrhea in premenopausal women with stage II/III colorectal cancer. Clin Colorectal Cancer. 2015; 14: 31-4 (Ⅴ)
- 10)
- Kihara K, Yamamoto S, Ohshiro T, et al. Laparoscopic ovarian transposition prior to pelvic irradiation in a young female patient with advanced rectal cancer. Surg Case Rep. 2015; 1: 113 (Ⅴ)
- 11)
- Farber LA, Ames JW, Rush S, et al. Laparoscopic ovarian transposition to preserve ovarian function before pelvic radiation and chemotherapy in a young patient with rectal cancer. MedGenMed 2005; 7(1): 66. ID: 16369371(Ⅴ)
- 12)
- Al-Asari S, Abduljabbar A. Laparoscopic ovarian transposition before pelvic radiation in rectal cancer patient: safety and feasibility. Ann Surg Innov Res. 2012; 6: 9 (Ⅴ)
- 13)
- Azem F, Amit A, Merimsky O, et al. Successful transfer of frozen-thawed embryos obtained after subtotal colectomy for colorectal cancer and before fluorouracil-based chemotherapy. Gynecol Oncol. 2004; 93: 263-5 (Ⅴ)
- 14)
- Fabbri R, Pasquinelli G, Magnani V, et al. Autotransplantation of cryopreserved ovarian tissue in oncological patients: recovery of ovarian function. Future Oncol. 2014; 10: 549-61 (Ⅴ)
- 15)
- Hoshi M, Oebisu N, Takada J, et al. Pre-chemotherapy preservation of fertility in male patients with high-grade malignant bone and soft tissue tumors. Mol Clin Oncol. 2014; 2: 1111-4 (Ⅴ)
- 16)
- Hoekman EJ, Smit VT, Fleming TP, et al. Searching for metastases in ovarian tissue before autotransplantation: a tailor-made approach. Fertil Steril. 2015; 103: 469-77 (Ⅴ)
- 17)
- Kim DD, Park IJ, Kim HC, et al. Ovarian metastases from colorectal cancer: a clinicopathological analysis of 103 patients. Colorectal Dis. 2009; 11: 32-8 (Ⅴ)
- CQ4
- 消化器がん患者が挙児を希望した場合,治療終了後いつから妊娠可能な時期となるか?
- 推奨グレードC1
- 催奇形性を有する抗がん薬については,抗がん薬や代謝産物が体内から検出されなくなる,またはそれに相当する期間が経過するまでの避妊が考慮される。
背景・目的
消化器がん治療では,手術療法,化学療法そして放射線治療などを中心とした集学的治療が行われるが,消化器がん治療が妊娠や分娩に及ぼす影響は明らかにされていない。治療終了後に挙児を希望される患者において,がん治療終了後の妊娠可能時期は重要な検討課題である。
解説
消化器がんの患者を対象とした妊孕性に関する疫学研究はないため,消化器がんのがん治療が妊娠や分娩に及ぼす影響は明らかにされていない。また,消化器がんの治療終了後に妊娠し,正常児を分娩した症例報告はあるが1-3),妊娠可能な時期について検討した報告はない。一般的に,がん治療終了後に正常な卵巣機能が保たれていれば妊娠は可能と考えられるが,化学療法を行った場合は,抗がん薬による卵巣への影響を考慮する必要がある。また,催奇形性の問題がある抗がん薬については,抗がん薬や代謝産物が体内から検出されなくなるまで,妊娠を避ける方がよい。一般に,催奇形性を有する薬剤の治験の場合,薬剤の半減期の5 倍に女性の場合は30 日,男性の場合は90 日を加算した避妊期間が推奨されることが多い。消化器がんの術後薬物療法で用いられるフッ化ピリミジン系薬剤(5-FU,UFT,S-1,カペシタビン),白金製剤(シスプラチン,オキサリプラチン),ゲムシタビンは,いずれも動物実験において催奇形作用が報告されており,注意を要する。
参考にした二次資料
- ASCO ガイドライン
- 1)
- ASCO Recommendations on Fertility Preservation in Cancer Patients. J Clin Oncol. 2006; 24: 2917-31
- 2)
- Fertility Preservation for Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol. 2013; 31: 2500-10
- 3)
- Fertility Preservation for Patients with Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update(2013). ASCO Guidelines Data Supplement
- NCCN ガイドライン
Adolescent and Young Adult Oncology, ver.2 2014. Featured Updates to the NCCN Guidelines. JNCCN. 2014; 12: 21-32
引用文献
- 1)
- Smaldone GM, Richard SD, Krivak TC, et al. Pregnancy after tumor debulking and intraperitoneal cisplatin for appendiceal carcinoid tumor. Obstet Gynecol. 2007; 110: 477-9 (Ⅴ)
- 2)
- Elizur SE, Tulandi T, Meterissian S, et al. Fertility preservation for young women with rectal cancer–a combined approach from one referral center. J Gastrointest Surg. 2009; 13: 1111-5 (Ⅴ)
- 3)
- Hurmuz P, Sebag-Montefiore D, Byrne P, et al. Successful spontaneous pregnancy after pelvic chemoradiotherapy for anal cancer. Clin Oncol. 2012; 24: 455-7 (Ⅴ)
