頭頸部再建は,頭頸部癌術後などの欠損・変形を修復する形成外科において重要な分野である。対象疾患としては頭頸部癌・腫瘍切除後の一次再建,切除後の変形・欠損に対する二次的再建,また外傷や先天性・後天性疾患による変形・欠損に対する再建など多岐の分野にわたっている。欠損・変形した頭頸部の再建にはさまざまな組織移植を行う形成外科が大きな役割を果たしており,再建の主な担い手となっていることは周知の事実である。
本ガイドライン作成にあたり頭頸部再建が前述のように広い分野にわたるため,その中で最も多いと思われる頭頸部癌切除後の即時再建に絞ったガイドラインを作成することとした。頭頸部癌切除後の再建は頭蓋,頭蓋底,口腔,上顎,下顎,中咽頭,下咽頭頸部食道など多岐にわたっている。切除を担当する科は脳神経外科,耳鼻咽喉科,口腔外科,外科,皮膚科などさまざまである。切除の範囲などは各科により異なり,切除のガイドラインが制定されている場合もあるが,切除のガイドライン自体が存在しない疾患も存在する。形成外科は切除後の再建となるため,欠損にあわせた整容的,機能的再建を行うことが重要である。再建方法は植皮,局所皮弁,有茎・遊離皮弁などさまざまな方法 が用いられているが,その適応に関してはいまだ議論のあるところである。
再建部位による特殊性もあるため,本ガイドラインでは部位別CQ を作成することとした。切除後の再建に関してのガイドラインであるため,診断に関してはCQを作成することが難しく各部位ごとに再建担当医が重要と思われること,疑問に感じたことに関することから選択した。項目は1 章 「口腔」,2 章「中咽頭」,3 章「下咽頭頸部食道」,4章「上顎」,5章「下顎」,6章「頭蓋底」,7 章「頭 蓋」と分類しガイドライン作成を行った。CQ の検索において各部位別の検索では文献数が少ないものは頭頸部全般として調査したものを含んでいる。比較対照試験が難しい分野のため,エビデンスも高い文献などが少なく,今後変更や追加などが予想される分野と考えられる。
2013 年現在の共通する認識および今後の解決すべき問題の提示として本ガイドラインが頭頸部再建の参考になれば幸いである。
1.診療ガイドライン作成の目的と注意点
本ガイドラインは,形成外科が関わる疾患を対象とし,医療者と患者が特定の臨床状況で適切な判断を下せることを支援する目的で作成するものである。
したがって,ガイドラインの根拠にかかる情報収集(文献検索・検討)においては,「研究デザインによる視点」のみならず「臨床的意義による視点」を重視し,形成外科診療の実情を反映したものとする。
なお,本ガイドラインは,現在得られるエビデンスを集積・整理・検討し,現時点での一般診療に有用な情報提供を目的とするものであり,個別の診療(診断法,治療法)を制限するものではない。また,今後行われる(または現在進行中の)臨床研究の成果により内容が大きく変更される可能性がある。
2.作成主体
本ガイドラインは,三学会合同ガイドライン委員会が作成した原案に日本形成外科学会ガイドライン作成部会ならびに日本創傷外科学会ガイドライン作成委員会,日本頭蓋顎顔面外科学会ガイドライン作成委員会が吟味を加え,パブリックコメントを得たうえで公表するものである。
なお,本ガイドラインの内容については学会が責任を負うが,個々の患者の診療結果に関する直接の責任は治療を担当した医師,病院等に帰属すべきものである。また,保険医療の審査基準や医事紛争・医療訴訟の資料として用いることは,本ガイドラインの趣旨から逸脱することは言うまでもない。
3.作成の原則
EBM の手法に基づいて作成することを原則とした。
4.ガイドラインの対象
本ガイドラインは医師および関係する医療者を対象とした。
5.文献検索の範囲
形成外科疾患ガイドラインに用いた文献検索の範囲は,以下に示す①の範囲であるが,必要に応じて,②の範疇にあるものを加えた。
- ①MEDLINE,医学中央雑誌およびCochrane library で検索した臨床研究のメタアナリシス,の臨床研究に関する文献。
- ②上記以外の診療ガイドライン,総説,専門的見地からの意見,成書。
なお,非臨床研究に関する文献で参考となる重要な資料がある場合には引用してもよいが,推奨度
決定の判断には含めない(表2 注2 参照)。
6.文献検索期間
1982 年以降2010~11 年12 月(ガイドラインの作成開始日が項目によって異なるため)に公表されたものを検索の対象とした。文献検索期間がこれと異なるCQ では,該当するCQ で文献検索期間を別に記載した。
7.エビデンスレベル
エビデンスレベルは,研究デザインによる科学的妥当性を根拠とした(表1)。
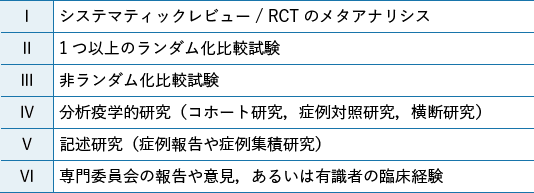
- 注)
- 個々のCQ に関して複数のエビデンスレベルがある場合には,原則として内容を吟味したうえで上記表に準じたレベルの高いエビデンスを採用した。また,どうしても判断がつかない論文については,その判断をプロに依頼した。
8.推奨度について
推奨度(表2)とは,あくまで臨床研究ならびに疫学研究などの文献から得られた情報を根拠とするものである。まず,①エビデンスレベル,②同じ結論に至るエビデンスの多さ,ばらつきの少なさ,③臨床的有効性の大きさ,④臨床上の適用性の広さ,⑤合併症の少なさ,⑥医療コストの多寡の順で検討し,さらに,総合的評価を加え決定した。
なお,本ガイドラインでは,形成外科臨床の実情をガイドラインに反映させるため,エビデンスが乏しい場合の推奨度の決定に関しては,以下の見解を参考とし,ガイドライン委員会のコンセンサスを最終判断の基準とした(表2 注3 参照)。
Canadian Task Force on Preventing Health Care. Decision Making When Evidence is Uncleare;
http:www.ctfphc.org/ctfphc&methods.htm(現在はリンク使用不可)

- 注1)
- 保険適用外もしくはその可能性があるものには(*)を付記した。
- 注2)
- 非臨床研究(作用機序を証明するような基礎実験,臨床症例の効果を裏付ける基礎研究などを含む)の文献を引用する場合には,文献欄の末尾に[非臨床研究]の旨を付記した。
- 注3)
- 表2 の括弧内に記載したエビデンスレベルは推奨度決定の際の目安を示すものである。文献的知見が不足しているものであって,表2 によると推奨度に問題が生じる場合等では,形成外科臨床の実情を勘案し,ガイドライン作成班およびガイドライン作成委員会の吟味,さらにはパブリックコメントを踏まえ,推奨度を決定した。また,エビデンスが少なく,今後の臨床研究の必要性が求められる項目については,その旨をガイドライン中に「今後の課題」として記載した。
9.改訂
ガイドラインの内容は,診療状況の進歩・変化を勘案し,5 年を目途に改訂を予定する。
10.作成に係る資金源について
本ガイドライン作成に係る資金は,内容の公平性を左右するような民間企業等からの支援を受けたものではない。また,本ガイドラインにおける勧告内容および作成に携わった委員,協力委員等は,特定の団体や製品・技術等との利害関係を有するものではなく,委員相互にも利害対立はない。
以上のことは,作成に携わったメンバーからの利益相反申告書により確認した。
